环境中毒死蜱的酶联免疫分析方法研究
魏茂琼,兰珊珊,王 丽,林 昕,张玉玲,刘宏程
(1.云南省农业科学院质量标准与检测技术研究所,云南 昆明 650222;2.农业农村部农产品质量安全风险评估实验室(昆明),云南 昆明 650223;3.大理州烟草公司祥云县分公司芮家烟站,云南 大理 672100)
【研究意义】环境中残留的农药直接影响人体健康[1]。有机磷农药使用量大[2-3],且毒性强,是环境中残留农药检出较高的农药之一[4]。毒死蜱,即O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯,又名氯吡硫磷,是一种中等毒性的有机磷农药。由于毒死蜱广泛使用及具有较好的稳定性,因此在很多国家和地区的环境介质中均已检测到其残留[3],可见,快速检测毒死蜱对保障人类身体健康非常重要。【前人研究进展】土壤是毒死蜱的主要环境介质[5],在土壤中毒死蜱可以发生吸附作用及光降解、微生物降解等作用。土壤中毒死蜱的半衰期为6.3 h 至100 d,半衰期期间带来了毒死蜱在环境中的积累。农药在田间施用后约10%作用于作物,80%~90%将进入土壤。曾阿莹等[6]研究了我国福州某蔬菜基地43 个土壤样品中有机磷类农药残留,检测结果显示,毒死蜱的最大残留量为9.77 mg/kg,检出率高达97.7%。在美洲附近的海洋沉积物,甚至在北极圈土壤样品中均检出毒死蜱[7-8]。毒死蜱可通过地表径流或田面主动排水进入河流湖泊,从而造成水体污染。调查发现,太湖水体的毒死蜱质量浓度区间为nd(未检出)~13.6 μg/L,平均值达4.8 μg/L[9]。我国《生活饮用水卫生标准》(GB5749-2006)规定毒死蜱的限值是0.03 mg/L。目前,毒死蜱农药的检测方法主要有色谱法[10-11]、色谱-质谱联用法[12]、光谱分析法[13]、电化学法[14-15]、免疫分析法[16-17]和酶抑制法[18]等。这些检测方法存在一些缺点,如色谱法仪器成本高、操作复杂、对专业人员要求高、检测周期长、前处理复杂等[19],不能应对田间地头等检测场景;光谱分析法虽然操作简单,但仪器设备昂贵;电化学法检测灵敏快速,但检测物中的氨基酸、蛋白质等成分会干扰农药检测效果[20]。【本研究切入点】酶联免疫吸附法(ELISA)以血清和抗原的特异性结合为基础,方法灵敏度高、反应时间短、专一性强,对检测人员专业性和环境的要求不高,检测装置价格低,更加适合现场大量样品的筛查。【拟解决的关键问题】本研究采用ELISA 方法快速检测环境中的毒死蜱,从灵敏度、交叉反应及有机溶剂对抗体的影响等方面研究建立间接竞争ELISA 酶联免疫检测法。通过快速检测方法实现对土壤、水体等基质中毒死蜱残留的现场监测,保障环境质量安全,为环保部门提供一种低成本、快速简便的分析方法。
1 材料与方法
1.1 试验材料
甲醇(色谱纯,德国Merck 公司),96 孔板(Costar 公司),TMB 双组份显色试剂盒(北京索莱宝科技有限公司),活性炭(DIKMA 公司),毒死蜱抗原、毒死蜱抗体(深圳市科捷实业发展有限公司),羊抗鼠IgG-HRP(Biosharp 公司),毒死蜱标准品(农业农村部环境保护科研监测所,100 μg/mL),无水醋酸钠、磷酸氢二钠、磷酸二氢钾、氯化钾、无水硫酸钠、氯化钠、硫酸、吐温-20、乙酸乙酯、二氯甲烷、二甲基亚砜、乙酸(分析纯,国药集团化学试剂有限公司)。标准溶液配制:用无水甲醇溶解毒死蜱原药,配制成1 000 mg/L 储备液,用PBS 缓冲液稀释成1 000、500、100、10、5、1 μg/L 的梯度工作溶液。
主要仪器设备:PL-9602G 酶标仪(北京普朗新技术有限公司),QY-300 电动匀浆机(江苏江阴周庄科研器械厂),N-EVAP 氮吹仪(Organomation 公司),DNP-9162 型恒温箱(上海精宏实验设备有限公司)。
土壤样品采集布点、采样要求依据《土壤环境监测技术规范》(HJ/T166),采集样品后密封、避光,可于冷冻条件下保存40 d。除去样品中的异物(枝棒、叶片、石子等)后完全混匀,过孔径250 μm 筛备用。地下水的采集及保存参考《地下水质分析方法 第2 部分:水样的采集和保存》(DZ/T0064.2-2021),饮用水的采集及保存参考《生活饮用水标准检验方法 水样的采集和保存》(GB/T5750.2 -2006)。采集的水样保存于4℃冰箱中,存储时间在3 d 以内。
1.2 试验方法
1.2.1 样品中毒死蜱的提取(1)土样中毒死蜱的提取:土样为未污染的蔬菜田土壤。样品前处理与检测供试土壤为潮土,供试土壤中毒死蜱未检出。称取土壤样品15 g,置于250 mL 锥形瓶中,加入50 mL 乙酸乙酯-乙酸混合液(体积比99 ∶1),振荡1 h,收集上清液于250 mL 锥形瓶中,加入20% NaCl 溶液20 mL,振荡10 min,静置30 min 后取上层有机相,使用无水硫酸钠脱水并浓缩至10 mL,浓缩液置于50 mL 离心管中并加入40 mg 活性炭。振荡一定时间,用滤纸过滤、浓缩至近干,用含有5%甲醇的PBS溶液定容至2.0 mL,备用。
(2)水样中毒死蜱的提取:取水样200 mL于500 mL 分液漏斗中,加入二氯甲烷30 mL,振荡提取3 min。静置分层,取下层提取液用无水硫酸钠玻璃漏斗过滤,收集。重复上述提取步骤,合并两次萃取液。将二氯甲烷萃取液置于旋转蒸发器中40 ℃水浴蒸发至近干,用含有5%甲醇的PBS 溶液定容至2.0 mL,备用。
1.2.2 ELISA 操作 采用间接竞争酶联免疫方法检测。将包被抗原稀释,加100 μL/孔,4 ℃冷藏过 夜;洗 涤3 次,250 μL/ 孔(下 同),加入封闭液200 μL/ 孔,37 ℃恒温放置2 h;洗涤,加稀释好的不同梯度毒死蜱工 作溶液(待测样本液)50 μL/ 孔,加一定稀释倍数的抗血清50 μL/ 孔,37 ℃反应1 h;洗涤,加入稀释的酶标二抗100 μL/孔,37 ℃放置30 min;洗涤,加入显色液100 μL/孔,室温避光显色10 min;加50 μL/孔终止液,测定OD450nm吸光值。加样孔(加有竞争物)测得的OD450nm值(B)与空白孔(不加竞争物)测得的OD450nm值(B0)之间的比值即为结合率。
1.3 试验条件优化
1.3.1 抗原、抗体最适工作浓度 用方阵试验法优化抗原、抗体最适工作浓度。包被抗原用pH9.6 的碳酸盐缓冲液稀释成不同质量浓度,包被于酶标板,同一个包被质量浓度对应不同的一抗质量浓度,每个处理3 次重复。
1.3.2 最佳包被条件 包被抗原吸附于酶标板的稳定程度与时间、温度有关,时间增加和温度升高在一定区间内能增加固定效果。但若过长时间的高温孵育会造成蛋白变性,可能降低包被抗原的固定效果。虽然低温不利于包被原与酶标板之间的固定效果,但低温下延长包被时间,既不影响蛋白活性,又可以增加固定效果。本试验选择了4、25(室温)、37、43 ℃共4 个温度条件,其中4 ℃包被时间要长,设12、24 h;室温下包被1、2、4 h;37℃包被 l、2、3 h;43 ℃包被 l、2、3 h。用ELISA 法检测后测定 OD450nm值,以最高OD450nm值的包被条件作为最佳包被温度和时间。
1.3.3 最佳封闭时间及竞争反应时间 为了减少非特异性,封闭中的蛋白会非特异性将ELISA 板中没有结合包被物的位点封闭,这样后续加入的抗原或抗体就不会再与ELISA 板发生非特异性结合,使ELISA 结果更加准确。因此选择37℃下加入BSA 溶液,封闭30 min、1 h、2 h,经过间接竞争ELISA 法操作,确定最佳封闭时间。竞争反应时间控制为5、15、30、45、60 min 等5 个梯度,测定OD450nm值。
1.3.4 有机溶剂最佳浓度 一抗加入前,添加含有不同体积分数甲醇的PBS 溶液于已包被的酶标板中,对照添加纯的PBS 溶液,计算抑制率,通过抑制率分析不同甲醇体积分数对结合反应的影响程度。

式中,ODmax为无甲醇时的吸光度值,ODx为加入甲醇时的吸光度值,ODmin为空白对照孔的吸光度值。
1.3.5 酶标二抗最佳浓度 将抗原、抗体按照最佳稀释度进行ELISA 操作,酶标二抗用PBS 缓冲液稀释成不同比例(1∶4 000、1 ∶8 000、1 ∶16 000、1 ∶32 000、1 ∶64 000、1 ∶128 000)。反应结束后通过多功能酶标仪读取OD450nm,选取吸光度值在1.0 左右的稀释度为最佳浓度。
1.4 方法的准确性与精密度试验
1.4.1 标准曲线建立、灵敏度及线性范围确定 在上述优化工作条件的基础上,按照ELISA方法进行操作,建立该方法的标准曲线。经过线性拟合得出该方法的标准曲线及检测限(灵敏度)和线性范围。
1.4.2 添加回收试验 将毒死蜱标准品分别添加到3 种土壤、3 种水样中,使毒死蜱最终质量浓度在土壤中为10、100、1 000 μg/kg。用建立的方法和LC-MS/MS 测定样品中的毒死蜱质量浓度,计算回收率和变异系数。
1.4.3 精密度测定 由两个试验人员使用相同的仪器设备,在1 d 内向土壤、水、蔬菜中添加100 μg/L 标样并测定3 次。由相同试验人员使用相同的试剂盒,在添加农药的当天及第1、3、5、7 天,通过向3 种土壤、3 种水样中添加100 μg/L标样并测定3 次。
1.4.4 特异性测定 对5 种毒死蜱的类似结构化合物(甲基毒死蜱、2-羟基-3,4,6-三氯-吡啶、杀螟硫磷、对硫磷、马拉硫磷)进行试验,以明确本试验方法的特异性。
1.5 方法的稳定性试验
将同一次配制的抗体及包被了抗原的板分别保存于4 ℃和-20 ℃,于保存0、1、l0、20、30、60、90、120、150、180 d 进行间 接竞争ELISA检测,OD450nm变化值<0.05,则检测结果有效。
2 结果与分析
2.1 试验条件优化结果
2.1.1 抗原、抗体最适工作浓度 以OD450nm值在1.0 附近的数值作为选择,同时参考抗原、抗体用量相对较少的质量浓度组合,作为抗原、抗体的最优工作质量浓度。根据试验结果(表1),确定包被抗原质量浓度为3.56 mg/L,抗血清(抗体)的稀释倍数为3 200 倍。在进行实际样本测定时,样品前处理的提取液可能会影响ELISA 测定结果。
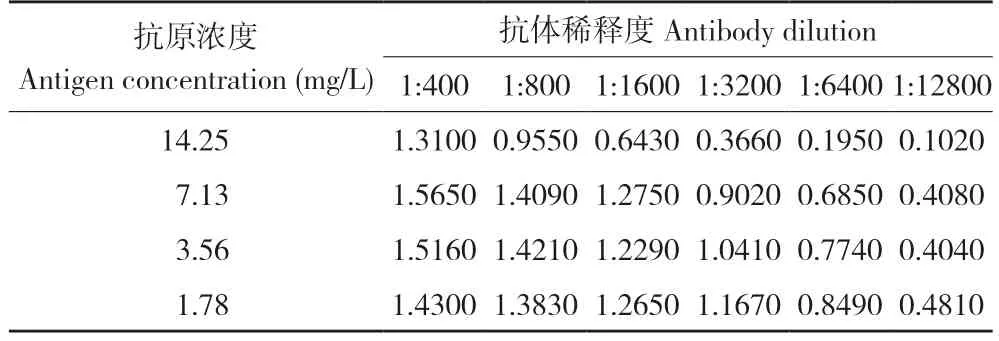
表1 抗原、抗体最适工作浓度优化结果(OD450mm)Table 1 Optimized working concentrations of antigen and antibody (OD450mm)
2.1.2 最佳包被条件 采用ELISA 法测定 OD450nm值,选择最高OD450nm值的包被条件作为最佳包被温度和时间。其中,4 ℃下包被12 h 的OD450nm值为1.132,室温下包被4 h 的OD450nm值为0.936,37 ℃下包被3 h 的OD450nm值为0.985,可见,抗原包被效果最好的是4 ℃下包被12 h。
2.1.3 最佳封闭时间及竞争反应时间 进行封闭处理时,OD450nm值随着封闭时间的延长先增加后急速降低,这可能因为蛋白在长时间的孵育温度下发生变性。吸光度值在封闭1 h 和1.5 h 的吸光度值较高,分别为1.208、1.214,考虑到时间因素,以封闭1 h 较合适。控制竞争反应时间,测定各孔OD450nm值。由图1 可知,当反应时间超过60 min,OD450nm值基本趋于稳定,因此选择60 min为最佳反应时间。

图1 竞争反应时间的选择Fig.1 Selection of competitive reaction times
2.1.4 有机溶剂最佳浓度 结果(表2)显示,甲醇浓度超过5%时,抗原抗体结合反应发生明显的抑制作用,说明过量的甲醇会抑制抗体抗原结合。因此,选择5%为最佳甲醇浓度。

表2 甲醇浓度对抗原抗体结合反应抑制作用的影响Table 2 Effect of methanol concentration on inhibition of on antigen-antibody binding reaction
2.1.5 酶标二抗最佳浓度 根据抗原最佳包被质量浓度与血清最佳稀释度的确定结果,反应结束后通过多功能酶标仪读取OD450nm,选取吸光度值在1.0 左右的稀释度为最佳质量浓度。当酶标二抗稀释度为64 000 时,吸光度值为1.089,以该稀释度为二抗工作质量浓度。
2.2 方法的准确性及精密度
2.2.1 标准曲线及灵敏度 在上述优化的体系条件下,将一系列毒死蜱标准溶液进行间接竞争抑制试验。本方法毒死蜱的标准工作曲线在质量浓度范围5.0~1 000 μg/L 间均呈良好的线性关系。以结合率B/B0为纵坐标,以不同标准溶液的质量浓度对数为横坐标,绘制标准曲线(图2)并进行回归分析,回归方程为B/B0=-24.87 logC +97.55,相关系数R2>0.99,毒死蜱的IC50=81.65 μg/L,检出限IC20为5.1 μg/L。

图2 竞争反应时间的选择Fig.2 Selection of competitive reaction times
2.2.2 样品添加回收试验 选择不含毒死蜱的土壤和水,添加10、100、1 000 μg/L 毒死蜱标准品,经过简单前处理后进行回收试验。结果(表3)显示,采用ELISA 方法测定土壤空白与PBST 空白得到的OD 值无显著差异,说明基质空白对抗原抗体结合反应不产生干扰,回收率在70%~110%之间,相对偏差在11%以内,符合检测方法的需求。同样的样品经过前处理后,用常规气相色谱法进行测定,结果回收率在70%~115%之间,相对偏差在11%以内。可见,ELISA 方法结果准确,操作简单,适用于土壤、水中毒死蜱的检测。

表3 样品添加回收试验结果Table 3 Recovery test results of samples
2.2.3 精密度分析 由两个试验人员使用相同的测定方法,在1 d 内通过向土壤和纯净水中添加100 μg/kg 的标样,测定3 次。不同人员重复测定土壤和水基质中的毒死蜱,相对偏差为4.04%和2.82%(表4)。从表5 可以看出,不同时间重复性测定不同土壤中毒死蜱的相对标准偏差在3.37%~8.23%之间;不同时间重复性测定不同水质毒死蜱的相对偏差在3.01%~6.59%之间。测试结果均符合检测方法中对相对偏差的规定。
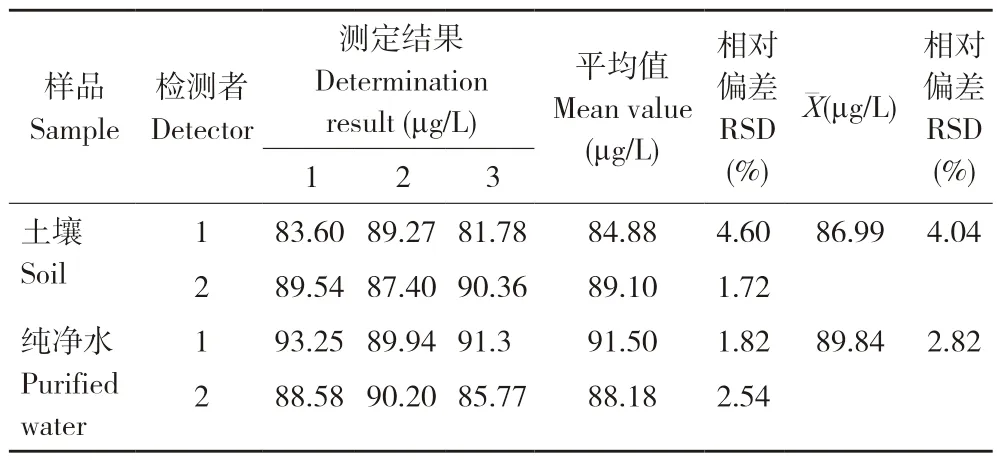
表4 两人测定毒死蜱的重复性试验结果(n=3)Table 4 Replicated test results of chlorpyrifos determination by two detectors (n=3)

表5 连续7 d 测定毒死蜱的重复性试验结果(n=3)Table 5 Repeated test results of chlorpyrifos determination in consecutive 7 days (n=3)
2.2.4 特异性分析 在最佳条件下测定5 种毒死蜱的类似结构物,结果显示,抗体与甲基毒死蜱的交叉反应率为62.58%,与2-羟基-3,4,6-三氯-吡啶的交叉反应率为11.1%,与杀螟硫磷、对硫磷、马拉硫磷的交叉反应率分别为0.09%、0.14%、0.05%。可见,甲基毒死蜱与毒死蜱的抗原决定簇结构相近,而其他农药不会对该抗体造成太明显干扰。
2.3 方法的稳定性
将同一次配制的抗体及包被了抗原的板分别保存于4 ℃和-20 ℃下,随着保存时间的增加,间接ELISA 法测定结果(表6)显示,OD450nm的变化值均小于0.05,因此,在180 d 内试剂盒储存在4 ℃或-20 ℃下都不影响使用。

表6 方法的稳定性结果(OD450mm)Table 6 Stability result of the method (OD450mm)
3 讨论
酶联免疫法具有特异性强、灵敏度高、操作简单等优点,但影响因素也很多,因此需要优化反应体系中的各种条件。本研究通过优化抗原、抗体及酶标二抗的最适浓度,在用量最少的前提下,选择OD450nm值在1.0 左右的质量浓度组合,抗体浓度过高会造成浪费及结果不稳定,浓度过低则反应结果不准确。由于反应体系涉及到蛋白,因此体系反应时间很关键,本试验研究了封闭时间及竞争时间,吸光度值随着时间的延长先增加后急速降低,这可能是因为蛋白在长时间的孵育温度下发生变性,因此选取封闭时间和反应时间均为1 h。样品提取液中的有机溶剂会影响抗原抗体的结合率,试验发现样品提取液中甲醇体积分数增加,抗原抗体结合反应没有明显被抑制,但甲醇体积分数超过5%,抗原抗体结合反应发生了明显的抑制作用,这与魏松红等[21]的研究结果一致。OD450nm在5%体积分数时取得最大值,说明过量的甲醇会降低抗体和包被抗原的结合率,使吸光度降低。TMB 与辣根过氧化物酶的浓度及反应时间对检测也有影响,后续试验将对显色方面的试剂浓度及反应时间进行研究。
土壤及水等不同基质存在的干扰物质有所差异,需要根据基质间的差异选择不同的提取方法进行毒死蜱的提取,才能更准确地检测样品中的实际农药含量[22-23]。张超等[24]研究水、土壤中毒死蜱的提取方法,认为水样采用石油醚提取、土壤采用乙酸乙酯-石油醚提取并净化为佳。本试验前期对土壤及水中毒死蜱农药的提取进行了方法摸索,选择相对简单快捷的前处理方法与酶联免疫法结合,本试验方法的建立适合黄壤、棕壤、黄棕壤,纯净水、自来水、河水等环境样品的毒死蜱检测。毒死蜱的结构类似物不会干扰检测体系,保障了方法的特异性;通过保存条件的研究明确了方法的稳定性;通过回收试验、不同人员操作及灵敏度试验确定方法的精密度。
4 结论
本试验酶优化了可快速检测环境中毒死蜱的间接竞争ELISA 试验条件,选择甲醇含量5%的PBS 提取液提取环境样品,在最佳反应条件(包被抗原质量浓度为3.56 mg/L,抗血清(抗体)的稀释倍数为3 200 倍,抗原包被效果最好的是4 ℃下包被12 h、封闭1 h,酶标二抗稀释度为64 000)基础上,建立了毒死蜱的标准曲线,毒死蜱质量浓度对数与吸光度值成线性关系,回归方程为B/B0=-24.87 logC+97.55,相关系数R2>0.99,毒死蜱的IC50=81.65 μg/L,检出限IC20为5.1 μg/L。本试验建立的间接竞争ELISA 法具有一定的特异性、稳定性和精确性,可应用于检测不同类型的土壤及水样中的毒死蜱,能够实现快速、灵敏的毒死蜱农药残留检测。

