鸭NLRP3基因真核表达特性分析
伍单丹,孙迪,汪铭书,程安春,毛赛*
(1.四川农业大学动物医学院禽病防治研究中心,成都 611130;2.四川农业大学预防兽医研究所,成都 611130;3.四川农业大学动物疫病与人类健康四川省重点实验室,成都 611130)
NLRP3炎症小体(Inflammasome)是一种胞浆内多蛋白复合体,是固有免疫系统重要组成,可识别多种病原相关分子模式(PAMPs)以及损伤相关分子模式(DAMPs),如外源性ATP、造孔毒素、细菌、病毒等,在机体天然免疫防御病原感染中发挥重要作用[1-3]。近年来,鸭肠炎、鸭肝炎、禽流感等病毒病及大肠杆菌病、沙门氏菌病、鸭疫等细菌病时有发生,严重威胁养鸭业健康发展。NLRP3炎症小体是炎症反应核心,在疾病发生发展中发挥关键作用,也是多种疾病治疗潜在靶点。研究表明NLRP3炎症小体可被口蹄疫病毒(FMDV)[4]、肠病毒71(EV71)[5]、新城疫病毒(NDV)[6]、脑心肌炎病毒(EMCV)[7]等多种病毒激活,引发机体炎症反应。但关于鸭NLRP3炎症小体研究较少,制约鸭NLRP3炎症小体在鸭传染性疾病中作用及机制研究,导致对水禽疾病发生机制研究及有效防治策略开发缓慢。本研究对鸭NLRP3基因克隆,通过生物信息学方法分析其氨基酸序列、蛋白质特征结构及遗传多样性,构建真核表达载体,为鸭NLRP3炎症小体功能研究奠定基础。
1 材料与方法
1.1 载体、细胞和抗体
真核表达载体pCAGGS为四川农业大学预防兽医研究所实验室保存。鸭胚成纤维细胞(DEF)为每次新鲜培养。ProteinFind®Anti-DYKDDDDK(Flag)Mouse Monoclonal Antibody(HT201-01)购自北京全式金生物技术有限公司;HRP标记山羊抗鼠IgG(M21001L)购自艾比玛特医药科技(上海)有限公司;Alexa Fluor®488 AffiniPure Goat Anti-Mouse IgG(H+L)(33206ES60)购自羿圣生物科技(上海)股份有限公司。
1.2 主要试剂
RNAiso Plus(9108)、PrimeSTAR®Max DNA Polymerase(R045A)、PrimeScript™II 1st Strand cDNA Synthesis Kit(6210A)、限制性内切酶EcoRⅠ(1611)、限制性内切酶BglⅡ(1606)、DL10000 DNA Marker(3584Q)均购自宝日医生物技术(北京)有限公司;DL5000 DNA Marker(MD102-01)购自南京诺唯赞生物科技股份有限公司;Endo-free Plasmid Mini KitⅡ、Plasmid Mini KitⅠ购自Omega;通用型DNA纯化回收试剂盒(DP219)购自天根生化科技(北京)有限公司;TransIntro®EL Transfection Reagent(FT201-01)购自北京全式金生物技术股份有限公司;DAPI(C0060)购自北京索莱宝科技有限公司;ECL显色液(P0018FS)购自上海碧云天生物技术有限公司。
1.3 引物设计与PCR扩增
根据NCBI鸭NLRP3基因组序列(Gene ID:101795933),利用SnapGene 2.3.2设计真核表达特异性扩增引物,送华大基因股份有限公司合成。引物序列见表1。参照RNAiso Plus(9108)说明书,从DEF细胞中提取总RNA,NanoDrop检测核酸浓度和纯度后,严格按照PrimeScript™II 1st Strand cDNA Synthesis Kit(6210A)说明书合成cDNA。以cDNA为模板,PCR扩增目的基因。PCR扩增体系为:PrimeSTAR®Max DNA Polymerase 5 μL,上游引物F 0.2 μL,下游引物R 0.2 μL,cDNA模板0.2 μL,ddH2O补足至10 μL。反应程序:预变性98℃3 min;98℃10 s,57℃5 s,72℃30 s,30个 循 环;72℃延伸7 min。
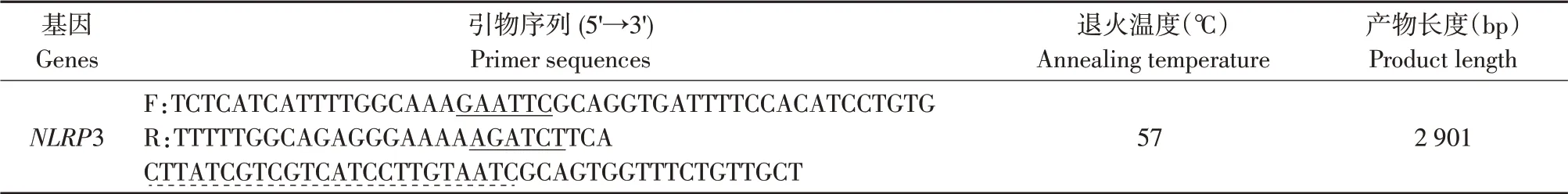
表1 引物设计Table 1 Primer design
1.4 载体构建及测序
PCR产物经10 g·L-1琼脂糖凝胶电泳检测分离,切胶纯化回收目的基因片段。同时将pCAGGS载体用限制性内切酶EcoRⅠ和BglⅡ双酶切,回收酶切产物。将线性化载体与目的基因片段进行同源重组后,转化大肠杆菌DH5α感受态细胞,涂布于含氨苄青霉素(Amp+)的LB固体平板,置于37℃培养箱过夜后挑选单菌落,进行菌落PCR鉴定。将鉴定正确的单菌落接种于Amp+LB液体培养基,继续培养后,用质粒提取试剂盒提取质粒,对质粒进行双酶切鉴定并送华大基因股份有限公司测序,将测序正确的质粒命名为pCAGGS-duNLRP3-Flag,-20℃保存备用。
1.5 生物信息学分析
应用NCBI数据库ORF Finder程序搜寻开放阅读框并推导氨基酸序列,BLAST比对分析基因相似性,SMART分析duNLRP3蛋白结构域;通过DNAMAN将测序结果与NCBI现有鸭NLPR3基因比对;应用DNAStar软件将测序结果与其他物种NLRP3基因序列比对同源序列,通过软件Mega X构建系统进化树;应用ProtParam、ProtScale、SWISS-MODEL等在线软件预测分析蛋白理化性质、蛋白结构、细胞内定位等。
1.6 细胞培养与转染
参照文献原代DEF细胞分离培养方法分离、培养DEF细胞[8]。取10日龄鸭胚胚体,剔除头、四肢和内脏,用无菌PBS清洗后,将胚体剪碎成匀浆状,然后加入0.25%胰酶置于37℃水浴锅消化5 min,经4℃4 500 r·min-1离心5 min,弃上清。用DMEM重悬、过滤沉淀,将滤液与含10%NBS的DMEM混合后接种于细胞培养板,置37℃、50 mL·L-1CO2培养箱培养。待细胞汇合度达70%~80%时,将重组质粒pCAGGS-duNLRP3-Flag转染细胞。继续培养细胞,进行后续试验。
1.7 间接免疫荧光
将DEF细胞接种于含细胞爬片的12孔细胞培养板,待细胞汇合度达70%~80%时,将pCAGGSduNLRP3-Flag转染细胞,收不同时间点NLRP3样,观察pCAGGS-NLRP3-Flag表达时间。另外,在NLRP3蛋白表达之后,接毒1 000 TCID50,通过观察NLRP3荧光变化验证其生物学活性。具体操作方法:细胞爬片收样后经4 mL·L-1多聚甲醛固定、0.25%的Triton X-100透化处理后,5% BSA 37℃封闭1 h;加入一抗Anti-DYKDDDDK Mouse Monoclonal Antibody(1∶500),4℃孵育过夜;PBST洗涤后,加入Alexa Fluor®488 AffiniPure Goat Anti-Mouse IgG(1∶400),37℃孵育1 h;PBST再次洗涤后,加入DAPI(1∶1 000)染核,37℃孵育10 min;用含50%甘油封片剂封片,于倒置荧光显微镜下观察、拍照。
1.8 Western blot
将DEF细胞接种于6孔细胞培养板,待细胞汇合度达70%~80%时,将pCAGGS-duNLRP3-Flag转染细胞。转染48 h后,加入细胞裂解液,充分裂解后离心,收集上清,经SDS蛋白凝胶中电泳分离目标蛋白。采用半湿转方式作蛋白转膜,5%脱脂奶粉4℃封闭过夜;TBST洗涤后,加入一抗Anti-DYKDDDDK Mouse Monoclonal Antibody(1∶5 000),4℃孵育过夜;TBST再次洗涤后,加入HRP标记山羊抗鼠IgG(1∶3 000),室温孵育1.5 h;TBST清洗后,ECL显色1 min,并采集成像。
2 结果与分析
2.1 NLRP3基因克隆
PCR扩增的NLRP3片段经10 g·L-1琼脂糖凝胶电泳检测,经测序长度为2 901 bp,如图1所示,可在电泳图看到靠近3 000 bp位置有一条与目的片段长度相应的明亮条带,与预期长度相符。

图1 PCR扩增鸭NLRP3基因Fig.1 Amplification of duck NLRP3 gene by PCR
2.2 真核重组表达载体构建
将回收目的基因片段与pCAGGS载体同源重组连接,获得pCAGGS-duNLRP3-Flag重组质粒。用限制性内切酶EcoRⅠ和BglⅡ进行双酶切后,获得1 159、1 700和4 698 bp 3个片段,如图2所示。NLRP3序列中有一个BglⅡ酶切位点,因此,双酶切获得3个片段,与预期结果一致。经分析,确定其中含鸭NLRP3基因编码区序列全长2 805 bp(去除残留酶切位点、Flag标签和NLRP3非编码区)。
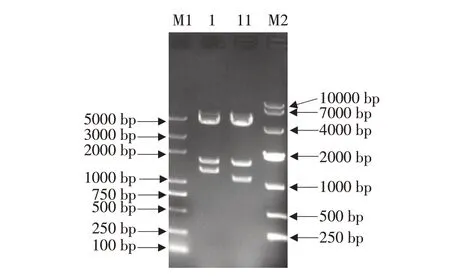
图2 重组质粒pCAGGS-duNLRP3-Flag的Eco R I和Bgl II双酶切鉴定Fig.2 Double digestion of recombinant plasmid pCAGGS-duNLRP3-Flag by Eco R I and Bgl II
2.3 生物信息学分析
2.3.1 基因序列分析
将阳性重组质粒分析测序,成功获得duNLRP3基因编码区系列。应用NCBI的ORF Finder程序进行分析,结果显示,duNLRP3基因编码区全长2 805 bp,可编码934个氨基酸。通过DNAMAN将测序结果与已报道鸭NLRP3基因序列比对发现,与NCBI登 录 号 为MH373356.1、XM_005029957和XM_005029959基因序列相似性为100%,与XM_005029958基因序列相似性为90.16%,如图3所示。通过SMART程序预测结构域,结果显示,duNLRP3蛋白有NLRP3蛋白典型的结构域,分别是位于N端第7~90位氨基酸的PYRIN结构域,位于第177~345位氨基酸的NACHT结构域,以及C端的6个LRR结构域,分别位于680~707、708~735、734~764、765~793、79~822和823~849位氨基酸,如图4所示。

图3 duNLRP3与NCBI上提交的鸭NLRP3基因序列相似性分析Fig.3 Similarity analysis of NLRP3 gene sequences between the sequenced result and the sequences submitted on NCBI

图4 duNLRP3蛋白结构域预测Fig.4 Prediction of the protein domains of duNLRP3
2.3.2 相似性分析及进化树构建
应用DNAstar软件分析基因相似性,结果显示,duNLRP3基因与Gallus(鸡属)、Anser(雁属)、Numida(珠鸡属)、Tyto(草鸮属)、Centrocercus(榛鸡属)、Melegris、Coturnix(鹌鹑)、Falco(隼属)和Strigops(鸮面鹦鹉属)NLRP3基因相似性较高,分别为84.6%、75.7%、84.8%、81.5%、84.4%、84.2%、81.9%、80.3%、80.1%;与哺乳动物和鱼类NLRP3基因相似性较低,低于55%,如图5所示。系统进化树分析显示,NLRP3基因分为哺乳动物、鸟类和鱼类3个分枝,duNLRP3位于鸟类分枝,如图6所示,进化树形态与分类学保持一致。

图5 duNLRP3与其他物种NLRP3基因相似性分析Fig.5 Similarity analysis of NLRP3 gene sequences between duck and other species
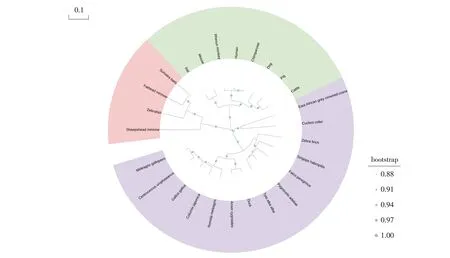
图6 duNLRP3基因进化树分析Fig.6 Phylogenetic tree of duNLRP3 gene
2.3.3 蛋白质理化性质分析
应用ProtParam分析duNLRP3蛋白理化性质,结果显示,duNLRP3蛋白含有934个氨基酸,其中亮氨酸含量最高(14.9%)、谷氨酸第二(7.3%)、甘氨酸第三(7.2%),其余氨基酸含量见表2。DuNLRP3蛋白理论分子质量为104.31 ku,分子式为C4605H7310N1270O1372S59,等电点(pI)为5.88,不稳定系数为44.17,说明duNLRP3蛋白属于酸性、不稳定蛋白。
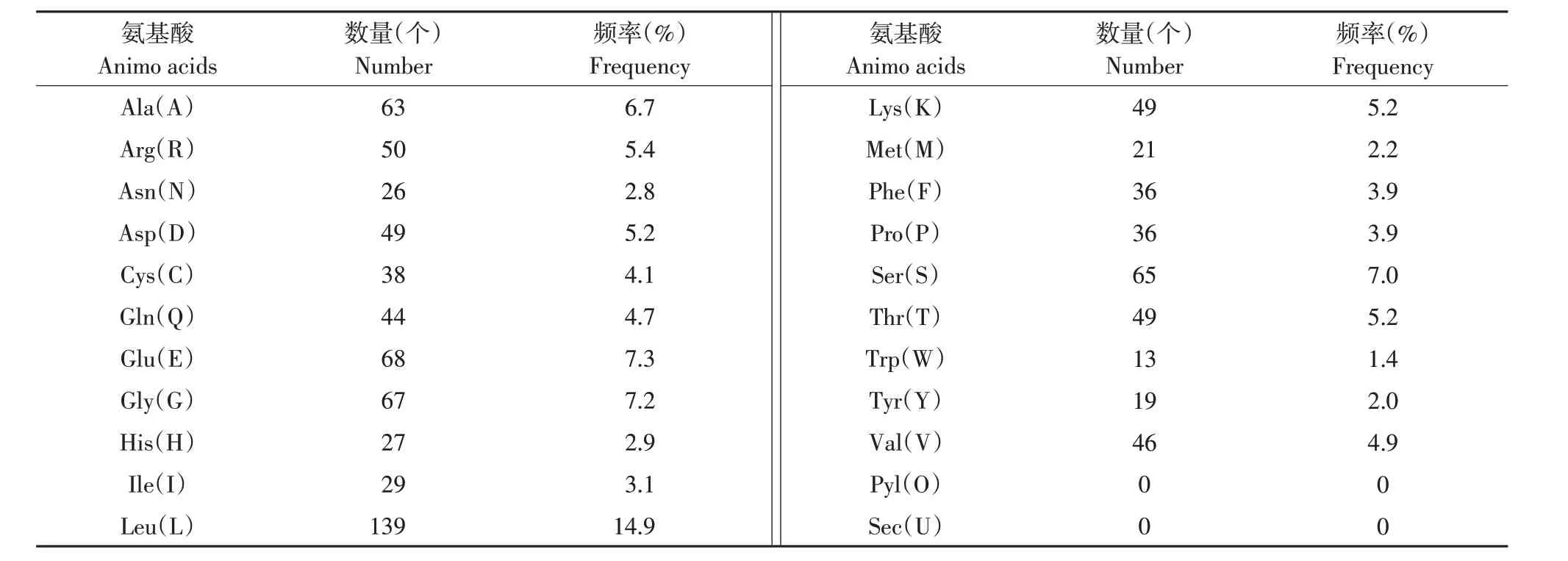
表2 duNLRP3蛋白氨基酸组成Table 2 Amino acid composition of duNLRP3 protein
应用ProtScale预测duNLRP3氨基酸序列亲/疏水性,结果显示,duNLRP3氨基酸序列最低分值为-3.256(位于第98为氨基酸,谷氨酰胺),亲水性最强;最高分值为2.467(位于第840位氨基酸,丙氨酸),疏水性最强,如图7所示。该蛋白整条肽链大部分位于亲水区域,总平均亲水性(GRAVY)为-0.175,说明duNLRP3蛋白为亲水性蛋白。
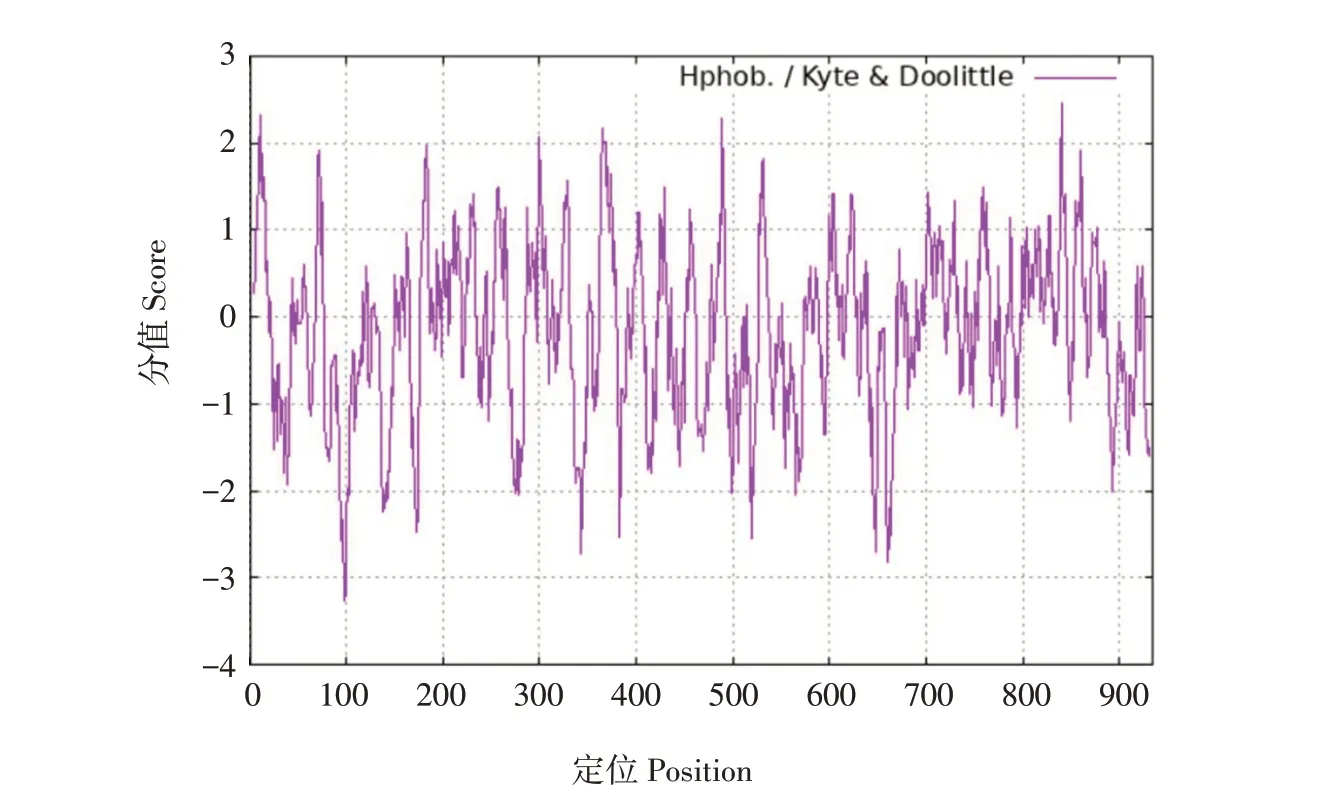
图7 duNLRP3蛋白疏水性预测Fig.7 Hydrophpbicity prediction of duNLRP3 protein
2.3.4 跨膜结构域预测
通过TMHMM Server v.2.0程序预测duNLRP3跨膜结构域,结果显示,duNLRP3蛋白无跨膜区,整条肽链位于膜外且不属于定位于膜上的蛋白,为膜外蛋白(见图8)。由图9、10可知,核定位分析结果显示入核得分为0.46、信号肽预测结果显示,有信号肽概率为3.617%,表明该蛋白定位于细胞质中,属于胞质蛋白,不是膜蛋白、核内蛋白或分泌蛋白。
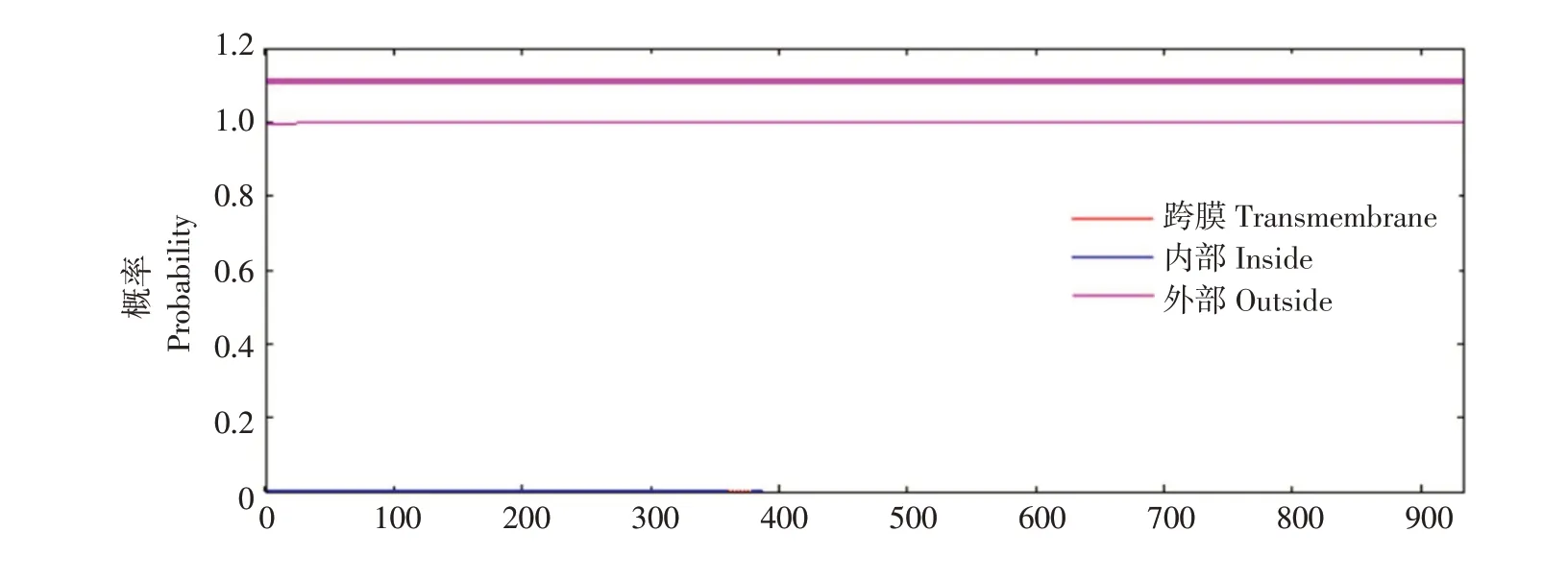
图8 duNLRP3蛋白跨膜结构预测Fig.8 Transmembrane structure prediction of duNLRP3 protein

图9 duNLRP3蛋白核定位预测分析Fig.9 Prediction of nuclear localization of duNLRP3 protein
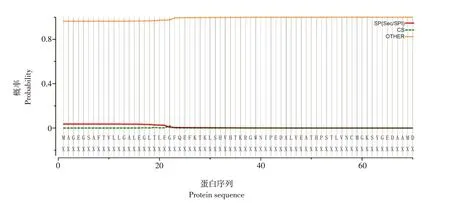
图10 duNLRP3蛋白信号肽预测分析Fig.10 Prediction analysis of signal peptide of duNLRP3 protein
2.3.5 二级三级结构预测
通过SOPMA在线程序对二级结构进行预测,结果显示,duNLRP3蛋白二级结构主要为α-螺旋(58.03%),无规则卷曲、延伸链、β-转角分别为31.26%、7.07%和3.64%,如图11所示。通过SWISS-MODEL程序对该蛋白三级结构进行预测,结果显示,duNLRP3蛋白含有α-螺旋、β-转角和无规则卷曲等复杂结构,且duNLRP3与人NLRP3蛋白高级结构高度相似,与鱼类NLRP3蛋白高级结构存在较大差异,如图12所示。

图11 duNLRP3蛋白二级结构预测Fig.11 Secondary structure prediction of duNLRP3 protein
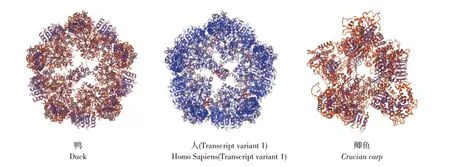
图12 NLRP3蛋白三级结构预测Fig.12 Tertiary structure prediction of NLRP3 protein in duck,human and Crucian carp
2.3.6 磷酸化位点预测分析
利用NetPhos3.1 Server在线程序预测duNLRP3蛋白磷酸化位点,如图13所示,结果显示,该蛋白共有81个磷酸化位点,其中丝氨酸磷酸化位点47个,苏氨酸磷酸化位点27个,酪氨酸磷酸化位点7个。
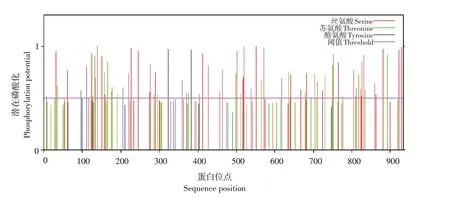
图13 duNLRP3蛋白磷酸化位点预测Fig.13 Phosphorylation sites of duNLRP3 protein
2.4 重组蛋白duNLRP3-Flag表达和鉴定
IFA检测发现,重组质粒pCAGGS-duNLRP3-Flag转染DEF细胞后,鸭NLRP3蛋白从12 h开始表达,在细胞质中呈弥散性分布,且随转染时间增加蛋白表达量逐渐增多,DHAV-1刺激后,鸭NLRP3寡聚化,在核周呈现点状聚集,如图14A所示。WB检测结果显示在104 ku有条带,与预期蛋白结果相符,如图14B所示。结果表明重组质粒pCAGGS-duNLRP3-Flag可在DEF细胞中成功表达,且表达的蛋白具有寡聚化功能。
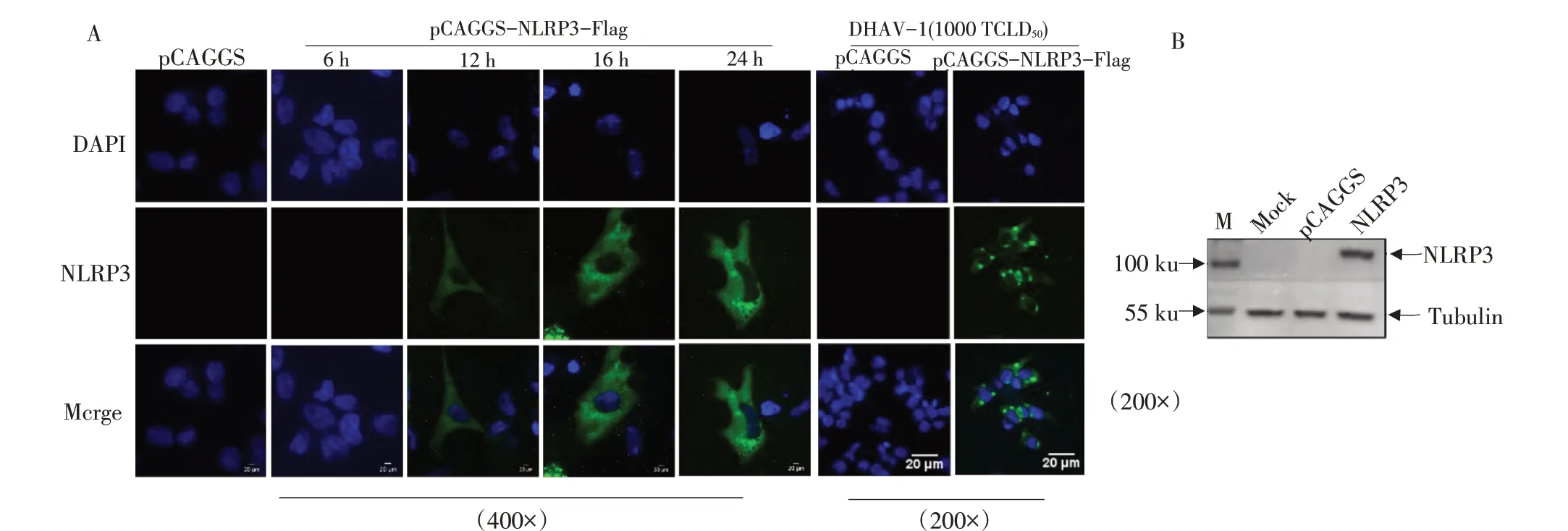
图14 重组质粒pCAGGS-duNLRP3-Flag在DEF细胞中的表达Fig.14 Expression of recombinant plasmid pCAGGS-duNLRP3-Flag in DEF cells
3 讨论
炎症小体作为炎症反应重要组成,在2002年首次被提出,是多种蛋白质组成复合体,是天然免疫系统重要组成[9]。在感知外界病原体或损伤后,传递信号给免疫系统,启动炎症。根据受体蛋白不同,炎症小体主要有NLRP3、NLRC4、AIM2、NLRP1、NLRP6等[10],由于NLRP3炎症小体可被广泛外源性和内源性刺激物激活[11],是炎症小体研究重点。NOD样受体蛋白3是NLRP3炎症小体核心蛋白,主要包含3个功能结构域:氨基(N)末端PYD结构域、中间NACHT结构域及羧基(C)末端LRR结构域[12]。本研究中扩增的鸭NLRP3基因长2 805 bp,编码934个氨基酸,具有完整PYD、NACHT和LRR结构域。因此,本试验获鸭NLRP3基因全长CDS序列,编码的蛋白在理论上具有NLRP3蛋白完整功能。研究发现,鸭NLRP3炎症小体在大肠杆菌感染及砷、钼、镉等重金属污染时参与机体炎症反应[13-16]。本研究在DHAV-1感染后,duNLRP3发生寡聚化,形成斑点样聚集。NLRP3蛋白自身寡聚化是NLRP3炎症小体活化的结构基础[17],说明鸭NLRP3蛋白具有与哺乳动物NLRP3蛋白相似的功能。
NLRP3炎症小体激活受两级信号调控,第一级信号为预激活,第二级信号为组装。磷酸化修饰贯穿于NLRP3炎症小体激活全部过程,是预激活阶段(Priming)和组装阶段(Assembly)关键分子。在NLRP3炎症小体激活Priming阶段,位于PYD和NACHT结构域之间的第198位丝氨酸(人Ser198,小鼠Ser194)发生的磷酸化修饰介导NLRP3去泛素化及自身寡聚化,促进NLRP3炎症小体激活[18]。还有一些位点的磷酸化参与维持静息状态时NLRP3蛋白的自我抑制或抑制NLRP3炎症小体组装,抑制炎症小体激活。比如,NLRP3蛋白PYD区Ser5(小鼠Ser3)和Tyr32(小鼠Tyr30)的磷酸化导致相应位点带上负电荷,在静电斥力作用下无法与ASC蛋白PYD结构域发生同型互作,抑制炎症小体组装[19-21]。LRR区Tyr861(小鼠Tyr859)和Tyr918(小鼠Tyr915)磷酸化促进NLRP3蛋白自噬降解或蛋白酶体途径降解,在NLRP3炎症小体活性调控中发挥抑制作用[22-24]。本研究发现鸭NLRP3蛋白在上述磷酸化位点相同或相近位置也存在磷酸化阳性位点,说明NLRP3炎症小体活性调控机制在不同物种间具有相似性。
不同物种NLRP3炎症小体活性存在较大差异。相比于人类和小鼠NLRP3炎症小体的高促炎活性,蝙蝠NLRP3炎症小体促炎活性较低。在病毒感染后,蝙蝠NLRP3转录水平也显著低于人类和小鼠,Ahn等研究发现蝙蝠NLRP3蛋白LRR结构域与其较低的功能活性有关,LRR-LRR相互作用力增强,导致NLRP3炎症小体活化阈值升高,降低其促炎活性[25]。鸭NLRP3蛋白LRR结构域包含229个氨基酸,形成6个LRR。相比人NLRP3 LRR序列缩短148个氨基酸,缺失过渡LRR,并减少2个经典LRR。因此,鸭NLRP3蛋白活化能力和NLRP3炎症小体活性可能与人等哺乳动物的NLRP3炎症小体存在差异,但尚需进一步试验验证。本研究通过克隆鸭NLRP3基因全长编码区后对其进行生物信息学分析,构建鸭NLRP3基因真核表达载体,为今后探讨鸭NLRP3基因在宿主防御病原感染中作用及鸭NLRP3炎症小体功能调控奠定基础。

