‘小金海棠’MxCS4基因克隆、表达分析及功能初探
李文慧,张立华,钟继亮,邵帮涛,李迎梅,黄鹏飞,李兴国,韩德果
(东北农业大学园艺园林学院,农业农村部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030)
植物在生长发育过程中需要铁、锰、铜和锌等必需微量元素,这些元素对植物正常生长发育至关重要[1]。铁元素在土壤中(特别是碱性土壤pH 7.4~8.4)溶解度较差(不足10 mol·L-1),因此缺铁是北方果树生长发育过程中常见现象。轻度缺铁导致叶绿素合成减少,光合速率降低,新叶褪绿;严重缺铁时,铁与氧发生还原反应,氧自由基增加(ROS)损伤生物合成,导致产量大幅度降低[2]。
为避免上述一系列缺铁问题发生,植物在进化过程中形成两种从土壤中吸收铁的作用机理(机理Ⅰ和机理Ⅱ)[3]。在缺铁情况下,机理Ⅰ是所有非禾本科植物吸收铁元素的有效途径,这类植物产生更多铁还原酶,将铁(Ⅲ)还原成铁(Ⅱ),从而有利于植物吸收铁。Abadía等研究发现,缺铁引起柠檬酸盐等羧酸盐增加[4],在番茄和尤力克柠檬中发现缺铁引起柠檬酸合成酶CS(Citrate synthetase)活性增加[5-6]。另外,拟南芥突变体FRD3证明柠檬酸(Citric acid)在铁长距离运输中发挥重要作用,FRD3可装载铁螯合剂(柠檬酸盐),将植物体内铁运输到木质部中[7]。
小金海棠是一种铁高效苹果属型,以往研究中已克隆得到与小金海棠有关的一些微量元素高耐受性基因[8],证实这些基因在小金海棠中表达受铁胁迫影响。刘丽丽等发现MxYSL7可能与小金海棠中铁在木质部和韧皮部运输有关[9]。韩德果等研究克隆得到MxCS1、MxCS2和MxCS3等柠檬酸合成酶家族基因,证实MxCS1、MxCS2和MxCS3这3种基因表达受铁胁迫和植物激素(IAA和ABA)影响[10]。MxCS1、MxCS2和MxCS3基因过表达拟南芥可提高转基因拟南芥对铁胁迫的耐受性[11-12]。植物激素如ABA、IAA作为感知铁胁迫的信号分子在植物铁胁迫中参与反应,小金海棠幼苗中Mx-CS1、MxCS2和MxCS3表达量均受ABA和IAA处理影响,处理后这些激素在小金海棠各部分表达量均增加。缺铁胁迫使小金海棠茎尖IAA含量上升,经IAA处理后茎尖也诱发植物体缺铁反应[13]。
前期研究已明确小金海棠柠檬酸合成酶中发挥关键作用的MxCS1,MxCS2和MxCS3基因功能[14]。然而,这个基因家族其他成员是否也具有相似功能尚不清楚。因此,发掘小金海棠柠檬酸合成酶基因家族中新基因,研究该基因在小金海棠不同部位表达水平及该基因表达与铁胁迫、ABA和IAA处理之间关系,并进一步过表达该基因,确定其对转基因拟南芥根、茎、叶中铁、锰、铜和锌元素含量、柠檬酸合成酶活性、柠檬酸和叶绿素含量等的影响,将为提高植株铁胁迫耐受性和培育耐缺铁的苹果砧木提供理论基础和实验依据。
1 材料与方法
1.1 材料
拟南芥(Arabidopsis thalianaL.)种子来自拟南芥资源中心(https://abrc.osu.edu/,俄亥俄州立大学,哥伦布,美国),小金海棠(Malus xiaojinensisCheng et Jiang)组培苗为实验室保存(东北农业大学,哈尔滨,中国)。拟南芥选用Col-0,播种在MS培养基上和营养钵中(草炭∶蛭石=3∶1),在光照培养箱中培养,14 h光照,10 h黑暗,生长温度白天22℃,夜间20℃。待长至四周时进行农杆菌侵染。在生长培养基(MS+0.3 mg·L-16-BA+0.5 mg·L-1IBA)中培养小金海棠组培苗45 d,将其转至生根培养基(MS+1.2 mg·L-1IBA)中培养50 d至生根。再将幼苗转移至Hoagland溶液中培养,直到植株长出8~9片成熟叶片。铁胁迫处理:铁胁迫处理浓度参考文献[14-16],将小金海棠幼苗浸泡于不同铁浓度(4、40和160 μmol·L-1)的Hoagland营养液中。ABA和IAA处理:将幼苗分别放入铁浓度正常的0.1 mmol·L-1ABA溶液中和0.1 mmol·L-1IAA溶液中。在处理0、3、6、9和12 h后,取对照植株以及处理植株根、木质部、韧皮部、新叶和成熟叶,将样品迅速放入液氮中冷冻处理,储存于-80℃冰箱中用于提取RNA。
1.2 MxCS4基因全长获取
根据Li等操作方法,从不同部位(根、木质部、韧皮部、新叶、成熟叶)提取RNA[17]。根据反转录操作说明书合成出第一条cDNA链,将合成好的cDNA链作为模板进行PCR扩增获得MxCS4基因完整序列。依照MdCS4(MDP0000680864)同源区域设计引物(F1:5'ATGGTGTTCTTCAGGAGCGTCACAG 3'和R1:5'TCAAGACGAAGCTGCTTTCT TGCA 3'),利用设计好的引物扩增出全长序列。采用PCR扩增方法以F1和R1为引物从小金海棠中克隆得到MxCS4基因cDNA全长。将获得的DNA片段凝胶纯化,再连接至pMD18-T载体上,然后送出测序。
1.3 实时荧光定量PCR表达分析
根据SYBR Premix ExTaqTMⅡ说明书进行Mx-CS4基因实时荧光定量PCR试验,反应体系以及运行条件参照前期研究。以苹果属ApActin基因作为内参并设计引物(ApActF1:5'CTACAAAGTCATCGTCCAGACAT 3'和ApActR1:5'TGGGATGACATGGAGAAGATT 3')。
利用设计好的定量引物(MF:5'GAATGAGAGGAATGACAGGGTTGCTG 3'和MR:5'CTGGAGG GCCATGACACCAGTG 3')对不同处理(4、40和160 μmol·L-1铁)、不同处理时间(0、3、6、9、12 h)下小金海棠不同部位(根、木质部、韧皮部、成熟叶、新叶)中MxCS4基因表达情况进行实时定量分析。使用2-ΔΔCT方法分析数据[18]。
1.4 MxCS4蛋白亚细胞定位
利用PCR扩增方法,在MxCS4基因开放阅读框序列两端加上HindIII和BamH I双酶切位点,随后将该序列插入pSAT6-GFP-N1载体中。随后参照韩德果等研究方法[16],利用基因枪法将质粒导入洋葱表皮细胞,利用激光共聚焦显微镜观察定位结果。
1.5 拟南芥转化与鉴定
构建用于拟南芥转化的表达载体,通过PCR扩增在MxCS4基因5'和3'末端加上SacI和XbaI两个限制酶切位点,将PCR得到的目的片段连接至克隆pMD18-T载体上。测序结果无误后对连有MxCS4基因序列的pBI121和T载体进行双酶切,然后胶回收并用T4连接酶进行载体连接,构建pBI121-MxCS4载体,最后将pBI121-MxCS4载体转入菌株为GV3101农杆菌中。
花序浸渍法将MxCS4基因转入拟南芥中[19],培养3~4周,待种子成熟后,收取T1代种子,干燥器中存放2周。再经含有50 μg·mL-1卡那霉素的MS筛选培养基对转基因拟南芥种子作初步筛选。经培养和筛选得到纯合体T3代植株,用于进一步分析。试验设3次重复。
1.6 转基因拟南芥铁胁迫耐性分析
分别从T3代转基因拟南芥株系(OE-5和OE-6)和野生型拟南芥株系中筛选出60株生长状况相符幼苗,每组20株,转移至铁浓度分别为4、100和400 μmol·L-1的MS培养基上培养,12 d后观察各株系表现型。
1.7 叶绿素含量、柠檬酸含量和柠檬酸合成酶活性测定
根据关锦毅等试验方法[20],分别测定T3代纯合体转基因拟南芥株系(OE-5和OE-6)和野生型拟南芥(WT)叶片中叶绿素含量。利用高效液相色谱法测定柠檬酸含量[21],然后再分别测定转基因拟南芥株系以及野生型拟南芥株系叶片CS活性[22]。
1.8 铁、锰、铜和锌浓度测定
据韩德果等试验方法,分别称取野生型和T3代纯合体转基因株系(OE-5和OE-6)拟南芥100~200 mg根、茎、叶和整株,而后将样品放到装有2 mL硝酸的密封聚四氟乙烯容器中。将容器加热到150℃,加热90 min,随后保持150℃恒温放置6 h。待容器冷却至室温后,利用电感耦合等离子体发射光谱法(SPS1200 VR;Seiko,Tokyo,Japan)测定金属元素浓度。
2 结果与分析
2.1 小金海棠MxCS4基因克隆与序列分析
序列分析结果显示,MxCS4基因全长为1 218 bp,这个基因编码出一个含有405个氨基酸的蛋白质,ExPASy软件预测结果显示,编码蛋白分子质量为44.9 ku,等电点为6.15,且MxCS4蛋白含有一个具有植物特异性的高度保守氨基酸序列LERPKSVT(即LERP-box),LERP-box被视为植物柠檬酸合成酶的标识[23]。
为研究植物CS蛋白间进化关系,利用DNAman软件分析来自不同物种的9个CS蛋白(见图1)。如图1 A所示,MxCS4氨基酸序列在C端包含有一个保守柠檬酸合成酶结构域。所有9个CS蛋白结构域中均含有CS植物特异性LERP-box序列。此外,对来自于9种植物的CS蛋白序列进行系统发育树构建(见图1B),结果显示MxCS4、MdCS4(苹果Malus domesticaM.,MDP0000680864)、PbCS4(白梨Pyrus bretschneideriR.,XP_009365050)和Mx-CS1(小金海棠Malus xiaojinensisC.,ADL62695.1)同源性较强,聚为第一组。PpCS(桃Prunus persicaL.,AAL11504)、PsCS1(山杏Prunus sibiricaL.,AIU64849)和CsCS(橙Citrus sinensisL.,KDO46047)被分到第2组。AtCS4(拟南芥A.thalianaL.,AAM62868.1)和DcCS3(胡萝卜Daucus carotavar.sativaH.,AB017159.1)为第3组。
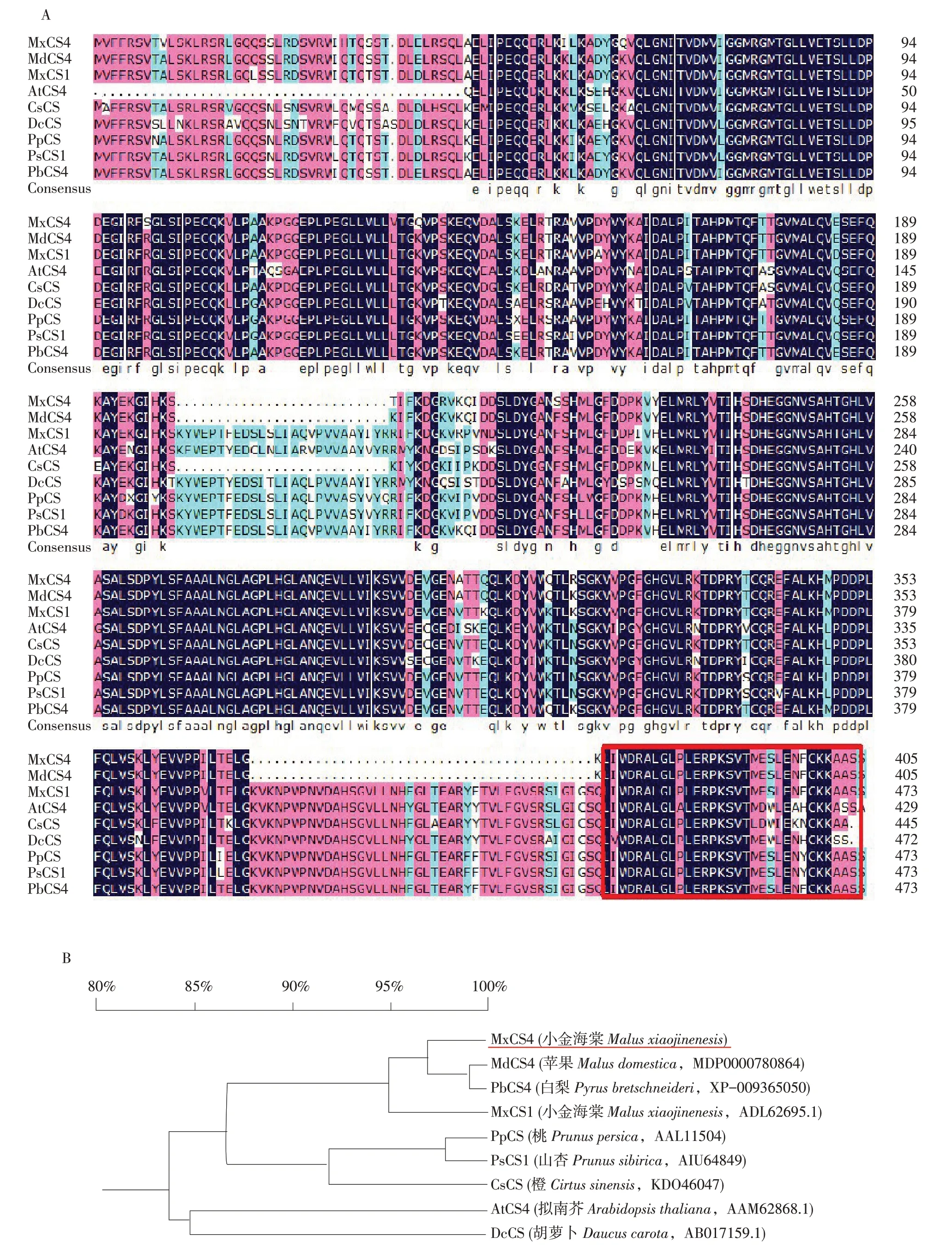
图1 MxCS4蛋白与其他CS蛋白序列比对(A)和系统发育树(B)Fig.1 Mutiple alignment(A)and phylogenetic tree(B)of MxCS4 protein and other CS proteins
2.2 MxCS4基因在苹果属小金海棠植株中的表达分析
通过实时荧光定量PCR方法研究小金海棠中各组织MxCS4基因在不同处理条件下表达情况。在正常铁浓度(40 μmol·L-1)处理下,MxCS4在根、叶和韧皮部中表达量较高,在木质部中表达量最低(见图2A)。在低铁(4 μmol·L-1)胁迫处理下,MxCS4在新叶和根中表达量增加,9 h时达到最高,之后表达量持续降低,在成熟叶中表达量随时间逐渐降低,在12 h时降到最低。IAA和ABA处理时,MxCS4在新叶和根中表达情况与低铁胁迫处理时一致,均在9 h时达到最高。然而,在高铁(160 μmol·L-1)胁迫处理下,MxCS4在新叶和根中表达量随时间增加均呈下降趋势,在成熟叶中呈先升后降趋势,在9 h时表达量达到最高。在IAA和ABA处理下,MxCS4在成熟叶中表达情况与其他各部位表达情况相同(见图2C)。
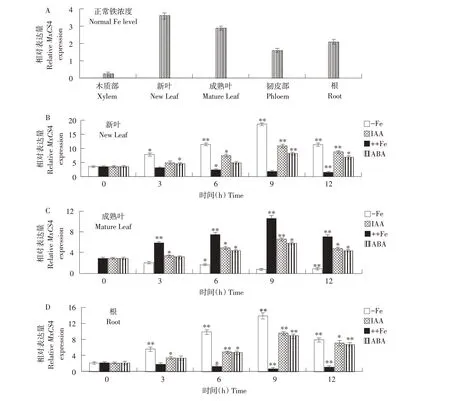
图2 小金海棠MxCS4在不同组织以及不同处理下表达模式Fig.2 Expression pattern of MxCS4 in different organs and different treatments in Malus xiaojinensis
2.3 MxCS4亚细胞定位情况
为进一步研究MxCS4基因功能,构建瞬时表达载体,采用基因枪法进行洋葱表皮亚细胞定位研究。结果表明,在洋葱细胞中MxCS4蛋白仅定位在细胞膜上(见图3),初步判断MxCS4基因表达的蛋白定位在细胞膜上。
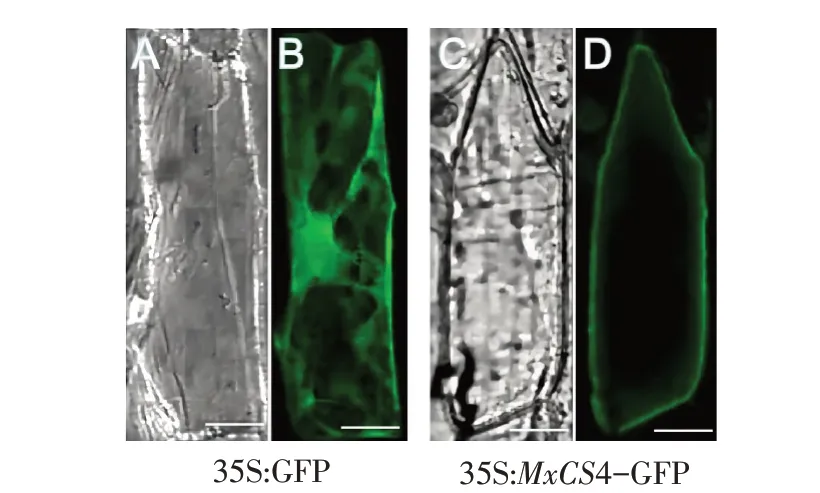
图3 MxCS4亚细胞定位Fig.3 Subcellular localization of MxCS4
2.4 MxCS4基因过表达提高转基因拟南芥对铁胁迫的耐受性
为探究植物中MxCS4基因在铁胁迫中发挥的作用,构建pBI121-MxCS4载体并利用农杆菌导入拟南芥获得转基因拟南芥。以野生型拟南芥作为对照,从转基因拟南芥中挑选出12个转基因拟南芥株系进行RT-PCR分析,分析结果表明其中6个株系(OE-2、OE-3、OE-5、OE-6、OE-7、OE-9)表现为阳性(见图4A)。
从表型上看,在正常铁浓度(100 μmol·L-1)处理下,野生型拟南芥和转基因拟南芥无明显差异(见图4B),各株系拟南芥均生长较良好。但在低铁(4 μmol·L-1)胁迫处理下,野生型拟南芥表现出明显萎缩及黄化,转基因拟南芥株系(OE-5和OE-6)并无明显萎黄现象。在高铁(400 μmol·L-1)胁迫处理下,野生型拟南芥生长发育情况也较转基因拟南芥株系(OE-5和OE-6)差。
高铁和低铁胁迫处理下,转基因拟南芥(OE-5和OE-6)中叶绿素含量与野生型拟南芥相比显著升高(见图4C),OE-5、OE-6柠檬酸合成酶活力与WT相比极显著升高,低铁胁迫下增长量高于高铁胁迫(见图4D),所有拟南芥柠檬酸含量呈现趋势与柠檬酸合成酶活力一致,但转基因拟南芥(OE-5和OE-6)柠檬酸含量极显著升高(见图4E)。
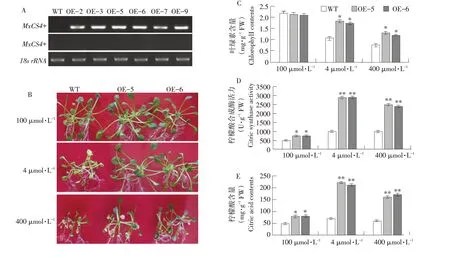
图4 MxCS4超表达提高转基因拟南芥的耐铁胁迫能力、叶绿素和柠檬酸含量、柠檬酸合成酶活性Fig.4 Overexpression of MxCS4 in transgenic A.thaliana contributed to improved Fe stress tolerance,and increased citrate synthase activity,chlorophyll and citric acid content
2.5 过表达MxCS4基因提高转基因植株中铁、锌、铜、锰元素含量
对野生型与转基因拟南芥(OE-5和OE-6)根、茎、叶和整株金属元素含量比较可得出,在叶(见图5A)、茎(见图5B)、整株(见图5C)、根(见图5D)中铁、铜、锌和锰4种元素含量均显著高于野生型拟南芥(WT)。转基因植株各部位铜元素含量也均高于野生型植株,但仅在根中达到显著差异。以上结果表明,MxCS4基因过表达提高柠檬酸合成酶含量,最终在转基因植株中形成更多柠檬酸,提高植株对金属元素的吸收和转运,促进金属离子,特别是铁、锌、锰和铜转运。
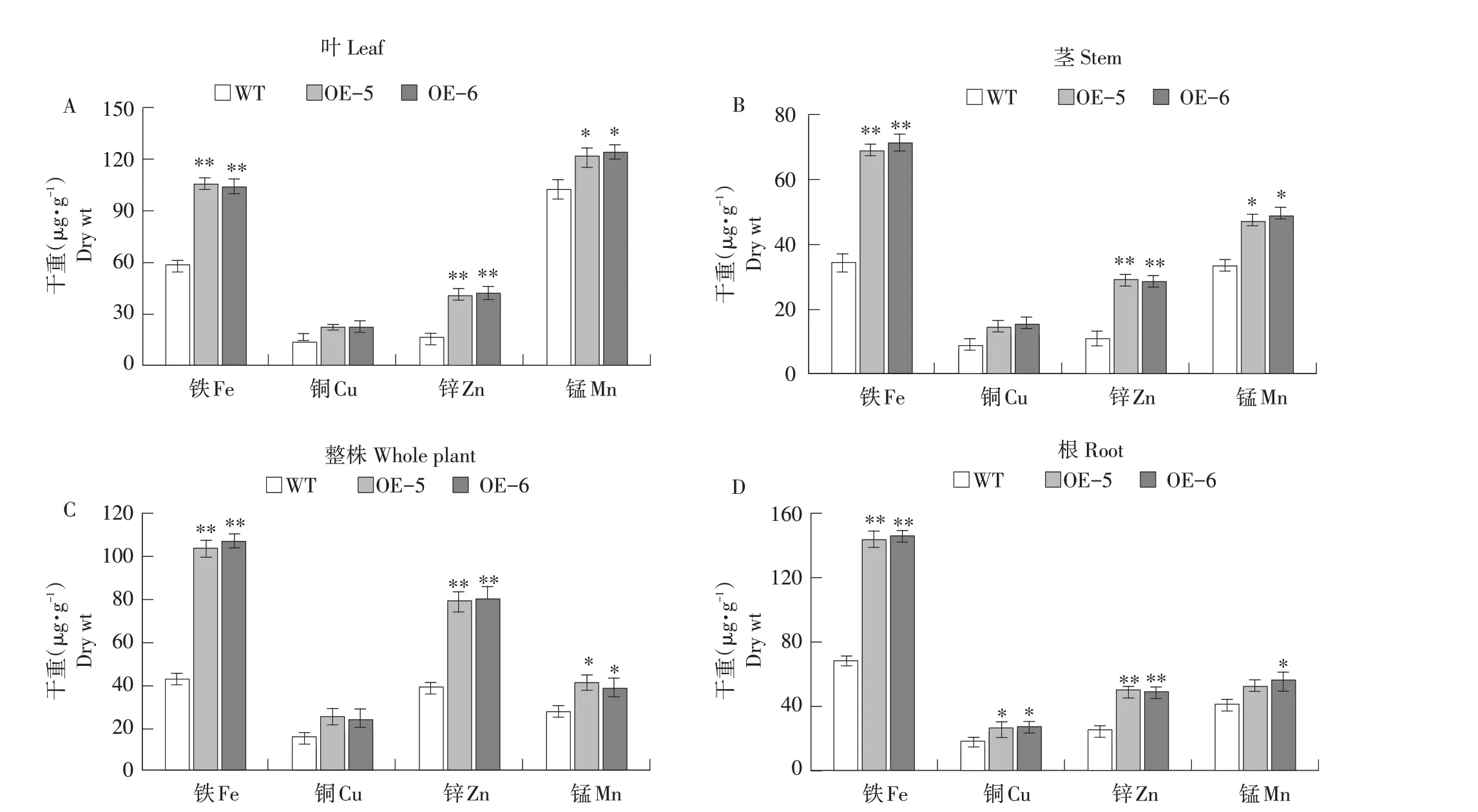
图5 超表达MxCS4提高转基因植株中铁、铜、锌、锰含量Fig.5 Overexpression of MxCS4 increased the contents of Fe,Cu,Zn,Mn in transgenic A.thaliana
3 讨论与结论
序列比对分析结果表明,MxCS4是CS家族成员,首次被克隆验证,与MdCS4、PbCS4、MxCS1、PpCS、PsCS1、CsCS、AtCS4、DcCS之间有较强同源性(见图1)。所有CS家族在C端包含一个保守CS结构域[24]。系统发育树结果显示,CS家族基因具有高度保守进化过程,CS家族基因普遍分布于苹果、桃、杏、橙、胡萝卜和拟南芥中,且参与包括金属转运在内的多种过程。
MxCS4基因在韧皮部中表达量略低于叶和根,MxCS4在木质部中表达量最低(见图2A)。这种表达现象显示,MxCS4在活跃部位中发挥重要作用,与MxCS1、MxCS2和MxCS3表达情况一致。铁胁迫时,新叶、根、成熟叶中MxCS4表达均受到显著影响。铁胁迫处理3、6、9 h后,新叶(见图2B)和根(见图2D)中MxCS4表达量均有所增加,12 h后时表达量下降。12 h时MxCS4表达水平有所下降,可能是此时已有较大量CA积累。在低铁胁迫处理下,小金海棠新叶和根MxCS4表达上调,加速CS和CA合成。在高铁胁迫处理下,Mx-CS4在小金海棠新叶和根表达下调,减少CS和CA合成,从而减弱植株从环境中吸收铁的能力,这与之前报道结果一致[25]。在成熟叶中MxCS4表达模式与新叶和根呈相反趋势(见图2C),铁胁迫处理时下调,高铁胁迫处理时上调。植物在低铁环境下,优先向新叶和根等活性部位提供铁,这些部位中MxCS4表达上调,而成熟叶表达下调。
IAA、ABA处理时,MxCS4在小金海棠中表达均受到显著影响,MxCS4可能在调控小金海棠铁胁迫反应中发挥作用。IAA和ABA影响渗透物质、叶绿素含量积累,增强抗氧化酶活性,被认为是植物中铁胁迫的信号物质[26],缺铁诱导小金海棠茎尖IAA含量升高,而IAA含量上升引起茎尖缺铁反应。IAA和ABA处理均影响MxCS4表达,因而推测MxCS4可能影响铁元素转运。而MxCS1、MxCS2和MxCS3表达水平受IAA影响较大,受ABA影响较小。
亚细胞定位研究证实MxCS4蛋白仅定位在细胞膜上(见图3)。Slabas等研究表明,柠檬酸合成酶蛋白预期定位结果是线粒体、过氧化物酶体和乙醛酸循环体[27]。猜测MxCS4蛋白具有某些影响其定位结果的未知区域,具体原因需进一步研究。
MxCS4基因有可能通过调节柠檬酸合成,帮助植物在铁胁迫下生存。MxCS4过表达拟南芥中柠檬酸合成酶活性和柠檬酸含量均较高(见图4),有利于低铁环境中铁吸收。当植物处于高铁胁迫作用下,高活性柠檬酸合成酶有助于合成柠檬酸,螯合多余铁以减轻毒害,此为MxCS4过表达提高拟南芥对高铁胁迫耐受性的原因。铁是叶绿体必需成分,所以高浓度柠檬酸诱导高浓度铁,导致MxCS4过表达的拟南芥中叶绿素含量相对较高,促进铁、锰、铜和锌含量增加(见图5)。
综上所述,本研究结果与之前小金海棠柠檬酸合成酶家族基因MxCS1、MxCS2和MxCS3研究结果一致。在低铁(4 μmol·L-1)胁迫处理下,Mx-CS4基因表达量变化较快,在9 h达到峰值,幅度较高(5.2倍),与MxCS1基因(24 h达到峰值,幅度4.1倍)、MxCS2基因(12 h,4.6倍)、MxCS3基因(10 h,4.3倍)相比,达到最大值时间较快,提升幅度较大。亚细胞定位显示该基因定位在细胞膜上,与MxCS2一致。MxCS4过表达拟南芥中柠檬酸含量(215 mg·g-1FW)和铁元素含量(128 μg·g-1FW)也高于MxCS1过表达拟南芥(137 mg·g-1FW和95 μg·g-1FW)、MxCS2过表达拟南芥(156 mg·g-1FW和105 μg·g-1FW)和MxCS3过表达拟南芥(196 mg·g-1FW和115 μg·g-1FW)。因此MxCS4比Mx-CS1、MxCS2和MxCS3更可能是MxCS基因家族关键基因。转基因试验证实MxCS4过表达提高拟南芥对铁胁迫的耐受性,该研究将有利于培育耐缺铁的苹果砧木。对MxCS4和MxCS家族成员其他功能还有待进一步研究。

