磁共振与CT在布鲁氏杆菌脊柱炎患者中的诊断价值对比*
袁慧莹
河南大学第一附属医院医学影像科,河南 开封 475000
布鲁氏菌病是由布鲁氏菌引起一类人畜共患疾病,具有传染性,在我国羊是该疾病的主要传染源,病菌主要通过破损的皮肤、粘膜以及消化道进入人体,引发布鲁氏菌病[1]。布鲁氏杆菌性脊柱炎是由于布鲁氏杆菌入侵脊柱进而引起的一类脊柱炎症性疾病。腰部、腿部及臀部的疼痛是其主要临床表现。布鲁氏杆菌性脊柱炎的临床表现和腰椎间盘退行性病变临床表现相似,故此在临床中常常混淆,鉴别有一定难度。依据发病的病程布鲁氏杆菌脊柱炎可分为急性期、亚急性期和慢性期3个病程阶段。人体感染布鲁氏杆菌后,随着血液的流动,病菌到达血流较为丰富的地方,病菌首先侵袭软骨终板,破坏其完整性,随着终板损伤的加重,破坏会累及整个椎体以及邻近椎间盘,甚至形成椎旁脓肿[2]。临床中常用CT及磁共振(MRI)对布鲁氏杆菌脊柱炎进行诊断前的检查,评判病变的程度,预测预后的恢复情况。本研究通过回顾性分析探究MRI和CT在诊断布鲁氏杆菌脊柱炎的诊断价值及不同。
1 资料与方法
1.1 一般资料
选取河南大学第一附属医院2019 年12 月—2020 年12月期间确诊的80例布鲁氏杆菌脊柱炎患者,并且符合布鲁氏菌脊柱炎的诊断标准。80 例患者年龄在42~73 岁之间,平均年龄(55.6±1.5)岁,男性47例,女性33例;其中53例患者有0.4~26.1 年的畜牧养殖史,平均畜牧养殖史3.2年;20例患者有幼畜接生史;剩下7例有羊肉、牛肉或乳制品摄入史。其中急性期18 例,亚急性期34 例,慢性期28例。
1.2 诊断标准
依据2009年修订的《布鲁氏菌病诊断标准》对所有患者进行诊断:(1)流行病学调查,有确切的感染途径及接触史。(2)临床表现:发热,腰腿部疼痛及全身的临床症状。(3)实验室检测结果:平板凝集试验或虎红平板凝集试验阳性。(4)布鲁氏菌血培养阳性。(5)试管凝集实验或者补体结合实验阳性,同时符合(1~3)者为可疑,同时满足前3条以及加上(4)或(5)可确诊。
1.3 纳入及排除标准
纳入标准:(1)符合《布鲁氏菌病诊断标准》诊断为布鲁氏菌病感染。(2)主要症状以腰腿疼痛为主,可伴有或不伴有其他的临床症状。(3)家属及患者签署知情同意书。排除标准:(1)有确切的腰腿部外伤、肿瘤以及先天性脊柱病变。(2)有明显的老年退行性改变。(3)身体内有金属置入物体等不宜完善MRI检查。(4)幽闭空间症及其他不能配合完成MRI检查。所有患者或其法定授权人均签署知情同意书。本研究通过医院医学伦理委员会批准通过。
1.4 检查方法
80 例患者均进行CT 及MRI 检查。检查前准备:对所有进行影像学检查的患者进行详细的病史搜集。并向患者交代本次检查的目的,征得患者及家属的同意并签署知情同意书。采用64层螺旋CT行颈、胸、腰椎的连续螺旋CT扫描。扫描参数:管电压120 kV,管电流200 mA,层厚1.25 mm,层间距0.625 mm。采用3.0T 超导型磁共振扫描仪行MRI检查,依次对颈椎、腰椎、胸椎进行扫描。所有患者均行快速自旋回波(TSE)、矢状面T1WI、矢状面T2WI、脂肪抑制(STIR)、横轴面T2WI 扫描。所有的影像学结果均由影像学两位高年资医师共同评估,并详细记录病变分布情况。
1.5 统计学方法
采用SPSS 25.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t 检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CT检查布鲁氏杆菌脊柱炎患者结果
80例布鲁氏杆菌性脊柱炎中,累及单个椎体13例,2个及2 个以上椎体受累67 例(83.75%);其中颈椎病变8例,胸椎5 例,骶髂关节3 例,腰椎病变65 例,腰椎L4、L5椎体受累最多,合并椎旁及椎管内软组织影像。其中急性期1 例,亚急性期22 例,慢性期24 例。CT 的表现为椎体破坏的周围有增生硬化,发生小破坏灶,见图1。
图1 布鲁氏杆菌患者脊柱CT表现
2.2 MRI检查布氏杆菌脊柱炎患者结果
常规MRI 共发现病变椎体94 例,其中腰椎64 例(68.1%),胸椎24 例(25.5%),颈椎6 例(6.4%)。常规MRI 中病变椎体T1WI 表现呈混杂低信号,T2WI、FLAIR均呈现混杂高信号,同时可见破裂的软骨终板、破坏及邻近关节间隙变窄,见图2。其中急性期14例,亚急性期32例,慢性期25例。
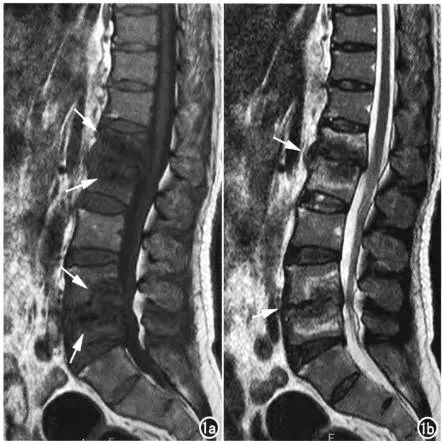
图2 布鲁氏杆菌患者脊柱MRI表现
2.3 CT、MRI和血清学指标结果
CT、MRI和血清学指标在诊断布鲁氏杆菌脊柱炎中的对比。结果提示在慢性期CT 和MRI 在诊断布鲁氏杆菌性脊柱炎中,差异无统计学意义(χ2=0.163,P=0.686),在亚急性期MRI 诊断布鲁氏杆菌性脊柱炎优于CT,差异有统计学意义(χ2=8.995,P=0.003),在急性期MRI 诊断布鲁氏杆菌性脊柱炎优于CT,差异有统计学意义(χ2=19.314,P=0)。
3 讨论
布鲁氏杆菌为一类革兰氏阴性的短小杆菌,主要感染牛、羊、猪等牲畜;可引发牲畜雌性流产,且该流产为传染性。当人类食用布氏杆菌污染的乳制品及肉制品时可被感染。布鲁氏杆菌病为一种人畜共患疾病,随着当今畜牧业、餐饮业的发展,该疾病的发病率呈现逐年上涨的趋势。布鲁氏杆菌病是一种全身性疾病,使身体内的多个器官受损,约有1/3 的病变涉及到骨骼[3]。血清学检查为布鲁氏杆菌诊断的“金标准”,临床中还可综合患者的临床及病理检查结果进行诊断。布鲁氏杆菌脊柱炎的临床表现主要有发热、多汗、关节或腰背部的持续性疼痛等。布鲁氏杆菌性脊柱炎的病理生理表现为肉芽肿性炎的炎症病变,在病变过程中主要以细胞免疫为主,且主要的细胞为淋巴细胞浸润。这就导致在疾病的早期不易出现椎间盘的破坏[4]。在整个疾病的过程中,布鲁氏杆菌性脊柱炎的病变比较局限,在原有骨质遭到破坏时,同时出现新生骨组织,且新生的骨组织为不规则性,且新生骨质的增生速度大于骨质破坏的速度,这就引起病变椎体呈现较为完整或仅仅出现楔形改变,骨质破坏不明显[5]。对于处于急性期的布鲁氏杆菌脊柱炎主要以终板炎性病或骨髓炎为主,椎体或椎间盘无确切病理改变,无骨质增生及硬化表现,在亚急性期与慢性期骨质破坏与骨质修复并存[6]。
布鲁氏杆菌脊柱炎患者CT检查中的表现如下。(1)椎体改变:病灶多为5 mm 直径以内的多发的、类圆性的低密度病灶。椎体变形,椎体边缘虫蚀样的骨质破坏,在破坏灶的边缘可见不同程度的新生骨,在新生骨质内又可见新的病灶,可伴有骨质硬化,无明显的死骨表现;相邻的椎体边缘会出现骨赘形成,在新生骨赘和破坏灶形成花边椎[7]。少数的病灶见于椎体中心。(2)椎间盘的改变:椎间盘变窄,密度增高,在相邻的椎体的上下缘骨质破坏,部分椎体上下缘形成骨桥。(3)椎小关节改变:关节间隙变窄、关节面破坏和关节面骨质增生硬化[8]。(4)韧带改变:前纵韧带和棘间韧带的钙化及骨化[9]。(5)椎盘脓肿:椎体的破坏区和椎旁软组织影相连接,形态多数不规则,但是界限清晰。(6)骨膜变化:椎体骨膜的变化为,椎体骨膜增厚,呈现由中心向周边的膨出趋势,椎体出现不均匀的密度,出现梭状变形;在椎体边缘的骨膜出现增生性肥厚,易形成“唇状”的骨赘,新生的骨赘和破坏的骨质病灶,呈现出“花边椎”的特征性改变。钙化骨膜与椎体的界限仍清晰可见。相邻椎体骨赘可形成椎体侧方融合。横突骨膜可出现横突顶部帽状增厚的改变。
由于MRI可以显示组织的精细结构,故此可以在布鲁氏杆菌脊柱炎病程的早期发现异常结构。布鲁氏杆菌脊柱炎早期的病理改变以淋巴细胞浸润为主,在疾病早期即可有死骨与新生骨相交出现;椎间盘破坏程度较轻,病变信号多数在椎体前方出现,椎体形态多无明显变化;椎旁软组织异常信号范围较小,椎旁脓肿壁较薄而不规则,多为单个脓肿灶。在炎症早期出现各种炎性细胞浸润、渗出反应,随着水分子增多,椎体结果未出现明显改变。随着病变进展,病理损害与机体保护措施共存,破坏和修复共存,椎体无明显变形。骨质破坏在T1WI出现混杂的稍低信号,T2WI上出现混杂稍高信号;在T1WI上骨髓水肿出现低信号,T2WI上呈高信号。局灶性终板破坏处向椎间隙内发展,压迫硬膜囊,致使椎间隙轻度变窄,出现其他相关症状。MRI中,椎间盘可呈现低T1 及稍高T2 的信号。仅根据影像学表现,可能出现误诊。
本研究中收集了样本医院80例经血清诊断的布鲁氏杆菌脊柱炎患者,分别用CT和MRI对所有患者进行影像学检查,以检查椎体病变,依据检查结果评价两种影像学检查方法对布鲁氏杆菌脊柱炎的诊断价值。经分析显示,在慢性期,依据CT结果诊断布鲁氏杆菌性脊柱炎24例,MRI诊断布鲁氏杆菌性脊柱炎25例。在亚急性期CT诊断布鲁氏杆菌脊柱炎22例,MRI诊断布鲁氏杆菌脊柱炎32例。在急性期CT诊断布鲁氏杆菌脊柱炎1例,MRI诊断布鲁氏杆菌脊柱炎18例。出现这种结果的原因可能为,在急性期和亚急性期,布鲁氏杆菌脊柱炎的病理生理改变主要集中在软组织,或者骨质的破坏和修复处于动态平衡状态。在慢性期,骨质破坏和修复的平衡被打破,出现骨质破坏的情况。MRI对软组织有较好的显影,故此在急性期和亚急性期,对布鲁氏杆菌脊柱炎的软组织的微小病变亦能出现较明显的影像学结果。在慢性期随着特殊骨骼的影像学改变的出现,MRI的优势在降低,故此在慢性期,二者对于布鲁氏杆菌脊柱炎的诊断价值差异不明显。
综上所述,在布鲁氏杆菌脊柱炎的慢性期,CT和MRI对该疾病诊断的准确性没有差别,在疾病的亚急性期和急性期,MRI 均比CT 展现出更优先的诊断准确性,能更好地对布鲁氏杆菌性脊柱炎进行准确的诊断。因此在实际的临床工作中,临床医师应根据患者的具体病史及病程选用合适的影像学检查方式,并以最小经济代价得出较为满意的临床诊断效果,可以减轻患者的经济负担,亦可避免过度医疗。

