栀子对产蛋后期蛋鸡生产性能和蛋品质的调控作用及其机制
王 衡,林惠莹,孙倩倩,马玉芳,李 健*
(1.福建农林大学 福建省兽医中药与动物保健重点实验室,福建 福州 350002;2.中西兽医结合与动物保健福建省高等学校重点实验室,福建 福州 350002)
蛋鸡进入产蛋后期,组织器官及生理机能逐渐衰退,机体处于亚健康状态,极大地影响着蛋鸡的生产性能和蛋品质,使得养殖效益低下。因此,如何延长集约化养殖条件下蛋鸡的产蛋时间并且提高蛋品质,值得深入研究。产蛋后期的蛋鸡,一方面生殖器官衰退,特别是卵巢功能减弱导致等级卵泡形成数目减少[1];另一方面,经历了高强度的产蛋高峰,蛋鸡脂质代谢紊乱,容易在肝脏蓄积,造成肥胖、胰岛素抵抗、肝脂肪变性等损害,引起卵黄合成和沉积能力降低[2],降低产蛋率和蛋品质。而生殖系统或肝脏的炎症、损伤等病变,多数与中医的“下焦湿热证”高度相关[3-6]。
栀子(GardeniajasminoidesEllis)是我国第1批药食同源中药,既能清解下焦湿热,同时也是优质的天然黄色素来源[7],兼具抑制生殖系统炎症[8]和改善蛋品质[9]两方面的潜力。本试验通过在饲料中添加不同水平的栀子,研究其对产蛋后期蛋鸡在血清生殖激素、肝脏和卵巢相关基因表达等方面的影响,探究栀子对蛋鸡生产性能和蛋品质的影响及其机制,为进一步开发利用栀子及延长有效产蛋时间、提高蛋品质提供理论依据。
1 材料与方法
1.1 试验材料栀子粉购自百纳生物科技(漳州)有限公司,由栀子(GardeniajasminoidesEllis)干燥成熟果实粉碎制得;实验动物为360日龄健康海兰褐蛋鸡,购自福州闽侯江洋蛋鸡场。
1.2 栀子粉中栀子苷含量测定对照品溶液:精密称定栀子苷对照品7.0 mg,置于50 mL容量瓶中,用甲醇定容,摇匀,制成质量浓度为0.14 g/L的栀子苷溶液。
供试品溶液:分别取栀子粉1.435 3,1.575 3和1.433 0 mg(过四号筛),置于25 mL容量瓶中,加入适量甲醇超声处理30 min,室温放置至冷却后定容摇匀,吸取10 mL过滤即可。
色谱条件:Waters 1525-2707半制备液相色谱仪,Waters C18(250 mm×4.6 mm,5 μm)色谱柱,检测波长为238 nm,柱温30℃,流动相为乙腈∶0.2%磷酸溶液(15∶85),流速1.0 mL/min,进样量10 μL。
线性关系考察:精密量取对照品储备液0.5,1.0,2.0,3.0,4.0,5.0 mL,分别置于10.0 mL容量瓶中,用甲醇定容摇匀,即得质量浓度为0.07,0.14,0.28,0.42,0.56,0.70 g/L的标准溶液,按上述色谱条件测定,以栀子苷质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。
精密度试验:取同一对照品溶液,按上述色谱条件连续进样5次,计算栀子苷峰面积的RSD值。
加样回收试验:取供试品溶液,分别加入适量栀子苷标准溶液,按上述色谱条件测定,计算回收率。
样品含量测定:取同一批次不同包装内的栀子粉,按照上述方法制成供试品溶液,进样检测,计算栀子苷含量。
1.3 实验动物分组及饲养管理选取产蛋后期(360日龄)健康海兰褐蛋鸡144只,随机分为4组,每组6个重复,每个重复6只,对照组(negative control group,N组)饲喂基础饲粮(组成及营养成分见表1),3个试验组(low-dose group、medium-dose group和high-dose group,L、M和H组)分别在基础饲粮中添加1.0%,1.5%和2.0%的栀子粉。采用3层笼养,每个重复由相邻2笼组成(70 cm×70 cm×40 cm),每笼6只鸡。每天饲喂3次(8:00,14:00和19:00),自由采食,自由饮水(乳头式饮水器),捡蛋2次。机械通风,舍内温度为(22±3)℃,相对湿度为(60±5)%,自然光照和人工光照相结合,每日光照16 h(5:00—21:00)。常规饲养管理及免疫,预饲2周,试验期8周。
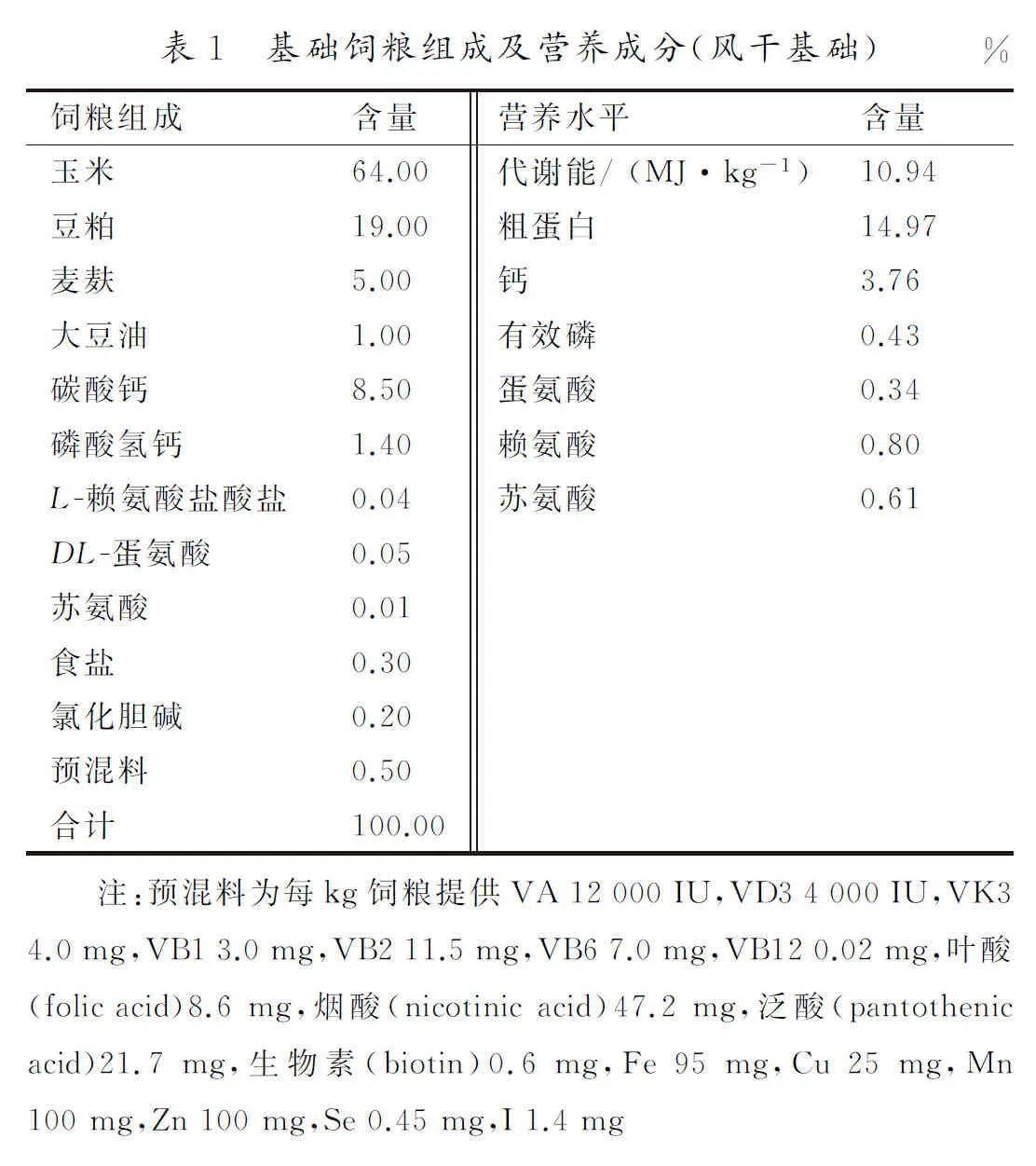
1.4 样品采集与测定生产性能测定:试验期间,每天填写蛋鸡生产记录表,以重复为单位,记录蛋鸡的实存栏数、产蛋数,称量鸡蛋总质量;记录每周蛋鸡的耗料量;计算平均产蛋率、平均蛋质量和平均日采食量。
平均产蛋率=每天产蛋个数/鸡存栏数×100%;平均蛋质量=产蛋总质量/产蛋数×100%。
蛋品质测定:在试验第2,4,6,8周末每组选取12个蛋,将每组取得的蛋样用游标卡尺测量纵径与最大横径,测定其蛋形指数;2人1组于光线充足处观察蛋壳表面暗斑,依主观判断分为4级:1级(基本无暗斑)、2级(暗斑数量少、直径小)、3级(暗斑数量较多、直径较大)和4级(暗斑数量多、直径大),记录每一级别蛋数,重复上述操作2次;蛋壳强度测定仪(日本Robot公司)测定蛋壳强度;蛋品质测定仪(日本Robot公司)检测蛋黄颜色、哈夫单位和蛋白高度。
蛋形指数=纵径/横径;蛋黄比率=蛋黄质量/蛋总质量×100%。
采血:分别于试验第0,4,8周,早晨饲喂结束后(9:00—10:00),每个重复随机选取3只鸡,用10 mL 注射器翅下静脉采血,室温静置后3 000 r/min离心10 min,将离心管上层血清分装于1.5 mL的EP管中,-20℃保存,待测。
采集组织样品:试验结束时,早晨饲喂结束后,每个重复随机选取3只鸡常规处死,采集肝脏和卵巢组织,分为3部分:第1部分经液氮速冻后移至-80℃ 保存,第2部分进行组织匀浆,第3部分以4%多聚甲醛固定。
血清雌激素水平:由北京华英生物技术研究所检测。
qPCR检测:根据GenBank登录号查询各待测基因序列,引物由福州白鲸生物科技有限公司合成(经PCR扩增、琼脂糖凝胶电泳证实可用)。引物序列见表2。常规方法提取RNA,D260/D280及琼脂糖凝胶电泳证实其纯度和完整性良好。按照HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)说明书,反转录cDNA,反转录体系见表3。每20 μL cDNA模板中加入30~50 μL ddH2O稀释,用于qPCR反应,以SYBR Green Ⅰ为染料对基因进行相对定量分析(美国ABI 7500 实时荧光定量PCR仪),qPCR反应体系见表4,反应条件见表5,结果以2-ΔΔCt表示。
2 结果
2.1 栀子粉中栀子苷含量按上述色谱条件进行测定,分离度与拖尾因子均达到要求,对照品和供试品色谱图见图1a、b。栀子苷对照品标准曲线见图1c,计算得回归方程为:y=1E+07x-11 008(R2=0.999),表明栀子苷在0.07~0.70 g/L范围内线性关系良好。栀子苷峰面积RSD为1.32%,表明检测方法精密度较高。加样回收率均值为98.3%(图1d)。栀子苷含量平均值为7.405%(图1e),符合2020版《中华人民共和国药典》规定(栀子苷≥1.8%)。

表2 引物序列

表3 反转录反应体系

表4 荧光定量PCR反应体系

表5 荧光定量PCR反应条件

a.栀子苷对照品;b.供试品;c.栀子苷对照品标准曲线;d.栀子苷加样回收率;e.栀子苷含量
2.2 栀子对产蛋后期蛋鸡生产性能的影响栀子对产蛋率的影响结果见表6。组间日采食量均无显著性差异(P>0.05);2.0%栀子组产蛋率提高5.9%,与对照组相比差异显著(P<0.05),另外2个栀子处理组的差异则不显著(P>0.05);2.0%栀子组平均蛋质量比对照组提高1.78 g,差异显著(P<0.05),另外2个栀子处理组与对照组相比差异不显著(P>0.05)。

表6 栀子对生产性能的影响
2.3 栀子对产蛋后期蛋品质的影响栀子对蛋形指数、蛋壳强度和蛋壳质量等指标的影响,组间无显著性差异(P>0.05)(图2a~c)。但是,栀子能显著减少蛋壳表面暗斑,具体表现在第6,8周时,栀子处理组中1级暗斑(基本无暗斑)和2级暗斑(暗斑数量少、直径小)数量显著增加(P<0.05 或P<0.01)(图2d、e),而3级暗斑(暗斑数量较多、直径较大)和4级暗斑(暗斑数量多、直径大)数量显著减少(P<0.05或P<0.01)(图2f、g)。栀子对哈夫单位和黏蛋白高度的影响,组间基本没有显著性差异,只在第8周时,2.0%栀子组比空白组有显著升高(P<0.05)(图3a、b)。蛋黄比率方面,第4,8周时,2.0%栀子组较空白组显著升高(P<0.05)(图3c)。而栀子对蛋黄颜色的影响则十分明显,与空白组相比,1.0%栀子组第6,8周蛋黄颜色显著增加(P<0.05);1.5%栀子组第2,4,6周均显著增加(P<0.05),第8周时极显著增加(P<0.01);2.0%栀子组第2,4周时显著增加(P<0.05),第6,8周时极显著增加(P<0.01)(图3d)。

a.蛋形指数;b.蛋壳强度;c.蛋壳质量;d.一级蛋壳暗斑;e.二级蛋壳暗斑;f.三级蛋壳暗斑;g.四级蛋壳暗斑;*.P<0.05,**.P<0.01。下同
2.4 栀子对产蛋后期蛋鸡血清生殖激素的影响第4周时,空白组E2、FSH、LH水平较0周显著升高(P<0.05或P<0.01)(图4a、c、d),空白组和栀子处理组P4水平无显著性变化(图4b);1.0%栀子组E2、FSH、LH显著升高(P<0.05或P<0.01);2.0%栀子组中FSH和LH极显著升高(P<0.01)。8周时,空白组E2、P4、LH水平较0周显著升高(P<0.05或P<0.01);栀子组血清中E2、P4、FSH和LH水平整体呈升高趋势,各栀子组内E2、P4、FSH、LH均显著升高(P<0.05或P<0.01);其中,E2和FSH水平在1.0%栀子组最高,P4和LH水平在1.5%栀子组较好。

a.雌二醇;b.孕酮;c.促卵泡刺激素;d.促黄体激素
2.5 栀子对肝脏组织及肝脏中卵黄合成/沉积相关基因的影响肝脏组织切片显示,空白组肝脏细胞排列较为紊乱、间隙不明显,可见少量坏死区域;栀子处理对肝脏组织能起不同程度的保护作用,其中,1.0% 栀子组细胞间隙较空白组有轻微改善,但仍有少许空泡变性;1.5%和2.0%栀子组肝脏细胞排列整齐,未见坏死区(图5a)。与空白组相比,1.0%栀子组ApoVLDLⅡ表达显著升高(P<0.05),其他剂量栀子组差异不显著(P>0.05),但也表现出升高趋势;2.0%栀子组PPARγ和ApoB表达量显著升高(P<0.05);FAS、ACC和SREBP-1c在1.0%和1.5%栀子组中表达显著升高(P<0.05或P<0.01),其中以1.0%栀子组表达最高;各栀子组中VTGH的表达较对照组无显著性差异(P>0.05)。结果表明栀子能上调蛋鸡肝脏中部分基因的表达,促进脂质的合成及转运,加快卵黄合成与沉积(图5d~h)。

a.肝脏组织切片(×100);b~h.卵黄合成/沉积相关基因
2.6 栀子对卵巢组织及卵巢中卵泡发育相关基因的影响卵巢组织切片显示,空白组皮质和髓质分界不清楚,初级卵泡和闭锁卵泡较多;1.0%栀子组次级卵泡数量少,且细胞形态较扁、薄;1.5%和2.0% 栀子组初级卵泡数量多,次级卵泡数量少,但个体较大,有多个明显的核仁,闭锁卵泡少(图6a)。相比空白组,AR基因在1.0%,2.0%栀子组表达显著升高(P<0.05),以2.0%栀子组最高;CYP17、CYP19、ESR2、FSHR、LHR在2.0%栀子组中表达量显著升高(P<0.05或P<0.01),在其余剂量栀子组中也表现出升高趋势;各栀子组中ESR1表达较对照组差异不显著(P>0.05)。结果表明栀子能上调蛋鸡卵巢中部分基因的表达,调节生殖激素的分泌,促进卵泡生长和发育(图6b~h)。

a.卵巢组织切片(×100);b~h.卵泡发育相关基因
3 讨论
蛋鸡进入产蛋后期,随着日龄增加,产蛋率和蛋品质均明显下降,尤其是480日龄以后,产蛋率急剧降低[10]。为缓解这种下降趋势,延长蛋鸡有效生产时间,就需要蛋鸡的卵泡发育和排卵功能维持在正常水平,而卵泡发育和排卵直接受到生殖相关激素及其受体表达水平的调控[11]。禽类卵泡内,孕酮(P4)在卵泡内膜层由CYP17催化为雄激素,雄激素再通过旁分泌形式转移至卵泡外膜层,由CYP19催化为雌激素[12]。3种激素互相影响,不断作用于颗粒层、卵泡内膜层和外膜层,促进其生长分化,进而调控卵泡的发育[13]。另外,家禽超过95%的卵泡会发生闭锁,无法发育至排卵前卵泡[14]。闭锁卵泡与正常卵泡相比,促卵泡激素受体(FSHR)和促黄体生成素受体(LHR)基因表达量极显著上调,这对于闭锁初期的卵泡而言,可能有助于延缓卵泡闭锁的进程。
应用中药调控蛋鸡生殖相关激素或其受体表达的研究,已有一定数量的报道,所选用的中药多属补益类,这符合传统医学“气血充盈、胞宫得养”的理论。例如,王改琴等[15]应用含益母草、甘草、黄芪等的精油植生素治疗患输卵管炎的蛋鸡,发现精油植生素能够不同程度地提高患输卵管炎蛋鸡的生产性能和蛋品质,调节血清中细胞因子和E2水平;GUO等[16]研究表明,淫羊藿总黄酮(TFE)能促进卵泡颗粒细胞增殖分化,促进激素分泌和卵泡发育,尤其是可以促进分层前和排卵前颗粒细胞分泌孕酮;张金汉等[17]研究了女贞子、巴戟天、菟丝子等16种补肝益肾类中药对产蛋后期蛋鸡生产性能、抗氧化指标和繁殖激素分泌的影响,发现这些药物能不同程度地提高蛋鸡生产性能、增强肝肾抗氧化能力、促进繁殖激素分泌。
值得注意的是,近期的一些研究发现,先前认为与补益气血、调控生殖关系不大的清热类中药或其有效成分,也表现出对蛋鸡卵巢、输卵管等的保健作用,进而发挥促进或维持蛋鸡生殖相关激素或受体表达的功效,其药理作用机制主要涉及抗氧化、抗炎、抗应激等。例如,MA等[18]研究表明,表没食子儿茶素-3-没食子酸酯能够通过Keap1-Nrf2-sMaf通路缓解钒诱导的蛋鸡肝脏、肾脏和卵巢抗氧化能力降低;姬晓琪等[19]发现血根碱对蛋鸡输卵管炎具有预防和治疗作用,可能的机理是下调炎性因子IL-2、IL-6、TNF-α和IFN-γ的表达。同样属于清热类中药的栀子,对产蛋率的影响,仅见王庭林等[20]报道饲粮中添加黄栀子对蛋鸡产蛋率有积极作用,但未开展相关机制研究。但是,刘兴廷等[11]报道,酚类成分原花青素(GSPE)通过提高卵巢组织抗氧化酶的活性、上调抗氧化基因的转录水平缓解D-gal诱导衰老和自然衰老蛋鸡卵巢组织的氧化应激,类胡萝卜素类成分番茄红素通过激活衰老卵巢组织中Nrf2/HO-1信号通路,提高衰老蛋鸡卵巢组织抗氧化能力,发挥促进增殖和抑制凋亡的作用,从而延缓蛋鸡卵巢衰退。而栀子同时富含酚类成分(3,4-二香草酰基四氢呋喃、对羟基肉桂酸、异阿魏酸等)[21]和类胡萝卜素类成分[22],由此推测,栀子亦可能是通过缓解产蛋后期蛋鸡卵巢衰老、减少卵巢氧化应激而发挥本研究观察到的上调卵巢AR、CYP17、CYP19、ESR2、FSHR、LHR基因表达、从而提升血清中E2、P4、FSH、LH等激素水平的作用。具体的作用机制,值得进一步深入研究。
蛋鸡自身不能合成类胡萝卜素,必须从体外获得,因此蛋黄颜色在很大程度上受饲料成分的影响。与人工合成色素相比,具有着色功能的中药成分相对更加安全且具备多元化的保健功效,因此成为这一领域的研究热点之一。刘宁等[23]报道,长顺绿壳蛋鸡饲粮添加400 mg/kg的茶多酚(TP),可显著提高第4和8周鸡蛋的哈夫单位和蛋黄颜色;白建等[24]报道,海藻粉和蒲公英粉对蛋鸡生产性能、免疫功能和蛋品质的影响存在协同效应,单独添加或协同添加均能提高海兰褐蛋鸡产蛋率和蛋黄颜色;陈祥宇等[25]报道,太行鸡饲粮中添加100,200和300 mg/kg万寿菊提取物均可显著增加蛋黄颜色,添加200和300 mg/kg万寿菊提取物可显著提高蛋黄中叶黄素含量。
栀子富含栀子黄色素(gardenia yellow pigment,GYP)[26],是一种少见的水溶性类胡萝卜素,易吸收,可作为营养型着色剂[27],其主要化学成分为藏红花素(crocin)和藏红花酸(crocetin),两者在水溶液中呈鲜艳的黄色,是产生黄色的有效成分[28]。王先敏等[29]以聚酰胺为栀子黄色素的纯化剂,工艺优化前后样品中西红花苷-Ⅰ,Ⅱ总含量由1.83%提升至25.96%;何国振等[30]研究了不同成熟期栀子果实的有效成分积累,发现西红花苷-Ⅰ的含量在全青期和全黄期最高;王莉等[31]研究了栀子最佳采收期及联合干燥对其黄色素含量的影响,发现栀子黄色素含量在结果后的第20周出现高峰,果壳、果仁、整果中的栀子黄色素吸光值分别达1.122,1.987,1.738。栀子黄色素在工业领域的研究和应用起步较早[32-33],而在养殖业中的应用尚处于起步阶段。郭振环等[34]发现,由栀子和山楂等组成的中药复方,能增加蛋黄颜色,效果优于化学色素,还可以提高产蛋率和降低蛋黄粗脂肪含量;范良志[9]用黄栀子为主要成分的中药复方添加剂饲喂蛋鸡,结果发现哈夫值和蛋黄颜色显著提高,而蛋形指数、蛋壳强度等差异不显著。本试验结果与之类似,1.5%和2.0%栀子组的蛋黄颜色在试验全程均显著加深,表明栀子对蛋黄具有较为可靠的染色效果。
本试验发现,高剂量栀子组的平均蛋质量和哈夫单位均较对照组显著提高,但蛋形指数、蛋壳质量等指征蛋壳质量的指标组间无显著性差异,可以推知平均蛋质量的增加主要是由蛋内容物的增加引起的。蛋内容物主要由蛋清和蛋黄构成。蛋清约占鸡蛋质量的60%,蛋白质约占蛋清的12%[35]。黏蛋白高度和哈夫单位是衡量鸡蛋清品质的关键指标,蛋白越黏稠,蛋白高度和哈夫单位的数值越大,蛋清品质越好[36]。本试验发现第8周时,2.0%栀子组的哈夫单位和黏蛋白高度均显著高于对照组,表明饲粮中添加栀子对产蛋后期蛋鸡所产鸡蛋的蛋清品质有提升效果。王晓翠等[35]报道,绿茶多酚(GTP)能够显著改善鸡蛋清品质,作用机制为GTP提高输卵管蛋白分泌部抗氧化功能,增强蛋清高丰度蛋白合成、分泌。而栀子也含有多种抗氧化成分[37-38],其提升蛋清品质的作用机制是否与GTP类似,值得进一步研究。
蛋黄前体物质主要在肝脏合成,蛋禽肝脏合成的脂肪大部分以极低密度脂蛋白(VLDL)形式转运到肝外,作为卵黄前体物质沉积到卵泡中,在VLDL组装和释放的过程中,载脂蛋白B100(Apo-B100)和微粒体甘油三酯转运蛋白(MTP)起主导作用,而apoVLDL-Ⅱ是VLDL的脱辅基蛋白[39]。这一过程主要受PPARs和SREBP-1c的调控,其中,PPARs的活化会影响与高密度脂蛋白(HDL)相关基因的表达,促进胆固醇的逆向转运过程[40];而SREBP-1c主要调控脂肪酸和甘油三酯合成,过度表达将导致非脂肪组织脂质沉积聚合,引起组织病变[41],SREBP-1c的靶基因包括乙酰辅酶A 羧化酶(ACC)和脂肪酸合成酶(FAS)等脂肪合成和葡萄糖代谢相关基因[42]。NAGMELDIN等[43]发现日粮添加甜菜碱(BET)显著提高母鸡产蛋率,并伴随肝脏脂质合成与转运相关基因ApoVLDL、ApoB、SREBP-1、FAS和ACC的表达显著上调。类似地,本研究发现饲粮中添加2.0%栀子,一方面显著提高蛋质量和蛋黄比率,另一方面显著上调ApoVLDL、ApoB、PPARγ、SREBP-1c、FAS和ACC等肝脏中卵黄合成与沉积相关基因的表达,因此推测这两方面可能存在因果关系,从而在增加脂质合成的同时促进脂质转运,加快卵黄沉积。
- 中国兽医学报的其它文章
- 《中国兽医学报》第七届编辑委员会委员名单

