基于TCGA数据库分析AHSA1表达与肝细胞癌预后的相关性
王琦琦, 叶必成, 王昌成
(1. 徐州医科大学附属淮安医院 消化内科, 江苏 淮安, 223000;2. 扬州市职业大学 医学院, 江苏 扬州, 225000)
肝细胞癌(HCC)具有较高的病死率,大部分HCC患者首次诊断时已为中晚期,且总体治疗效果相对较差,5年生存率约为18%[1]。热休克90 kDa蛋白ATPase同源物1的激活因子(AHSA1)是热休克蛋白90(HSP90)功能的一般上调剂,是真核细胞中必不可少的分子伴侣[2-3]。共伴侣因子AHSA1的N端结构域与HSP90的中间结构域发生相互作用,诱导HSP90中间结构域催化环区形成稳定构象,随后AHSA1的C端结构域识别并结合发生二聚化的HSP90N端结构域,最终上调HSP90的三磷酸腺苷(ATP)水解功能[4-5]。AHSA1伴侣分子具有独特的能力,能够显著增强人HSP90固有的低ATPase活性,其创建并维持称为“客户蛋白质”的蛋白质子集的功能构象,这是介导癌细胞增殖、存活和转移的多个信号网络的关键组成部分[6]。相关研究发现AHSA1与乳腺癌[7]、骨肉瘤[8]、子宫内膜癌[9]、多发性骨髓瘤[10]等恶性肿瘤的发生发展均有显著相关性,但有关肝癌中AHSA1表达及功能的系统研究则较少。本研究基于多项队列综合地探索了AHSA1在HCC中的表达,并评估了AHSA1在HCC预后中的价值以及潜在的生物学机制,现报告如下。
1 材料与方法
1.1 AHSA1在HCC中的差异性表达
通过HCCDB数据库(http://lifeome.net/Database/hccdb/home.html)对多个肝癌数据集检测AHSA1 mRNA在HCC组织中的表达水平。利用GEPIA数据库(http://gepia.cancer-pku.cn/)及 Oncomine数据库(https://www.oncomine.org/)检索AHSA1 mRNA在肝癌组织及癌旁组织中的表达。
1.2 AHSA1表达与肝癌患者生存预后的关系
通过Kaplan-Meier Plotter数据库(http: //kmplot.com/analysis/)对AHSA1在HCC中的预后进行生存分析评估,包括总生存期(OS)、无复发生存期(RFS)、无进展生存期(PFS)和疾病特异性生存期(DSS)。从癌症基因组图谱(TCGA)下载HCC RNA-seq表达和临床数据,排除临床信息不完整的样本,利用R软件对TCGA数据库中提取的患者信息及AHSA1 mRNA的表达构建单因素和多因素Cox回归模型,评估影响HCC患者OS的危险因素。使用TCGA数据集中具有详细临床病理信息的患者资料(包括诊断时的年龄、肿瘤分级、肿瘤分期和AHSA1表达水平)来建立列线图,以预测肝癌患者的1、3、5年生存率。使用R软件构建受试者工作特征(ROC)曲线和校准图,评估列线图的效率。
1.3 差异表达基因的筛选和功能分析
使用R软件的“wilcox. test”函数筛选TCGA数据库中肝癌患者肿瘤组织的不同AHSA1表达组之间的差异表达基因(DEGs)。DEGs的截断标准为|log2fold change|≥1, 错误发现率(FDR)<0.05。通过使用R软件的“clusterProfiler”包进行功能富集分析,以基因本体论(GO)和京都基因和基因组百科全书(KEGG)进行注释。GO分为3个部分: 分子功能(MF)、细胞组分(CC)和生物学过程(BP), 其中FDR<0.05被认为是显著富集。
1.4 免疫浸润相关性分析
使用TIMER2.0(http://timer.cistrome.org/)数据库计算得出AHSA1表达量与免疫细胞浸润情况的相关性。通过GEPIA数据库分析正常肝组织及HCC中的不同免疫细胞的免疫标记集与AHSA1的相关性(cor<0为负相关, cor>0为正相关,P<0.05为差异有统计学意义)。
1.5 潜在小分子靶向药物的筛选
Connectivity map(http://www.broad.mit.edu/cMap)是一个基因表达谱数据库。该网站搜集了利用小分子化合物处理后人类细胞基因表现的差异,建立小分子化合物、基因表型与疾病相关联的生物应用数据库。将差异表达基因分为上调组与下调组,分别输入CMAP数据库检索,筛选出P<0.01的潜在小分子药物。
1.6 统计学分析
生存分析采用Kaplan-Meier法及Log-rank检验,包括Cox回归模型评估影响HCC患者OS的危险因素,计算95%可信区间(95%CI)和风险比(HR), 其中P<0.05视为差异具有统计学意义。将单因素分析结果有统计学意义的变量纳入多因素 Cox比例风险回归中,用于确定肝癌患者的预后因素。建立列线图模型预测肝癌患者的OS,P<0.05为差异有统计学意义。采用R 4.0.2软件进行统计学分析和绘图。富集分析以FDR<0.05为差异有统计学意义。免疫浸润相关性分析,以cor<0为负相关, cor>0为正相关,P<0.05为差异有统计学意义。
2 结 果
2.1 AHSA1在肝癌组织与正常组织中的表达差异
在HCCDB数据库中分析了9个HCC的基因集: HCCDB1(P=0.000 005 880)、HCCDB3(P=2.860e-9)、HCCDB4(P=1.990e-76)、HCCDB6(P=8.830e-40)、HCCDB7(P=0.000 012 10)、HCCDB11(P=0.070 38)、HCCDB12(P=0.046 48)、HCCDB13(P=7.240e-7)、HCCDB15(P=3.840e-17)、HCCDB16(P=0.000 011 20)、HCCDB17(P=1.110e-17)、HCCDB16(P=3.730e-32), 发现与邻近的正常组织相比, AHSA1 mRNA在HCC组织中高表达(图1A)。
通过 GEPIA分析 TCGA 数据库及GTEx数据库中合计369个肝癌样本及160个正常肝组织样本中AHSA1的表达水平,结果显示肝癌组织中的AHSA1表达水平较正常肝组织升高,差异有统计学意义(log2FC Cut-off=0.8,P<0.001)(图1B)。进一步通过 Oncomine 数据库验证,数据库中有4项子研究符合筛选条件,共包含 299个肝癌组织样本及 261个正常肝组织样本,对其进行荟萃分析的结果显示, AHSA1在肝癌组织中的表达水平高于正常肝组织(P=0.005)(图1C)。
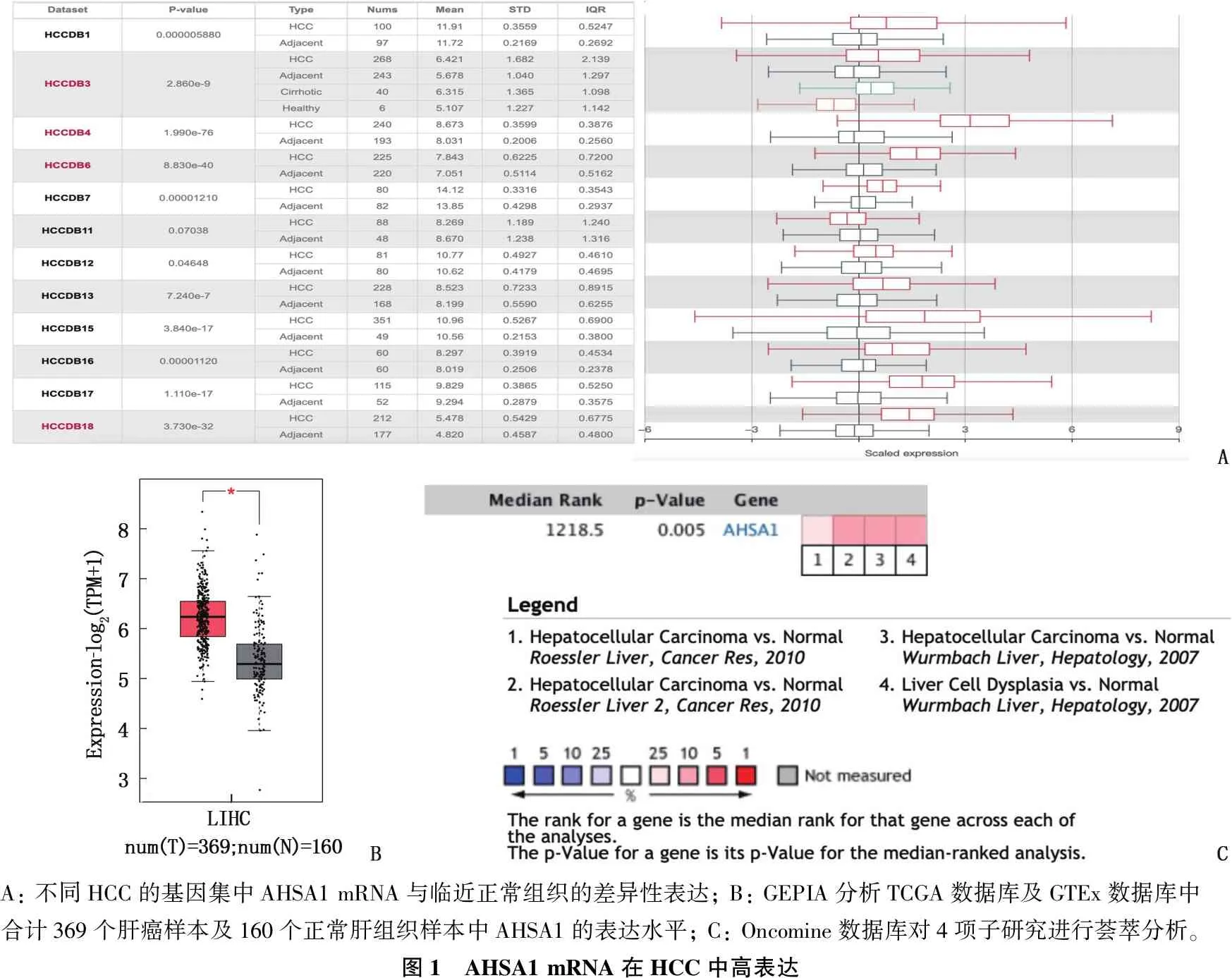
A: 不同HCC的基因集中AHSA1 mRNA与临近正常组织的差异性表达; B: GEPIA分析TCGA数据库及GTEx数据库中合计369个肝癌样本及160个正常肝组织样本中AHSA1的表达水平; C: Oncomine数据库对4项子研究进行荟萃分析。图1 AHSA1 mRNA在HCC中高表达
2.2 AHSA1高表达的HCC患者具有相对较差的预后
为了进一步评估AHSA1对HCC的预后价值,作者使用了Kaplan-Meier Plotter在线工具对TCGA数据库的HCC患者进行生存分析,结果显示,与低表达组患者相比, AHSA1高表达组患者的预后生存更差,表现为OS[HR=1.51(1.07~2.31),P=0.019]和DSS [HR=1.67(1.07~2.68),P=0.032]的差异有统计学意义,而PFS[HR=1.15(0.83~1.61),P=0.40]和RFS[HR=1.18(0.83~1.69),P=0.36]的差异无统计学意义。见图2。单因素Cox回归分析表明,高AHSA1表达与不良总生存率显著相关[HR=2.115(1.498~2.988),P<0.001]; 多变量Cox分析表明, AHSA1基因表达是肝癌患者总体生存的独立危险因素[HR=1.970(1.395~2.782),P<0.001]。见图3。
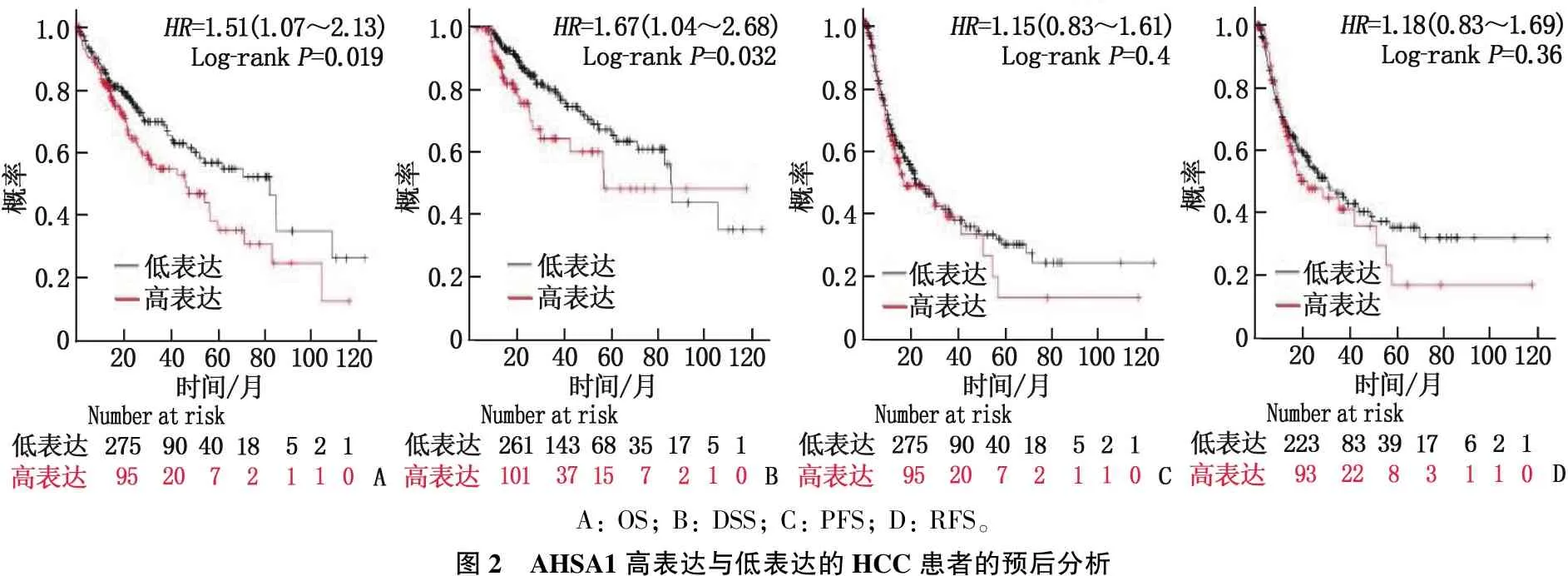
A: OS; B: DSS; C: PFS; D: RFS。图2 AHSA1高表达与低表达的HCC患者的预后分析
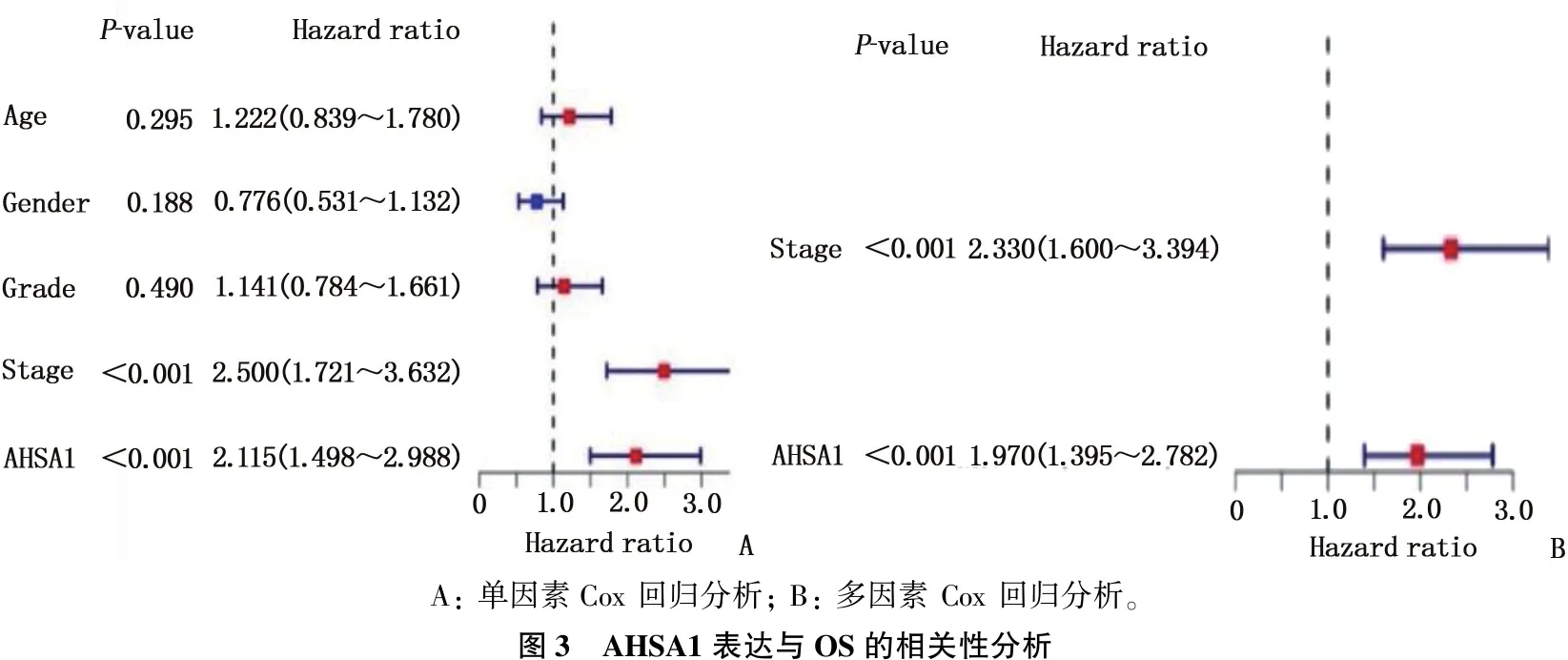
A: 单因素Cox 回归分析; B: 多因素 Cox 回归分析。图3 AHSA1表达与OS的相关性分析
为了临床医生能够预测个体HCC患者死亡的风险、指导患者治疗、评估治疗决策,本研究通过整合临床因素和TCGA数据集的基因表达来构建预后列线图(图4A),同时绘制ROC曲线和校正曲线,评估列线图的预测能力。校正曲线显示,由列线图预测的风险与观察到的1、3、5年生存率具有高度一致性(图4B、C、D)。在ROC曲线中,列线图预测1、3、5年生存率的曲线下面积(AUC)依次为0.721、0.711、0.725(图4E、F、G)。

A: TCGA肝癌队列中AHSA1与临床参数的列线图; B、C、D: 预测TCGA队列中1、3、5年生存率的列线图校准曲线; E、F、G: 基于TCGA队列的时间依赖性ROC曲线和1、3、5年OS的AUC。图4 预后列线图的构建及预测能力
2.3 AHSA1表达的生物学功能分析
GO功能富集分析结果显示, AHSA1差异表达基因在BP方面主要与介导中性粒细胞活化而参与免疫反应等有关; 在CC方面主要与分泌颗粒腔、胞质囊腔、分泌颗粒膜、内质网腔等有关; 在MF方面主要与辅酶绑定、维生素结合、羧酸结合、有机酸结合等有关(图5A)。KEGG信号通路分析结果显示, AHSA1差异表达基因主要富集于糖酵解/糖异生、癌症的中心碳代谢、酪氨酸代谢、苯丙氨酸代谢通路(图5B)。KEGG信号通路分析表明, AHSA1的表达涉及肿瘤细胞能量代谢相关的信号转导过程。

A: HCC中AHSA1表达的GO富集分析; B: HCC中AHSA1表达的KEGG通路分析。图5 AHSA1表达的生物学功能分析
2.4 HCC中AHSA1表达与免疫浸润水平的相关性
采用TIMER2.0分析AHSA1表达与HCC免疫浸润之间的相关性,结果显示, AHSA1表达与B细胞(r=0.256,P=1.47e-06)、CD4+T细胞(r=0.166,P=1.95e-03)、调节性T细胞(r=0.152,P=4.83e-03)、巨噬细胞(r=0.171,P=1.43e-03)、中性粒细胞(r=0.167,P=1.87e-03)、树突状细胞(r=0.405,P=4.37e-15)的免疫浸润程度有相关性,提示AHSA1可能参与肝癌细胞的免疫浸润过程。见图6。
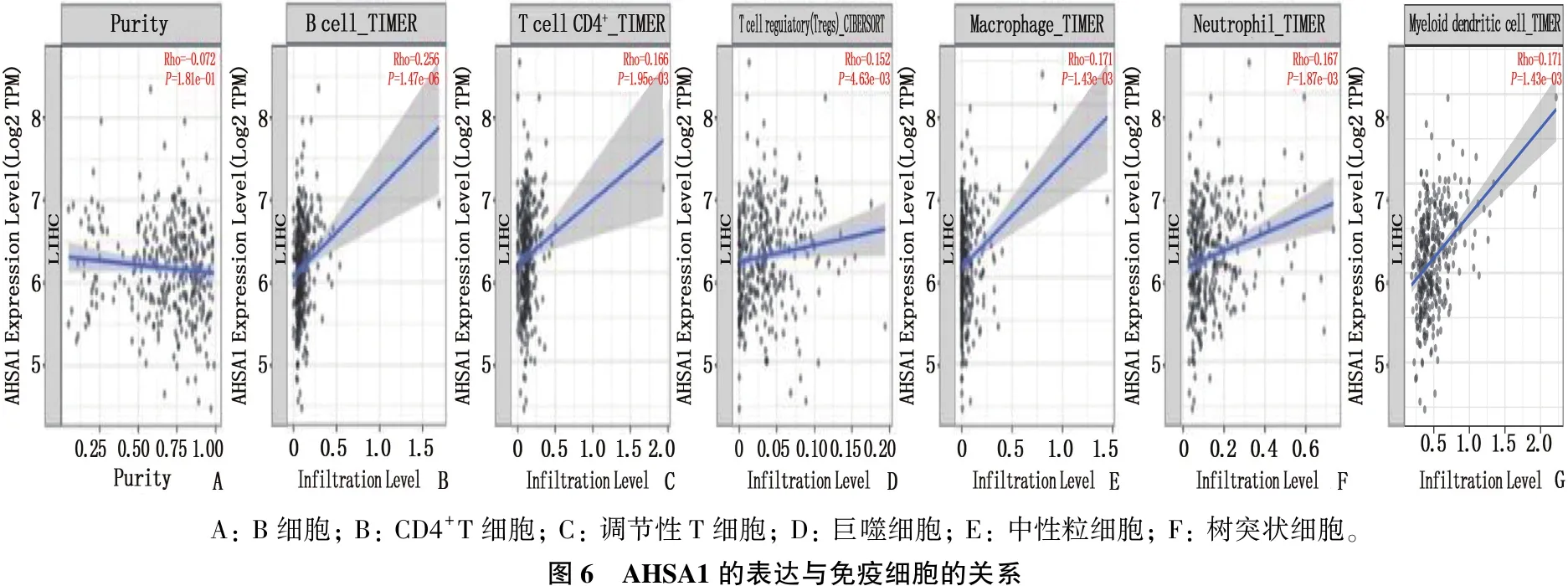
A: B细胞; B: CD4+T细胞; C: 调节性T细胞; D: 巨噬细胞; E: 中性粒细胞; F: 树突状细胞。图6 AHSA1的表达与免疫细胞的关系
为了进一步研究不同免疫浸润细胞与AHSA1的关系,作者研究了GEPIA数据库中正常肝组织和肝癌组织中的不同免疫细胞的免疫标记集与AHSA1的关系,结果显示,与正常肝组织相比,肝癌组织中AHSA1表达水平与部分免疫细胞的免疫标记集显著相关(cor>0,P<0.05), 这些结果进一步提示AHSA1表达可能与肿瘤的部分免疫细胞浸润有关,通过免疫浸润进一步促进肿瘤的进展。见表1-1、1-2。

表1-1 正常肝组织和HCC中的不同免疫细胞的免疫标记集与AHSA1的关系
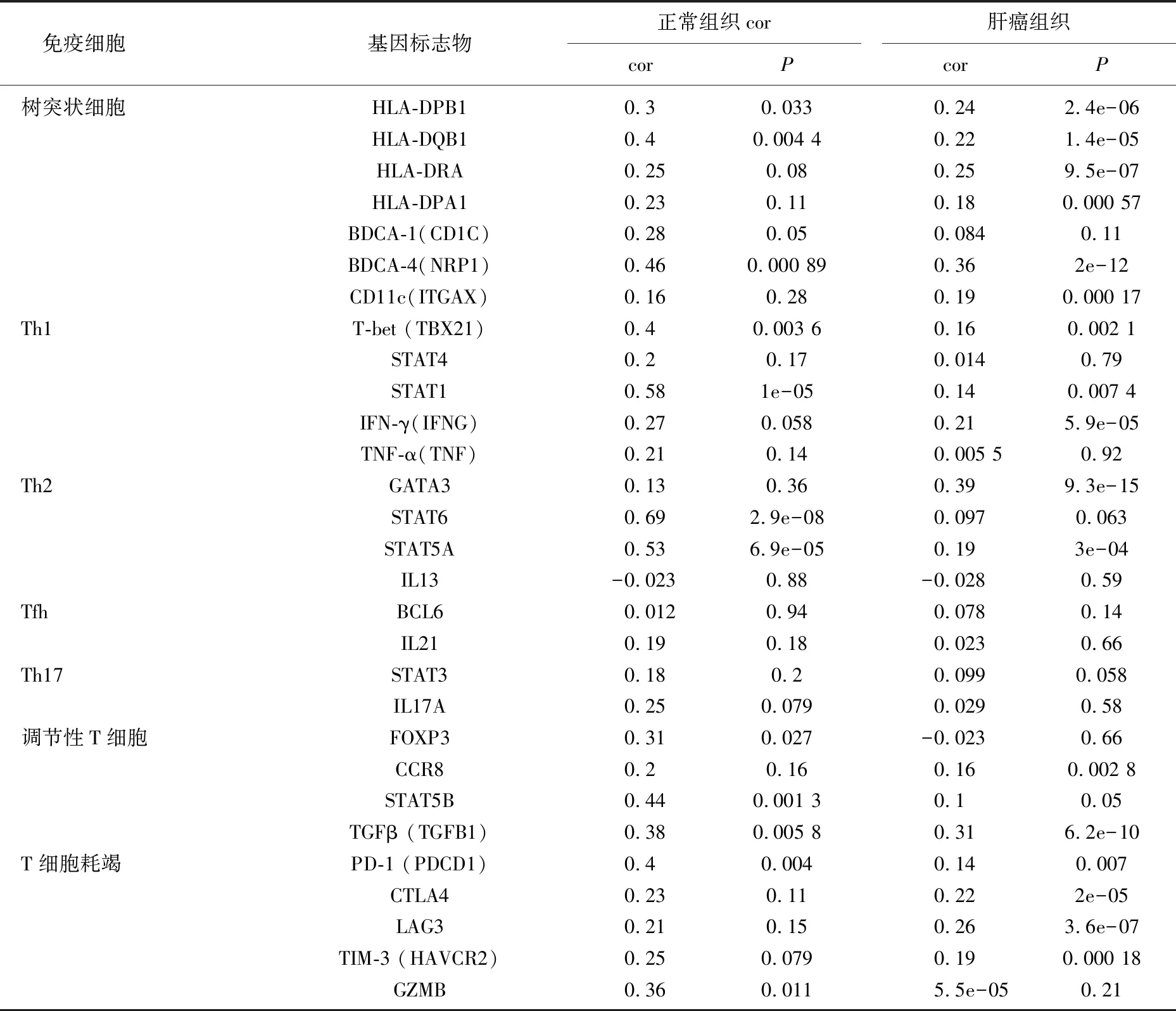
表1-2 正常肝组织和HCC中的不同免疫细胞的免疫标记集与AHSA1的关系
2.5 治疗肝癌的小分子药物的筛选
为了筛选有价值的肝癌候选治疗药物,作者将选定的与AHSA1表达有关的DEGs(分为上调和下调)上传到CMAP数据库,然后将其与小分子匹配,筛选出排名前13的小分子靶向药物(P<0.01), 见表2。在筛选出的药物中,依他尼酸和布雷他汀表现出显著的负评分,说明这两种小分子药物可以有效逆转肝癌细胞的AHSA1表达。

表2 CMAP筛选出的可以逆转肝癌细胞AHSA1表达的13种最重要的潜在小分子药物
3 讨 论
由于复杂的分子机制, HCC仍是世界上最具威胁的恶性肿瘤之一,尽管手术切除、肿瘤血管栓塞和射频消融可以提高生存率,但HCC患者的预后依然很差,免疫逃逸、侵袭和转移进一步降低了HCC患者的长期生存率。随着基因测序技术的发展,已经发现了一些对肝癌患者具有预测价值的潜在基因标志物,但这种生物标志物的数量仍然有限,为了改善肝癌患者的预后,需要发现更多具有较高预测准确性的生物标志物。
相关研究[11]表明,抑癌基因p53表达降低会导致AHSA1的表达升高; AHSA1通过上调HSP90来激活其下游蛋白MMP-2, MMP-2在癌症细胞迁移、侵袭和血管生成中起重要作用[12]; 通过调节AHSA1来调节HSP90活性会影响原发性血管内皮细胞中一氧化氮合成酶(eNOS)活性和血管内皮生长因子(VEGF)介导的作用,内皮细胞中释放NO是VEGF刺激内皮细胞通透性和新生血管生成的重要介质。由此可见, AHSA1的上调可以促进肿瘤组织血管的生成,从而增强肿瘤细胞的增殖和转移。AHSA1在骨肉瘤细胞中高表达,而敲除AHSA1可以抑制细胞生长、迁移和侵袭, miRNA-338-3p通过靶向AHSA1抑制骨肉瘤细胞的增殖、迁移、侵袭和上皮细胞-间充质转化(EMT)[8, 13], 说明AHSA1在肿瘤细胞生长、迁移和侵袭中发挥重要作用。本研究发现,肝癌组织中AHSA1 mRNA表达增加,且与HCC患者的预后显著相关,是预测HCC患者OS的独立危险因素,表明AHSA1是HCC患者的潜在预后指标。另外,本研究多因素Cox风险比例模型及列线图也进一步证明了AHSA1在HCC中的预后价值。
免疫细胞浸润和肿瘤微环境已被证实在癌症的发生发展中发挥着关键作用[14], 免疫疗法可能是一种很有前景的抗肝癌策略。研究发现免疫疗法对多种类型的人类癌症有效,如黑色素瘤[15]和肺癌[16],但在肝癌中获益较小。大多数肝癌由乙型或丙型肝炎发展而来,是一种炎症驱动的疾病,研究[17-18]表明免疫细胞浸润会加速慢性肝炎向肝癌的进展,同时与肝癌患者的不良预后相关,包括肿瘤相关巨噬细胞(TAM)[19]、CD4+调节性T细胞[20]和骨髓来源的抑制性细胞(MDSCs)[21]等。在这种情况下,调节肿瘤微环境中的免疫细胞浸润可能是治疗肝癌的一种新的有效策略。然而,肝癌细胞如何逃避免疫监视尚未完全阐明。本研究分析多个数据库表明AHSA1 mRNA表达水平与B细胞、CD4+调节性T细胞、调节性T细胞(Tregs)、巨噬细胞、中性粒细胞和树突状细胞浸润增加有关,且GO功能富集分析结果提示AHSA1生物学过程方面主要与介导中性粒细胞活化从而参与免疫反应等有关,都表明AHSA1可能通过调节免疫微环境对肝癌预后产生负面影响。
Tregs可以通过释放转化生长因子-β(TGF-β)、白细胞介素-10(IL-10)和白细胞介素-35(IL-35)来限制有效的抗肿瘤免疫反应,从而促进肝癌进展[22-23]; 肿瘤相关巨噬细胞(TAM)浸润可以通过表达细胞因子和趋化因子吸引Tregs至癌症部位,从而抑制抗肿瘤免疫并促进肝癌进展[24], 同时促进肝癌的远处转移[25]。CD8+细胞毒性T淋巴细胞(CTL)是用于靶向癌症的首选免疫细胞[26], 效应CTL会浸润到肿瘤的核心或浸润部位,在杀死癌细胞方面发挥重要作用,但是肿瘤细胞可以通过变换表型躲避CTL细胞识别和杀伤,促进肿瘤细胞侵袭和抑制肿瘤免疫治疗,并且这种作用受到如癌症相关成纤维细胞(CAF)、Tregs和M2型巨噬细胞的干扰[27]。研究[24]表明AHSA1是肿瘤免疫逃逸的核心基因之一。本研究结果提示, AHSA1的表达与Tregs和巨噬细胞浸润相关,也间接表明AHSA1的表达可能通过Tregs和M2型巨噬细胞浸润而触发CTL免疫逃避,导致肿瘤进一步恶化。该研究为进一步探索基于免疫的肝癌新疗法提供了参考。
目前临床上已涌现了许多相关药物研究,使用抑制剂破坏HSP90α/AHSA1复合物,引起HSP90α和AHSA1在细胞质的重新分布,并减少细胞迁移[28-29]。类黄酮TL-2-8可以通过减少HSP90-AHSA1复合物的形成来诱导乳腺癌细胞的死亡,起到抗癌作用[7]。本研究主要从CMAP数据库中筛选出两种可能逆转肝癌基因表达的小分子靶向药物: 依他尼酸和布雷他汀。依他尼酸是谷胱甘肽S-转移酶(GST)的抑制剂,而GST在肝细胞的表达与癌前病变及肿瘤发生有关,并导致耐药表型出现,因此依他尼酸可以通过抑制GST来发挥抗癌作用[30]。索拉非尼是用于治疗肝癌的常用靶向分子药物,与依他尼酸协同可以发挥更好的抗癌效果[31]。依他尼酸和环吡酮胺(CPX)联合对肝癌细胞具有强大的协同抗肿瘤作用[32]。布雷他汀是一种肌球蛋白抑制剂,肌球蛋白ⅡATP酶的过度活性与肿瘤转移和侵袭有关[33], 使用布雷他汀特异性抑制非肌肉肌球蛋白Ⅱ证实了该分子在胰腺腺癌细胞、乳腺癌细胞侵袭和细胞外基质相互作用中的关键作用[34-35], 但尚无布雷他汀在肝癌中的研究。后续需要更多的实验证据和长期临床试验来验证依他尼酸和布雷他汀在肝癌治疗中的作用。
综上所述,本研究提供了关于AHSA1在肿瘤发生和发展中的重要性及其作为HCC新型指标的潜力的多层次线索。尽管大数据分析可以全面、快速地挖掘潜在数据和功能性生物分子,但各种假阳性结果是不可避免的。本研究主要是为功能基因的筛选提供一种快速、简便的方法,提示AHSA1可能成为判定HCC患者预后的分子标志物和新的治疗靶点,证实了AHSA1在HCC中的重要作用,但后续仍需进一步进行实验分析和临床验证。

