思茅松毛虫2龄幼虫肠道可培养细菌的多样性
包书军, 熊 智, 李雕益, 李选文, 熊忠平, 罗 曼
(1.西南林业大学生命科学学院,云南昆明 650224;2.西南林业大学继续教育学院,云南昆明 650224;3.西南林业大学生物多样性学院,云南昆明 650224;4.西南林业大学林学院,云南昆明 650224)
我国松毛虫可分为7个属82种,分别是松毛虫属()、云毛虫属、大毛虫属、小毛虫属、丫毛虫属、杂毛虫属、栎毛虫属,而思茅松毛虫属于松毛虫属(),因最早在云南思茅地区发现而被命名为思茅松毛虫,主要分布在我国四川、云南、广东、江西、台湾、安徽等省份,一年发生1~2代,以幼虫危害最大,是我国南方重要松树害虫,主要危害松树有思茅松、云南松、海南松、云南油杉、马尾松和短叶松等,严重时可造成毁灭性灾害。
思茅松毛虫的防治方法主要包括:生物防治、物理防治、化学防治等。生物防治是近年常用效果较好的方法,主要是利用微生物、激素等方法进行防治;万鹰等利用白僵菌粉喷洒于有思茅松毛虫的树上,研究白僵菌对思茅松毛虫的防治效果,结果显示,白僵菌的防治效果相对于其他3种药剂要慢,但防治效果持久。物理防治是利用灯光诱集成虫使其接触高压电而死亡,或利用人工摘茧除卵等的方法。化学防治是指利用化学药剂杀灭害虫的方法,通常使用的化学药剂有50%马拉硫磷乳剂、杀螟松乳剂等,每年的4—6月在大面积防治中使用浓度为20%杀灭菊酯较为适用。
微生物研究一直是人们研究的热点,其中,昆虫肠道微生物也是人们的研究焦点之一,且随着测序技术的不断提升和发展,对于微生物的识别更加迅速和准确。昆虫肠道微生物的数量和种类均非常多,且肠道微生物对机体的发育、生理、营养吸收等均有巨大影响。
1 材料与方法
1.1 试验材料
试验时间:2018年10月至2019年5月。试验地点:云南省安宁市草铺镇森林地区(24°31′~25°6′ N,102°8′~102°37′ E),平均海拔1 968 m。
试验样本为思茅松毛虫2龄幼虫,根据安宁市森林的情况在采集地方圆1 km范围内随机挑选10个样品点,每个样品点采集10头健康的2龄幼虫,总计100头,采集样本的同时将样本所在的树枝带回实验室,用于2龄幼虫饲养,为后续研究做准备。
1.2 分离培养基与试剂、仪器
分离培养基:牛肉膏蛋白胨培养基(NA):牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15~20 g,蒸馏水定容至1 000 mL,pH值7.0~7.2,121 ℃灭菌20 min。
主要试剂:培养基及生理生化鉴定所用分析纯、化学试剂(西陇化工股份有限公司),Ezup 柱式细菌基因组DNA 抽提试剂盒[天根生化科技(北京)有限公司],PCR扩增体系试剂(硕擎生物科技有限公司)。
主要仪器:YXQ-LS立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)、AL204电子天平(Mettler-Toledo Group)、SW-CI超净工作台(上海博讯实业有限公司医疗设备厂)、HHB11电热恒温培养箱(上海跃进科技仪器厂)、Haier冷藏柜、HH-2数显电子恒温水浴锅(金坛市丹瑞电器厂)DHG-9053A型、电热恒温鼓风干燥箱(上海一恒科学仪器有限公司)、ZHWY-200B恒温培养振荡器(上海智城分析仪器制造有限公司)、Galanz微波炉、Midea电磁炉、70型离子交换纯水器(上海南华医疗器械厂)、SZ-96自动纯水器(上海亚荣生化仪器厂)、FM130制冰机(GRANT)、微量移液器(2.5、10.0、50.0、200.0、1 000 μL)(芬兰Finnpipette)、HBA-1960 PCR扩增仪(MJ RESEARCH)、DYY-8C电泳仪及电泳槽(北京市六一仪器厂)、凝胶成像分析仪(美国Bio-Rad公司,Gel-Doc XR+)。
1.3 肠道细菌的分离纯化
选取100头健康的2龄幼虫,试验前饥饿处理40 h即在恒温22~24 ℃、恒湿80%~85%条件下,无菌水喂养幼虫,40 h后待其排空体内食物残渣后进行试验。将试验幼虫置于冰上3~5 min,待其昏迷;采用70%乙醇擦拭幼虫体表30 s,无菌水冲洗 2~3遍,0.1%HgCl棉球擦拭幼虫体表10 s,无菌水冲洗4~5次,在超净工作台中将体表消毒好的幼虫固定于无菌蜡盘上,使用灭菌后的细尖钳将幼虫腹部剖开,取出整个肠道,并立即用0.9%无菌NaCl溶液冲洗表面2次,然后将肠道取出放入无菌离心管中,并向离心管中加入1 mL PBS缓冲液研磨成匀浆,备用。
吸取上述肠道匀浆1 mL置于9 mL PBS缓冲液中,稀释成10,按照10倍梯度稀释至10,吸取每个浓度稀释液100 μL分别涂布于NA培养基中,每个梯度涂3个平板,作为试验组。取最后一次清洗的无菌水100 μL涂布于NA培养基上,作为试验空白对照组。将涂布均匀的培养平板倒置于37 ℃培养箱内,培养72 h后观察空白对照是否有菌落形成,若无菌落长出,则选择单菌落数在30~300的培养皿,根据涂有肠道内容物悬液培养皿上单菌落的不同形态特征,挑选单菌落移至新的NA培养基平板上,采用分三区的划线法进行菌株纯化,直至菌株形态基本一致,得到纯菌株。将得到的菌种保藏于NA斜面培养基中,4 ℃保存备用。
1.4 2龄幼虫肠道可培养菌株的形态观察
将经分离纯化得到的纯菌株用平板划线法接种于新的NA平板上,在37 ℃下培养24~48 h,待菌落长成后,对菌落进行染色并参考《常见细菌系统鉴定手册》对菌落特征进行描述。
1.5 2龄幼虫肠道可培养菌株的生理生化鉴定
按照《现代微生物学实验技术》、《微生物学实验教程》等微生物生理生化鉴定的方法,对2龄幼虫肠道细菌进行生理生化鉴定。
1.6 2龄幼虫肠道细菌16S rDNA分子鉴定
1.6.1 肠道细菌基因组DNA提取及PCR扩增 在NA培养基上活化分离得到的纯菌株,然后接种至液体培养基扩大培养、离心、收集菌体,利用Ezup柱式细菌基因组DNA抽提试剂盒提取2龄幼虫肠道细菌基因组DNA。用1.0%的琼脂糖凝胶检测提取出的细菌基因组DNA,得到的片段大小符合细菌基因组DNA后,再将检测合格的DNA产物作为16S rDNA序列扩增模板。扩增引物选择:正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR扩增体系为:25.0 μL的2×PCR MasterMix;3.0 μL的模板DNA;10.0 μmol/L 正向引物27F和反向引物1492R各1.0 μL;双蒸水补充至50.0 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸3 min,30 个循环;72 ℃终延伸5 min,-20 ℃保存。取 4.0 μL PCR扩增后的产物用1%琼脂糖凝胶进行电泳检测,将检测合格的PCR扩增产物送生工生物工程(上海)股份有限公司测序。
1.6.2 2龄幼虫肠道细菌系统发育树构建 通过DNA MAN6.0软件进行矫正及拼接测得的序列,然后将拼接完成的16S rDNA序列在http://www.ncbi.nlm.nih.gov/中与GenBank数据库中的序列进行BLAST同源性比对,选出与菌株相似度最高的序列,运用软件MEGA 7.0构建Neighbor-Joining系统发育树,判定其分类学关系。
1.7 分离率与群落结构多样性分析
(1)分离率与相对分离率,分别衡量的是2龄幼虫肠道细菌丰富度和某种2龄幼虫肠道细菌的优势度。分离率指从样品中分离纯化得到的菌株数与全部样本虫数的比值;相对分离率指分离到的某种2龄幼虫肠道细菌株数占分离到的总菌株数的百分率。
(2)群落结构多样性分析
多样性指数的计算公式如下:
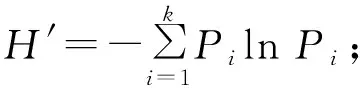
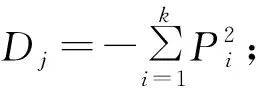
③Margalef丰富度指数:=(-1)/ln;
上述3个公式中,表示某个2龄幼虫肠道细菌的种类数,表示某个2龄幼虫肠道细菌的总量,表示某种2龄幼虫肠道细菌的相对分离率。
2 结果与分析
2.1 2龄幼虫肠道细菌的分离结果
从100头2龄幼虫肠道中共分离得到115株细菌,分离率达115.00%。根据菌落的形态特征共有8个类群,整理编号得:N201~N208。
2.2 2龄幼虫肠道细菌形态特征
对分离得到的8株细菌的菌落特征与革兰氏染色结果进行观察,结果(表1)表明,8株菌株中多数菌株的革兰氏染色结果呈阳性,仅有1株呈阴性。且大部分菌株为杆状,仅有N207、N208为球状,N202为拟球状;大部分菌株边缘整齐且不透明,只有N206、N207半透明;多数菌株表面光滑湿润。
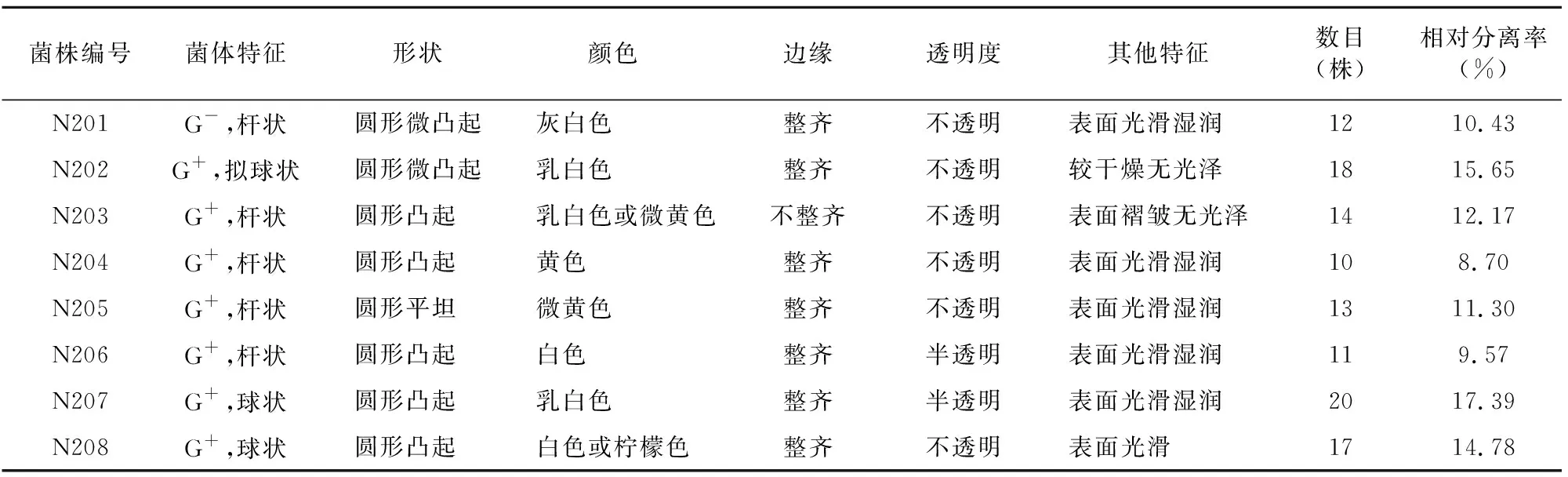
表1 2龄幼虫肠道细菌的菌落形态特征
2.3 2龄幼虫肠道细菌生理生化鉴定及多样性分析
经过对生理生化指标(表2)的聚类分析可知,在欧氏距离4.8左右处,可将8个细菌类群划分为2个遗传聚类组,N204自成一类,其他7个细菌类群为一类,其中,N201、N206属于一类,N202、N203、N205、N207、N208属于另一类(图1)。

表2 2龄幼虫肠道可培养细菌的生理生化特征
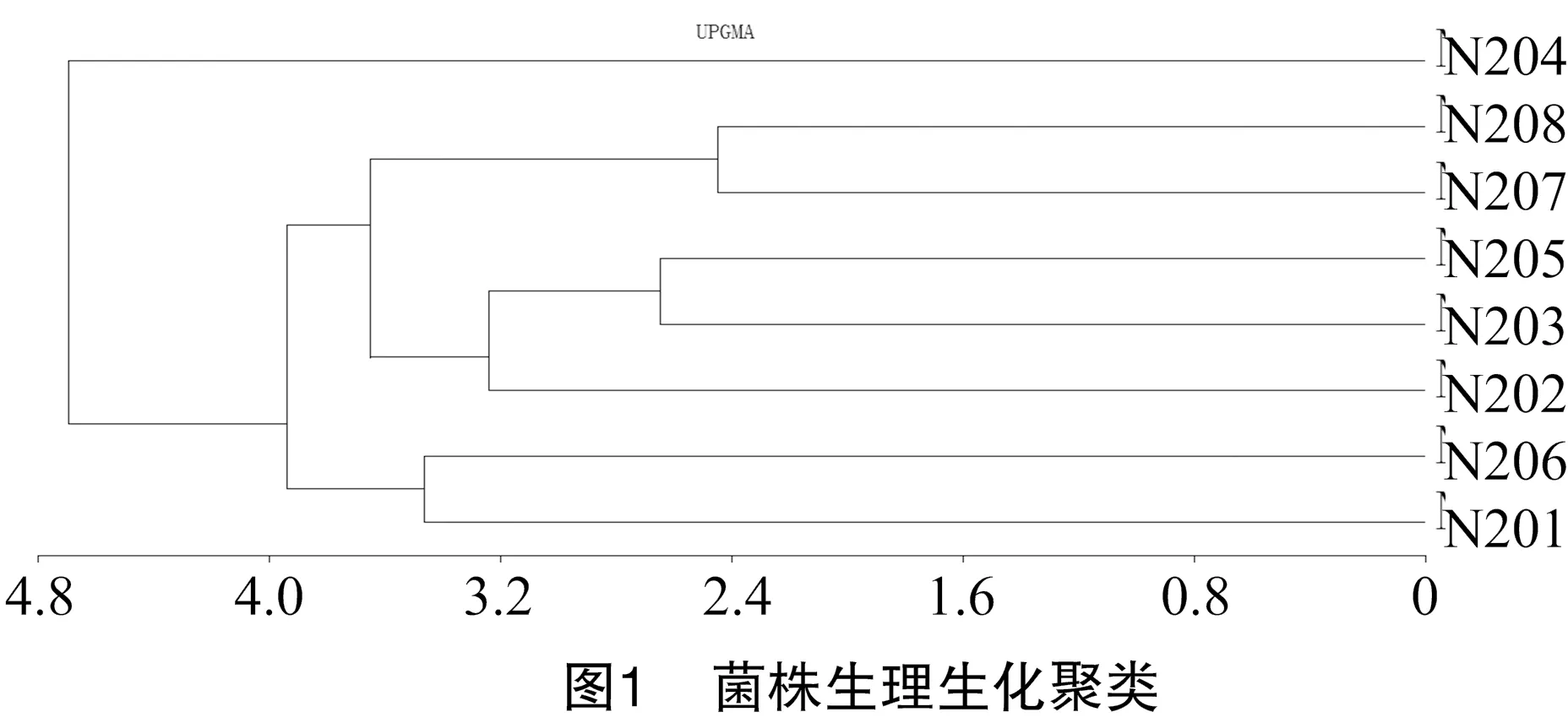
结合生理生化指标、细菌的形态特征、菌落及显微形态特征,查询细菌鉴定手册后,将分离到的8种细菌形态,初步鉴定为,N201、N206均属于肠杆菌属sp.,N202、N207、N208为葡萄球菌属sp.,N203、N203为芽孢杆菌属sp.,N204为棒状杆菌属sp.,部分菌株因为菌种形态过于相似,需进一步进行后续分子生物学鉴定。
由表1可知,115株2龄幼虫肠道细菌中,葡萄球菌属sp.(N202、N207和N208)相对分离率为48.00%,是思茅松毛虫2龄幼虫肠道细菌的优势菌群。另外,思茅松毛虫2龄幼虫肠道细菌的Shannon多样性指数、Simpson优势度指数、Margalef丰富度指数分别为2.052 6、0.868 2、1.475 3,说明思茅松毛虫2龄幼虫肠道细菌具有丰富的多样性。
2.4 2龄幼虫肠道可培养细菌16S rDNA分析结果
将所获8种细菌形态2龄幼虫肠道细菌16S rDNA序列在GenBank中注册,获得GenBank登录号。由表3可知,分离到的2龄幼虫肠道细菌与相应菌株的16S rDNA序列相似度在97%~99%。115株细菌隶属于4个属、8个类群,初步鉴定为,N201为阿氏肠杆菌,N202为木糖葡萄球菌,N203为枯草芽孢杆菌,N204为嗜甘氨酸棒状杆菌,N205为阿氏芽孢杆菌,N206为肠杆菌属sp,N207为科氏葡萄球菌,N208为表皮葡萄球菌,这些思茅松毛虫2龄幼虫肠道细菌均不能确定其真正的种属地位,需要做进一步研究以鉴定其分类学地位。
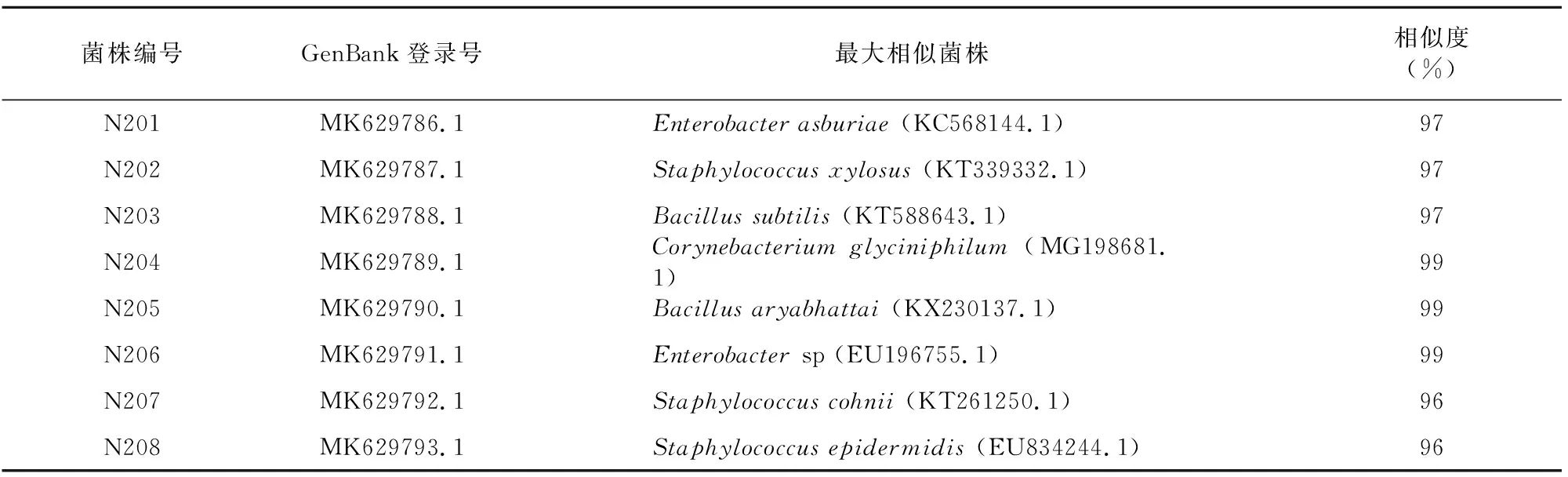
表3 2龄幼虫肠道细菌GenBank登录号及最大相似菌株
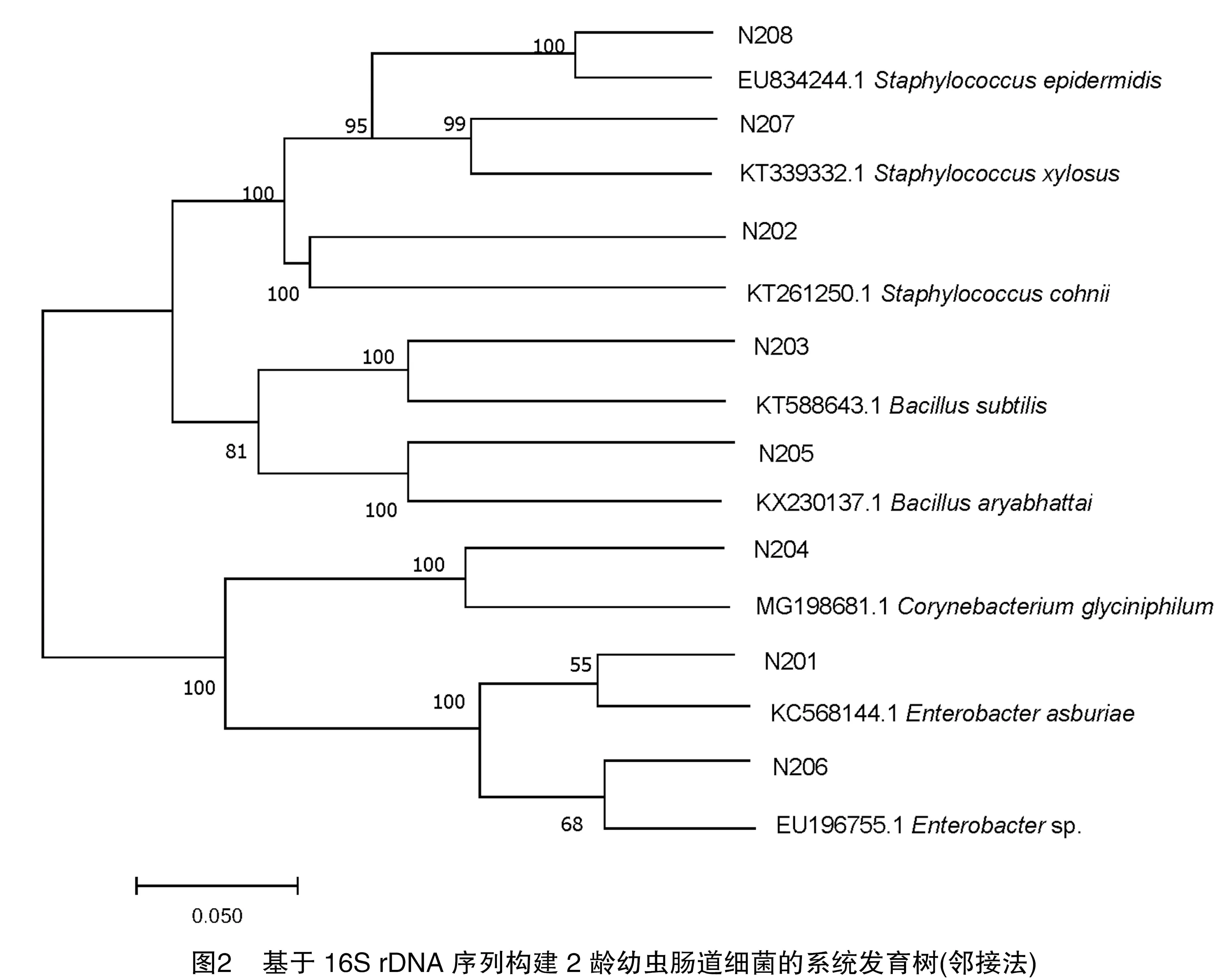
2.5 系统发育树
将2龄幼虫肠道细菌的16S rDNA序列进行系统发育进化分析,构建系统发育树。由图2可知,思茅松毛虫2龄幼虫肠道可培养细菌归属于3个大类,第一大类为厚壁菌门,分别为:芽孢杆菌属sp.、葡萄球菌属sp.;第二大类为变形菌门,为肠杆菌属sp.;第三大类为放线菌门,为棒状杆菌属sp.。
3 结论与讨论
思茅松毛虫对思茅松等松科植物有严重危害,由于对松科植物的危害而对林业造成巨大的损失,对生态环境和人类生产生活造成巨大影响。本研究以思茅松毛虫2龄幼虫为研究材料,通过对2龄幼虫肠道中的可培养细菌进行菌落观察、生理生化实验和16S rDNA同源性分析,共分离得到115株肠道可培养细菌,初步推测隶属于4个属、8个类群。通过对肠道细菌的相对分离率进行分析,葡萄球菌属的相对分离率最高,为48.00%,是2龄幼虫肠道细菌的优势菌属。通过对其多样性做一步分析,得到肠道可培养细菌具有丰富的多样性。
不同地域的思茅松毛虫肠道细菌种类存在一定差异。本次试验样品2龄思茅松毛虫幼虫采集地为云南安宁地区,结果显示2龄思茅松毛虫肠道可培养细菌有115株,属于sp.、sp.、sp.、sp.;张武先等利用传统培养法从采自云南思茅地区的思茅松毛虫2龄幼虫肠道内分离出了5株好氧细菌属于sp.。
同一区域不同龄期思茅松毛虫肠道微生物种类不尽相同。李选文等从云南安宁采集的思茅松毛虫6龄幼虫,从肠道内分离出104株菌,隶属于芽孢杆菌属、类芽孢杆菌属、苍白杆菌属、短芽孢杆菌属、微球菌属、莫拉菌属、栖水菌属、土壤芽孢杆菌属、葡萄球菌属、普罗威登斯菌属。康柳等从云南昆明采集健康的松毛虫,实验室人工饲养至3龄然后在其肠道内分离出11株细菌,分别属于sp.、sp.、sp.、sp.、sp.。孙佑赫等从采自普洱地区的4龄幼虫肠道内分离出11株细菌,分别属于sp.、sp.、sp.、sp.、sp.、sp.。王金华等从采自普洱的5龄幼虫肠道内分离出10株细菌,分别属于sp.、sp.、sp.、sp.。孙佑赫等从采自普洱市的6龄幼虫肠道内分离出6株细菌,分别属于sp.,sp.。马艳芳等从采自普洱市的7龄幼虫肠道内分离出14株细菌,分别属于sp.、sp.、sp.、sp.。
昆虫通常通过环境和食物获取各类微生物,所以不同的生长环境及食物使幼虫摄入体内的细菌不同,从而影响幼虫肠道细菌的种类。研究发现极端碱性条件不利于绝大多数细菌的生长,也有些细菌能在极端碱性条件下生活,如肠球菌能在pH值却高达11~12的鳞翅目幼虫中肠里生活,说明肠球菌可能以某种方式缓冲肠道极端pH值。本研究通过对2龄幼虫的肠道细菌分离得到了包含球菌在内的8个类群细菌,这为防治思茅松毛虫提供了依据。
随着分子生物学技术的发展,可以通过宏基因学技术直接提取肠道细菌的总DNA,进而分析出整个肠道的细菌种类,使得对昆虫的肠道微生物的研究更加方便。本次试验通过纯培养技术分离得到的2龄幼虫肠道细菌只是肠道细菌中很少的一部分,需要结合宏基因组技术,才能得到较为全面的细菌类群。
思茅松毛虫是林业重要的害虫,尤其是对松科植物危害十分严重,对其肠道微生物进行研究,不仅可以补充昆虫肠道微生物资源库,还可以据此进一步分析肠道细菌对昆虫生长发育的影响,最终得到防治思茅松毛虫的生物制剂,从而减少林业害虫的危害。

