不同产地烈香杜鹃的质量评价
曹 盼, 张樱山, 魏学明, 王秉鹏, 潘慧清, 褚延斌
(1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中药现代制药工程研究院,甘肃 兰州 730010)
烈香杜鹃为杜鹃花科植物烈香杜鹃RhododendronanthopogonoidesMaxim.的干燥花和叶[1],又名小叶枇杷、白香柴、黄花杜鹃[2],其味甘、涩,性平,具有清热消肿和补肾功效,藏医常用于治疗培根病、肺病、脾胃虚寒、消化不良、水土不服等症状[3],为藏药“达里”的来源植物之一[4],主要含有黄酮类、挥发油、香豆素、萜类等化学成分[5-9],黄酮类尤其丰富,具有抗炎、镇咳、平喘、祛痰、抑菌、降压及心血管系统方面的药理作用[10-11],主要分布于西藏、四川、甘肃等地[12]。中药质量控制须考虑“药材源头-制剂工艺-制药装备-中药制剂”全过程,形成全程可追溯、可测量且质量可反馈的“整体、辩证、动态、全程”多要素的质量观[13],制定合理的药材质量标准是保证药材质量的基础,是患者用药安全、有效的关键基础[14],也是药材有效检验的依据[15]。
HPLC指纹图谱具专属性强、稳定性和重复性好等特点[16],能全面呈现药材专属图谱。本实验通过测定金丝桃苷含量并建立HPLC指纹图谱以期更全面的控制烈香杜鹃药材质量,并结合SPSS聚类分析、主成分分析[17]和灰色关联度分析及选择具有代表性的指标成分评价不同产地烈香杜鹃质量,为控制烈香杜鹃药材质量提供进一步参考。
1 材料
1.1 仪器 Waters 2695型高效液相色谱仪、Waters 2424型蒸发光散射检测器(美国Waters公司);XS205-DU型电子分析天平(瑞士Mettler-Toledo公司);DZF-6050型真空干燥箱(巩义市予华仪器有限责任公司);HWS26型电热恒温水浴锅(上海恒科科技发展有限公司)。
1.2 试剂与药物 金丝桃苷对照品(批号111521-201909,纯度94.9%)购自中国食品药品检定研究院。HPLC用试剂为色谱纯;其余试剂均为分析纯。
1.3 药材 12批药材分别采自拉萨(S1)、夏河藏医院(S2)、青海(S3)、青海药市(S4)、日多(S5)、榆中(S6)、小昭寺(S7)、黄河药市1(S8)、黄河药市2(S9)、昌都(S10)、甘南1(S11)、甘南2(S12),经甘肃中医药大学晋玲教授鉴定为烈香杜鹃RhododendronanthopogonoidesMaxim.的干燥花和叶。
2 方法与结果
2.1 色谱条件 参考文献[18-20]报道。Agilent Eclipse Plus C18色谱柱(250 mm×4.6 mm,5 μm);流动相甲醇(A)-0.1%磷酸(B),梯度洗脱(0~10 min,10%~31%A;10~39 min,31%A;39~56 min,31%~42%A;56~70 min,42%~49%A;70~71 min,49%~10%A;71~86 min,10%A);体积流量1.0 mL/min;柱温30 ℃;检测波长254 nm;进样量10 μL。
2.2 对照品溶液制备 精密称取金丝桃苷对照品4.32 mg,置于25 mL量瓶中,甲醇制成质量浓度为163.99 μg/mL的溶液,即得。
2.3 供试品溶液制备 取药材粉末约1.0 g,精密称定,置于250 mL具塞锥形瓶中,加入甲醇50 mL,密塞,称定质量,加热回流30 min,冷却,甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.4 线性关系考察 精密吸取“2.2”项下对照品溶液,依次稀释至24.60、32.80、41.00、49.20、57.40、81.99 μg/mL,在“2.1”项色谱条件下各进样10 μL测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=27 273.04X+30 964.16(r=1.000 0),在24.60~81.99 μg/mL范围内呈良好的线性关系。
2.5 精密度试验 精密称称取药材1.0 g,按“2.3”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定6次,测得金丝桃苷峰面积RSD为0.19%,表明仪器精密度良好。
2.6 稳定性试验 精密称取药材1.0 g,按“2.3”项下方法制备供试品溶液,于0、2、4、8、12、18、24 h在“2.1”项色谱条件下各进样10 μL测定,测得金丝桃苷峰面积RSD为0.35%,表明溶液在24 h内稳定性良好。
2.7 重复性试验 精密称取药材1.0 g,平行6份,按“2.3”项下方法制备供试品溶液,在“2.1”色谱条件下各进样10 μL测定,测得金丝桃苷峰面积RSD为1.04%,表明该方法重复性良好。
2.8 加样回收率试验 取金丝桃苷含量已知的药材12份,每份约0.2 g,精密称定,按50%、100%、150%水平加入对照品溶液,按“2.3”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定,测得金丝桃苷平均加样回收率为91.51%~96.69%,RSD为1.47%。
2.9 样品含量测定 取12批样品适量,按“2.3”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定,平行3份,计算金丝桃苷含量,结果见表1。由此可知,甘南1(S11)中金丝桃苷含量最高,其次是青海(S3)、青海药市(S4)、榆中(S6),昌都(S10)最低,可能是产地不同,海拔、土壤、气候等生态条件差异,采集时间不一所致。
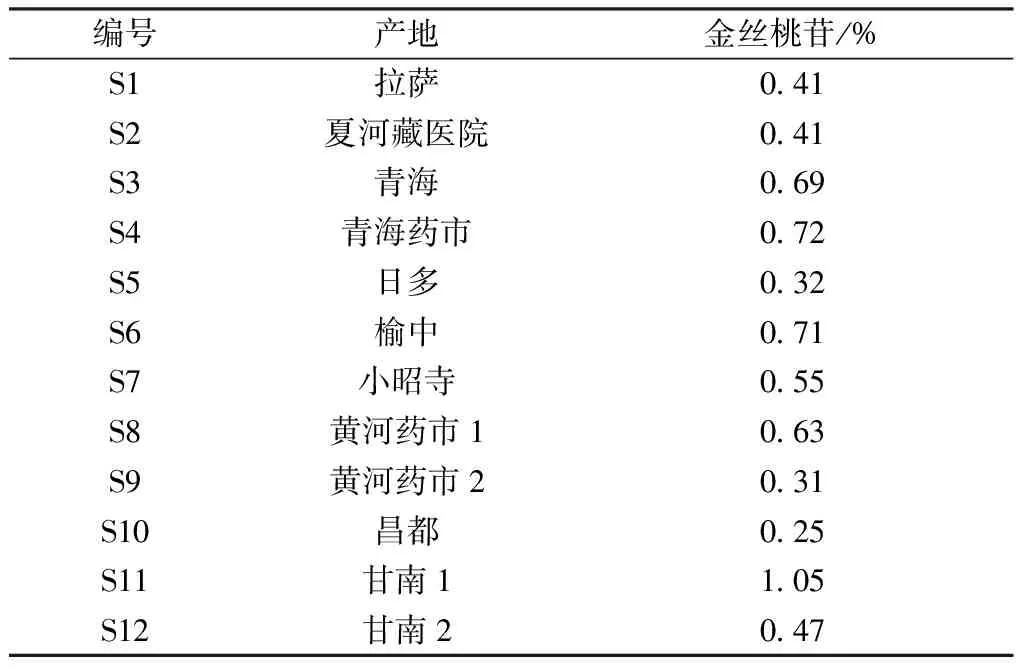
表1 金丝桃苷含量测定结果
2.10 特征图谱方法学考察
2.10.1 精密度试验 精密称取药材(S1)1.0 g,按“2.3”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定6次,以10号峰(金丝桃苷)为参照,测得15个共有峰相对保留时间RSD均小于1.53%,相对峰面积RSD均小于4.28%,表明该方法精密度良好。
2.10.2 稳定性试验 精密称取药材(S1)1.0 g,按“2.3”项下方法制备供试品溶液,室温下于0、2、4、8、12、18、24 h在“2.1”色谱条件下进样测定,以10号峰(金丝桃苷)为参照,测得15个共有峰相对保留时间RSD均小于2.16%,相对峰面积RSD均小于5.13%,表明溶液在24 h内稳定性良好。
2.10.3 重复性试验 精密称取药材(S1)1.0 g,共6份,按“2.3”项下方法制备供试品溶液,在“2.1”色谱条件下进样测定,以10号峰(金丝桃苷)为参照,测得15个共有峰相对保留时间RSD均小于1.19%,相对峰面积RSD均小于5.06%,表明该方法重复性良好。
2.11 HPLC指纹图谱建立
2.11.1 图谱生成 取12批样品,每批1.0 g,按“2.3”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定,采用《中药色谱指纹图谱相似度评价系统》(2012A版)生成图谱,见图1,相似度分别为0.925、0.957、0.976、0.976、0.934、0.957、0.891、0.981、0.956、0.867、0.951、0.966,表明不同产地之间药材所含成分差异较小,质量稳定性良好,而且对照指纹图谱具有较好的一致性;小昭寺(S7)、昌都(S10)相似度相对较低,可能由于产地、自然环境、采集时间存在差异,导致其所含成分含量有所不同。
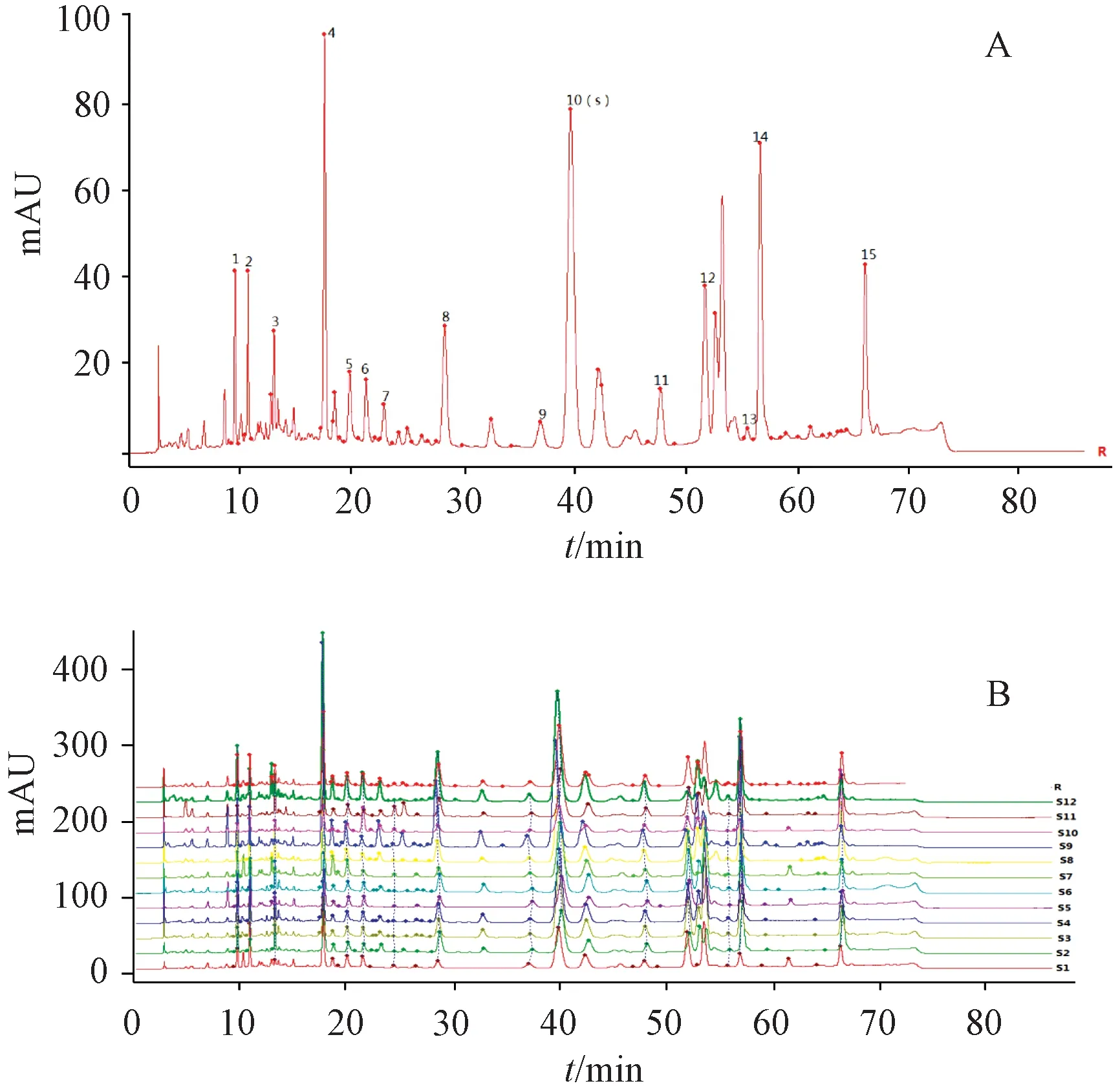
图1 药材对照指纹图谱(A)、12批样品HPLC指纹图谱(B)
通过与对照品比较,指认出10号峰为金丝桃苷,由于其峰面积较大,分离度较好,而且所有样品共有,故以其为参照,测得其他色谱峰相对保留时间为0.09%~1.88%,相对峰面积为16.31%~178.17%,表明不同产地药材共有成分虽然一致,但其所含成分含量存在差异,可能与产地、生长环境、采集时间等因素有关。
2.11.2 聚类分析 以共有峰峰面积为变量,采用SPSS 22.0软件将其标准化,测度为欧氏距离的平方,进行聚类分析,结果见图2。由此可知,类间距为10时,12批样品可聚为4类,S1~S8为一类,S9、S12为一类,S10为一类,S11为一类,结合金丝桃苷含量可知,S11质量最优,S1~S8良好,S9、S12较差,S10最差。
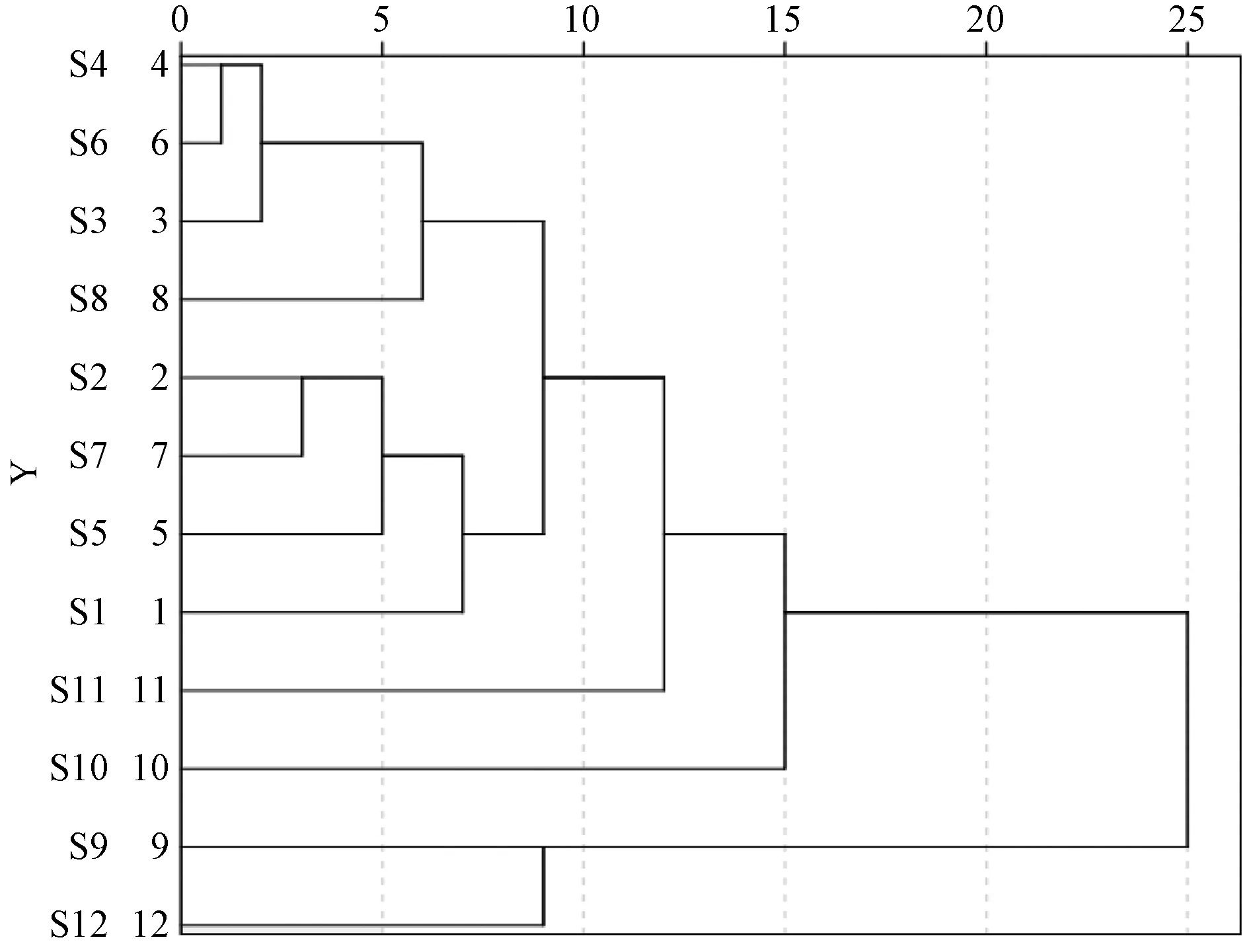
图2 共有峰面积聚类分析树状图
2.11.3 主成分分析 以共有峰峰面积为变量,采用SPSS 22.0软件进行主成分分析,结果见表2。由此可知,前4种主成分累积贡献率为86.976%,即能反映药材86.976%的信息,其中第一主成分特征值为6.816,贡献率为45.441%;第二主成分特征值为2.826,贡献率为18.838%。
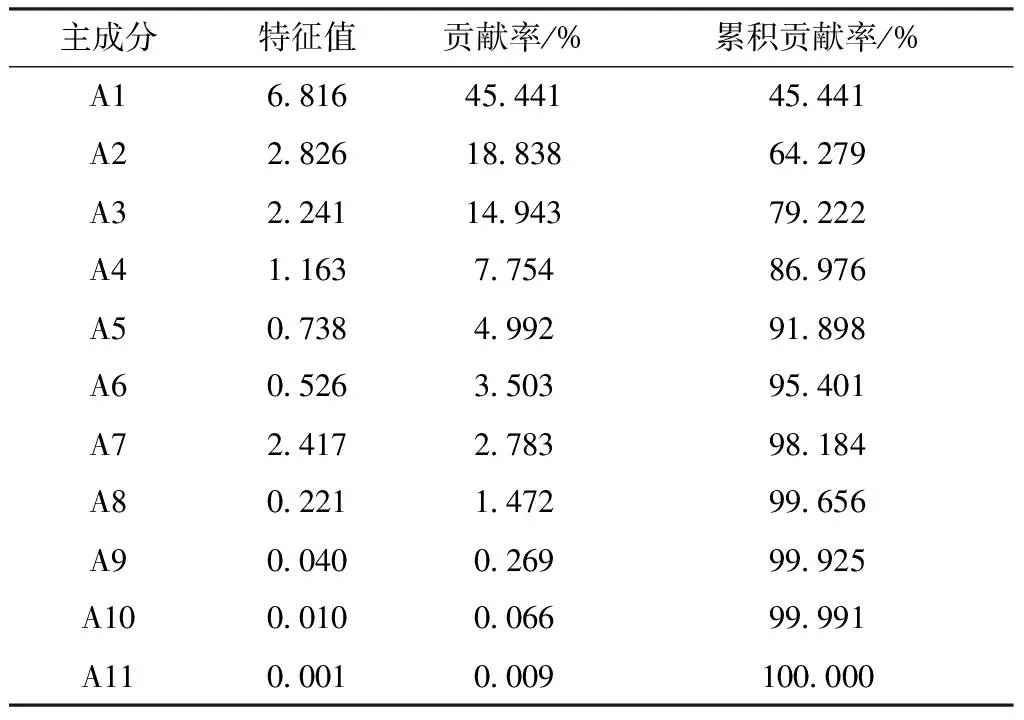
表2 共有峰特征值
以主成分分析对应的贡献率为权重,对其得分进行线性加权,建立综合评价函数为Y=0.522PC1+0.175PC2+0.171PC3+0.089PC4,计算综合评分并排序,结果见表3。由此可知,S9综合评分最高,即质量最优;S1、S10最低,即质量最差。
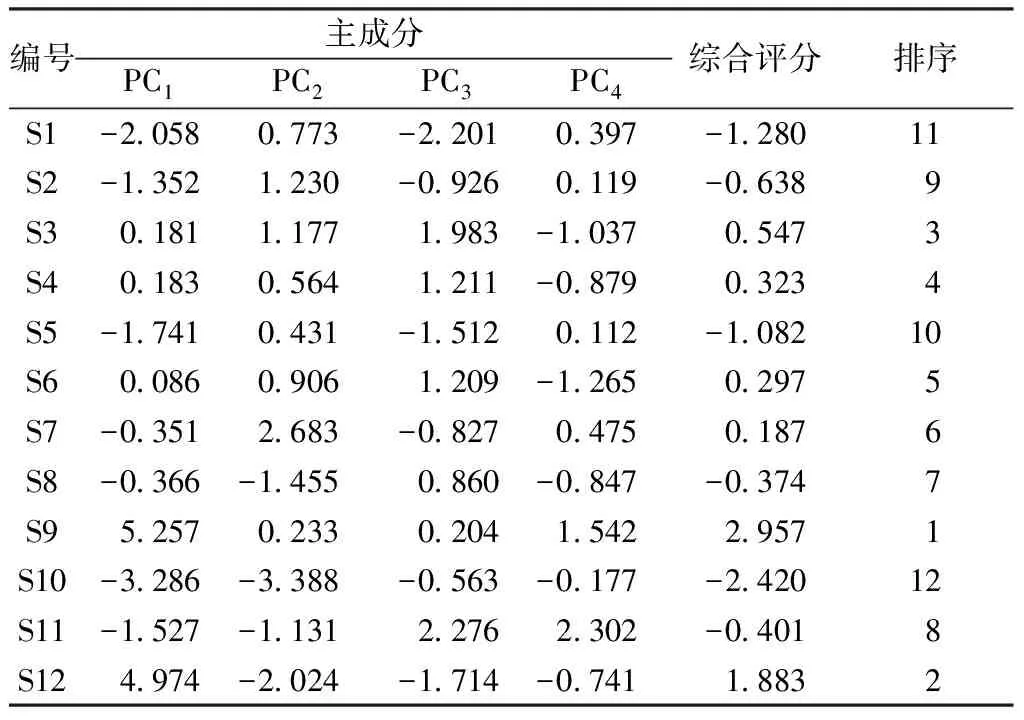
表3 主成分综合评分和排序
将共有峰面积数据导入Simca-p14.1软件,得到主成分分析二维分布散点图,见图3。由此可知,不同产地药材聚集在同一片区域中,与聚类分析结果基本一致。

图3 主成分分析二维分布散点图
2.11.4灰色关联度分析 将共有峰峰面积导入DPS9.01版软件,进行整体灰色关联度分析,数据序列转换方式为均值化,分辨系数为0.1,结果见表4。由此可知,S3(青海)、S4(青海药市)、S6(榆中)关联度最高,S10、S12较低,表明不同产地药材质量因其所含成分含量不同而有所差异。
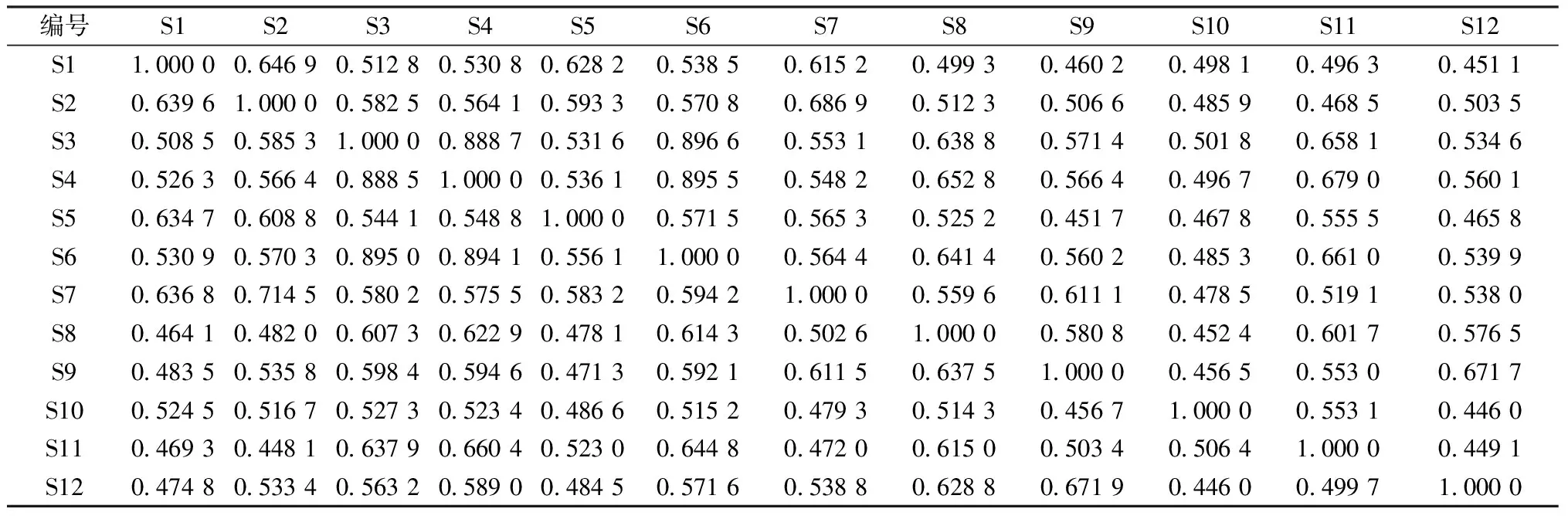
表4 灰色关联度分析关联系数
3 讨论
3.1 HPLC含量测定 金丝桃苷是烈香杜鹃中黄酮类化合物,含量相对较高,故选择其作为指标成分。分别考察了不同提取溶剂(甲醇、50%甲醇、75%甲醇、50%乙醇、75%乙醇、95%乙醇、无水乙醇)、提取方法(超声、振摇、回流)、提取时间(15、30、60、90 min)、溶剂量(25、50、75、100 mL)对金丝桃苷含量的影响,发现,以甲醇为溶剂、溶剂量50 mL、回流提取30 min时其含量最高。再进行耐用性试验,包括体积流量(0.9、1.0、1.1 mL/min)、柱温(25 ℃、30 ℃、35 ℃)、流动相(①0~10 min,9%~30%A;10~41 min,30%A;41~58 min,30%~42%A;58~70 min,42%~49%A;70~71 min,49%~9%A;71~86 min,9%A;②0~10 min,10%~31%A;10~39 min,31%A;39~56 min,31%~42%A;56~70 min,42%~49%A;70~71 min,49%~10%A;71~86 min,10%A;③0~10 min,11%~32%A;10~39 min,32%A;39~56 min,32%~42%A;56~70 min,42%~49%A;70~71 min,49%~11%A;71~86 min,11%A)、色谱柱(PLUS1、PLUS2、PLUS3、shimndzu)、流动相pH(pH2.5、3.0、3.5),结果含量均无明显差异,RSD%均小于3.0%,说明该方法耐用性良好,色谱条件稳定可靠,能够有效控制药材质量。但因只测一种成分不具有代表性,故以后可以同时测定多种成分含量,并建立指纹图谱,更能全面控制药材质量,便于临床应用。
3.2 指纹图谱及相关分析 通过HPLC指纹图谱对12批样品进行质量分析,发现对照指纹图谱共有峰保留时间与各产地烈香杜鹃样品基本吻合,除小昭寺(S7)、昌都(S10)外,其余10批相似度均大于0.92,小昭寺(S7)、昌都(S10)的药材可能因为产地不同、生长环境差异及采摘时间存在差异而导致相似度稍低;15个共有峰峰面积存在较大差异,说明不同产地烈香杜鹃共有成分虽一致,但含量明显存在差异,这可能与生长环境等气候土壤等因素有关。由于时间及其他条件影响,目前采集的烈香杜鹃样品批次相对较少,后续将增加样品批次,并采用其他技术对各共有峰作进一步确认,建立更明确的指纹图谱模式。
运用SPSS 22.0软件对12批药材进行聚类分析,将其分为4类;通过主成分分析,降维提取了4个主成分,能够反映86.976%的信息。但相似度评价、聚类分析、主成分分析的结果不一致,其原因可能是烈香杜鹃成分复杂,产地环境不一,相似度评价时特征峰校正不全面,导致一些信息缺失,所以各产地相似度较高;主成分分析分析中只提取了特征值大于1的四个主成分,但特征值小于1的其他成分仍存在影响,所以结果有偏差。通过灰色关联度分析,从整体上考察了12个产地烈香杜鹃之间的相关性,发现S3、S4、S6关联度最高,S2、S7次之,S10、S12较低。

