七彩山鸡养殖场铜绿假单胞菌的耐药性、多位点序列分型及遗传进化分析
向 勇,李庆钵,刘 鹏,黎丽珍,姜 增,陈小燕,曹伟胜,2
(1 华南农业大学 兽医学院,广东 广州 510642; 2 岭南现代农业科学与技术广东省实验室/农业农村部人兽共患病重点实验室/广东省动物源性人兽共患病预防与控制重点实验室/人兽共患病防控制剂国家地方联合工程实验室/农业部兽用疫苗创制重点实验室,广东 广州 510642)
七彩山鸡是一种野生禽类,又称野鸡、雉鸡,在食用和药用等多方面具有可观的经济价值,并已被列入《国家保护的有重要生态、科学、社会价值的陆生野生动物名录》。基于上述优势,广东省内七彩山鸡的养殖规模逐步扩大,每年向全国多个省份提供七彩山鸡种苗。
铜绿假单胞菌Pseudomonas aeruginosa,又被称为绿脓杆菌,可以在人、动物和环境中循环传播,不仅影响养殖业的发展而且严重危害人类健康[1-2]。随着养禽业规模的逐渐扩大,由铜绿假单胞菌导致的禽类疾病显著增多[3-5]。铜绿假单胞菌严重的耐药性一直是医院临床高度关注并愈发棘手的问题[6-8],碳青霉烯类抗菌药如亚胺培南、美罗培南等是目前医院对抗铜绿假单胞菌的最后一道有效防线,铜绿假单胞菌也逐渐对这些药物产生耐药性[9-10]。近年来,有学者从鸡、候鸟及其养殖环境中分离到严重耐药的铜绿假单胞菌[11],甚至有证据表明多重耐药的铜绿假单胞菌菌株在人、动物、环境中传播,严重影响公共卫生安全[12]。多位点序列分型(Multi-locus sequence typing,MLST)是通过对多个特定管家基因进行测序来分型的分子分型方法。医院内广泛流行的铜绿假单胞菌以ST-235和ST-244为主[13-14];Martins等[11]对从候鸟菌群中分离得到的产金属β-内酰胺酶的铜绿假单胞菌进行MLST分型,发现均属于ST-277型。目前铜绿假单胞菌在七彩山鸡中的流行情况及耐药性仍然不明,也缺乏相关的MLST分型数据。
本研究对广东省规模化的七彩山鸡养殖场进行铜绿假单胞菌的分离鉴定,了解其流行情况,并对分离的铜绿假单胞菌进行抗菌药物敏感性分析,为临床合理用药提供参考;同时,采用MLST方法对分离到的耐药谱较广的铜绿假单胞菌菌株进行分子流行病学分析,探讨耐药铜绿假单胞菌的遗传进化背景。
1 材料与方法
1.1 试验材料
LB液体培养基、LB固体培养基、MH液体培养基、MH固体培养基、铜绿假单胞菌ATCC27853以及大肠埃希菌Escherichia coliATCC25922 均购自广东环凯微生物科技有限公司。NAC固体培养基、NAC液体培养基、无菌均质袋均为青岛海博生物技术有限公司产品。rTaq PCR Premix购自上海翌圣生物科技有限公司。药敏纸片为OXOID公司产品。SQ组织DNA提取试剂盒为OMEGA公司产品。
1.2 样品采集
从广东省3个规模化的七彩山鸡养殖场收集死胚及周围环境样本。对于死胚,直接收集孵化房内21日龄仍未出壳且外壳完好的胚;对于环境样本,用无菌的棉拭子采集饲料、孵化机内灰尘、笼具器械灰尘、饮水等放入装有适量灭菌NAC液体培养基的15 mL离心管中。从样品采集至运送至实验室不超过 8 h。
1.3 铜绿假单胞菌的分离鉴定
用75%(φ)乙醇溶液将死胚外壳充分消毒3次,无菌操作取出胚体并剪碎,放入无菌均质袋;加入适量无菌的NAC液体培养基,37 ℃、120 r/min培养8 h;取上述菌液以1∶10的体积比接种到新的培养基内,继续培养12~16 h;采用三线法划板于NAC固体培养基,18~24 h之后,挑取绿色单菌落,参考文献[15]进行铜绿假单胞菌特异性基因oprI的PCR扩增并送广州擎科生物有限公司测序。
1.4 药物敏感性试验
利用铜绿假单胞菌ATCC27853和大肠埃希菌ATCC25922作为质控菌株,按照K-B纸片扩散法测试铜绿假单胞菌分离株对22种抗菌药物的敏感性试验,并参照标准[16]对试验结果进行判定。抗菌药物如下:氨苄西林(Ampicillin)、复方新诺明(Complex sulfamethoxazole)、萘啶酸 (Nalidixic acid)、卡那霉素(Kanamycin)、四环素(Tetracycline)、氯霉素(Chloramphenicol)、哌拉西林(Piperacillin)、头孢噻肟(Cefotaxime)、头孢吡肟(Cefepime)、头孢他啶(Ceftazidime)、头孢哌酮 (Cefoperazone)、亚胺培南(Imipenem)、美罗培南 (Meropenem)、氨曲南(Aztreonam)、哌拉西林/他唑巴坦(Piperacillin/tazobactam)、头孢哌酮/舒巴坦(Cefoperazone/sulbactam)、妥布霉素 (Tobramycin)、阿米卡星(Amikacin)、庆大霉素 (Gentamicin)、环丙沙星(Ciprofloxacin)、左氧氟沙星(Levofloxacin)和多黏菌素 B(Polymyxin B)。
1.5 多位点序列分型
参照试剂盒说明书提取铜绿假单胞菌的总DNA,参考文献[17]中的引物序列和PCR反应体系、扩增条件,对铜绿假单胞菌的7个管家基因(acsA、aroE、guaA、mutL、nuoD、ppsA、trpE)进行 PCR 扩增并测序。将测序得到的基因序列上传至铜绿假单胞菌的MLST官网(https://pubmlst.org/paeruginosa/),得到各个管家基因序列对应的等位基因编号。7个等位基因编号按照顺序依次排列形成7个数字组成的等位基因谱并得到相应的ST型。若7个等位基因编号不能与数据库中已有数据完全匹配,则认为是新发现的ST型,将该菌株的相关资料上传至数据库,经确认后给出新的ST型编号。
1.6 遗传进化分析
将各ST型的7个管家基因序列按顺序拼接得到多个长度相同的序列,用MEGA7软件对这些拼接好的序列进行遗传进化分析,得到各ST型的遗传进化树。
2 结果与分析
2.1 样品采集数量
从广东省的3个规模化七彩山鸡养殖场收集到死胚样品共405份,采集饲料、孵化机内污垢、笼具灰尘、器械灰尘、自来水等环境样品共109份。
2.2 铜绿假单胞菌的分离与鉴定
铜绿假单胞菌在选择性培养基(NAC固体培养基)中呈现出圆形、表面光滑且湿润的绿色菌落(图1),并散发出芳香气味。对特异性基因oprI进行PCR扩增,扩增出214 bp左右的条带(图2)。结合测序结果确认为铜绿假单胞菌。本研究共分离鉴定出铜绿假单胞菌145株(分离率28.2%,145/514),其中环境样本分离出24株(分离率22.0%,24/109),死胚分离出121株(分离率29.9%,121/405)(表1)。
图1 NAC固体培养基上铜绿假单胞菌的形态特征Fig.1 Morphological characteristics of Pseudomonas aeruginosa on NAC solid medium

图2 oprI基因PCR扩增产物的琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of PCR product for oprI gene
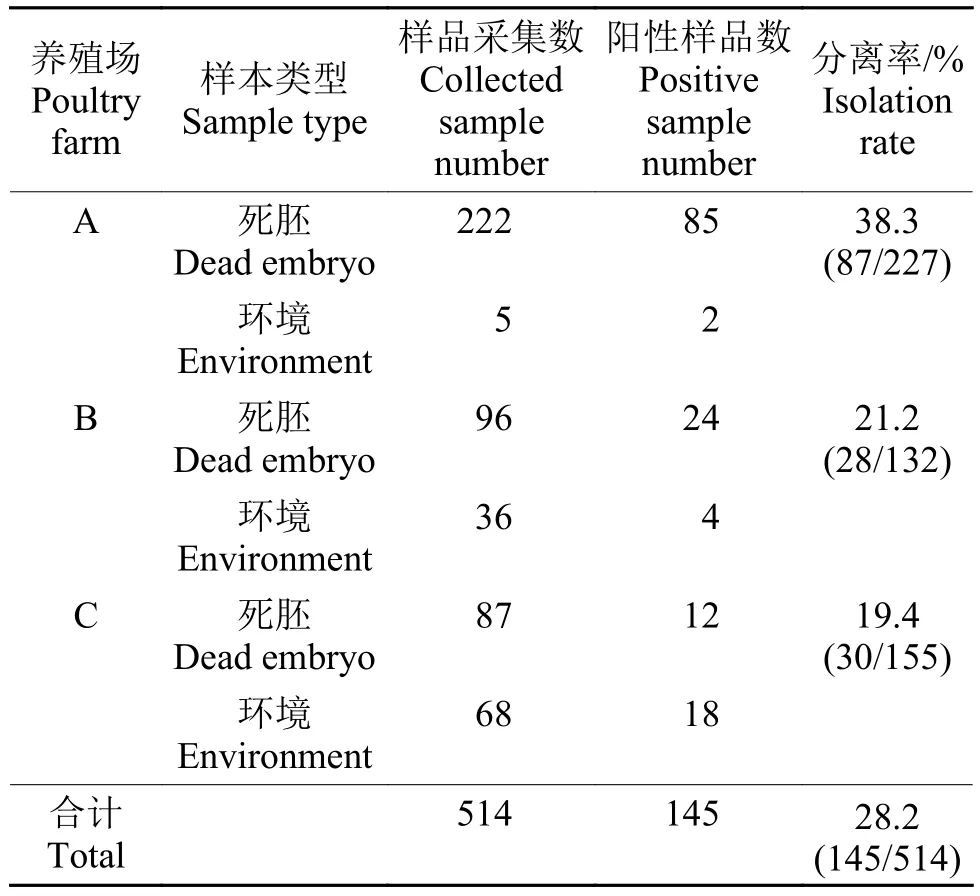
表1 不同七彩山鸡养殖场中铜绿假单胞菌临床分离株的数量及分离率Table 1 Quantity and isolation rate of clinical isolates of Pseudomonas aeruginosa from different breeding poultry farms
2.3 抗菌药物敏感性
共22种抗菌药物被用来测试分离鉴定出的145株铜绿假单胞菌菌株的药物敏感性,结果(表2)显示,除对氨苄西林、卡那霉素和萘啶酸天然耐药外,铜绿假单胞菌对复方新诺明、氯霉素、四环素的耐药性较强;其次为头孢噻肟;铜绿假单胞菌对亚胺培南、哌拉西林、头孢他啶、头孢哌酮和哌拉西林/他唑巴坦表现出较低的耐药率;未检测到对美罗培南、阿米卡星、头孢哌酮/舒巴坦和多黏菌素B耐药的铜绿假单胞菌菌株。死胚和环境来源的铜绿假单胞菌总体耐药情况相似,但环境样品分离株的耐药性要强于死胚分离株。耐药谱分析(表3)显示,所有分离菌株均表现出耐4种及以上抗菌药,最广耐15种抗菌药,其中6耐菌株最多。除天然耐药外,耐3类及以上抗菌药的铜绿假单胞菌菌株占比为73.1%(106/145),表现出多重耐药性。其中,耐3类抗菌药的菌株数量最多,占44.8%(65/145);其次为耐 4类,占 11.0%(16/145);耐 5类占 4.8%(7/145);耐7类占4.1%(6/145)。
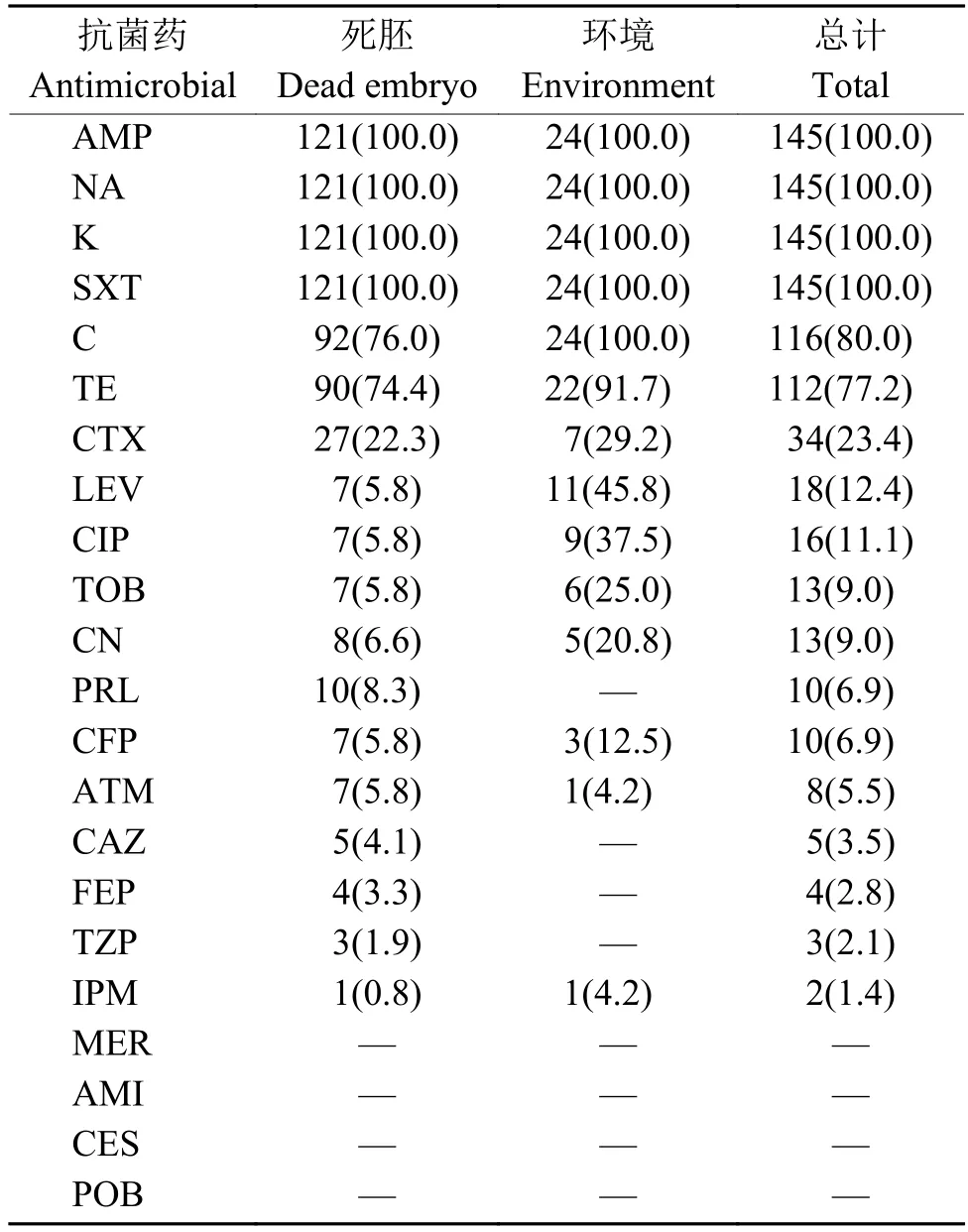
表2 死胚和环境样品中耐药铜绿假单胞菌菌株数量及占比1)Table 2 Number and proportion of drug-resistant Pseudomonas aeruginosa strain in dead embryo and environment samples

表3 铜绿假单胞菌的耐药谱及对应菌株数量Table 3 Drug resistance spectrum and strain quantity of Pseudomonas aeruginosa
2.4 多位点序列分型
从145株铜绿假单胞菌菌株中选取耐药谱较广的89株进行MLST分析,结果(表4)显示,89株菌株可分为18个ST型,呈现高度多样性,其中,72株属于原有数据库已包含的12种ST型。另外17株的ST型不包含在原数据库中,经提交相关资料至数据库并由管理员确认后得到6个新的ST型,分别为 ST-3199、ST-3200、ST-3201、ST-3202、ST-3203和ST-3204。死胚中分离到的铜绿假单胞菌以ST-260为优势ST型,环境中分离到的铜绿假单胞菌菌株ST型以ST-2100和ST-3202为主。
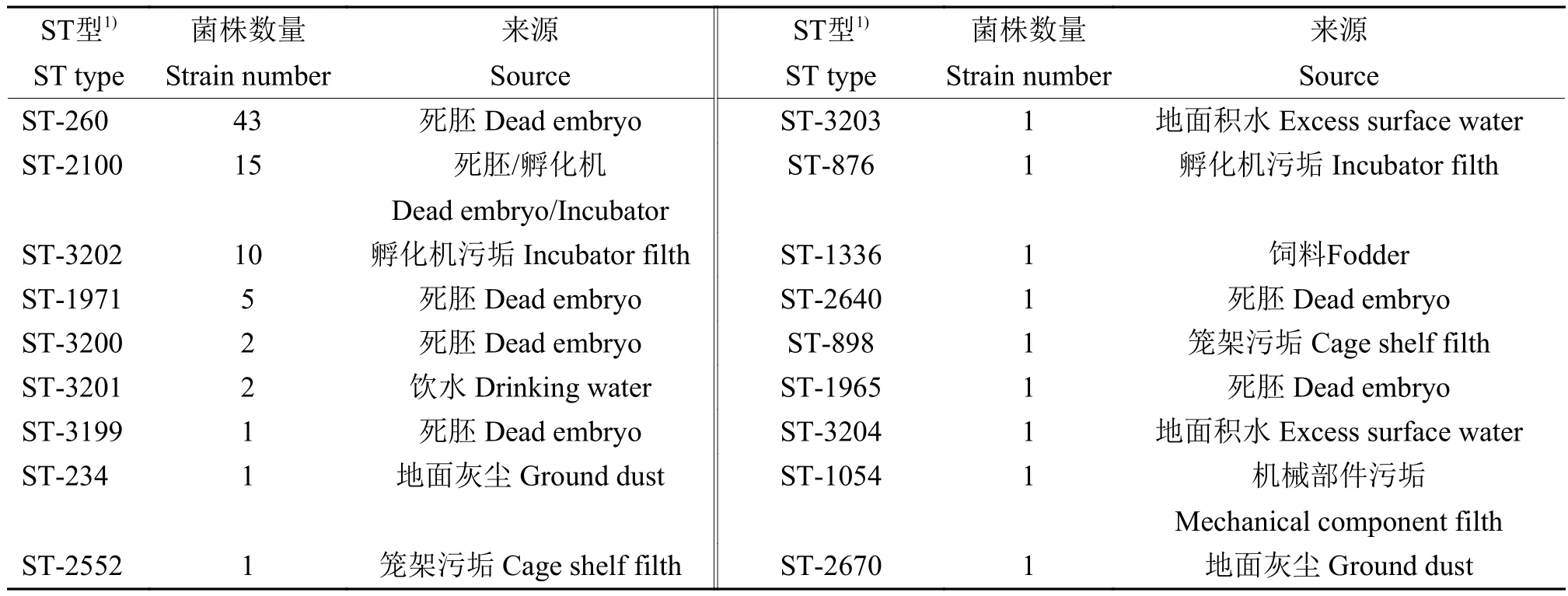
表4 89株铜绿假单胞菌菌株各ST型菌株数量及来源Table 4 Quantity and source of each ST type in 89 Pseudomonas aeruginosa strains
2.5 遗传进化分析
由图3可见,铜绿假单胞菌环境样品分离株与死胚分离株之间的亲缘关系比较紧密,如环境样品(饮水)分离株ST-3201与死胚分离株ST-3199属于同一分支,ST-3202与ST-1971、ST-2640属于同一大分支。
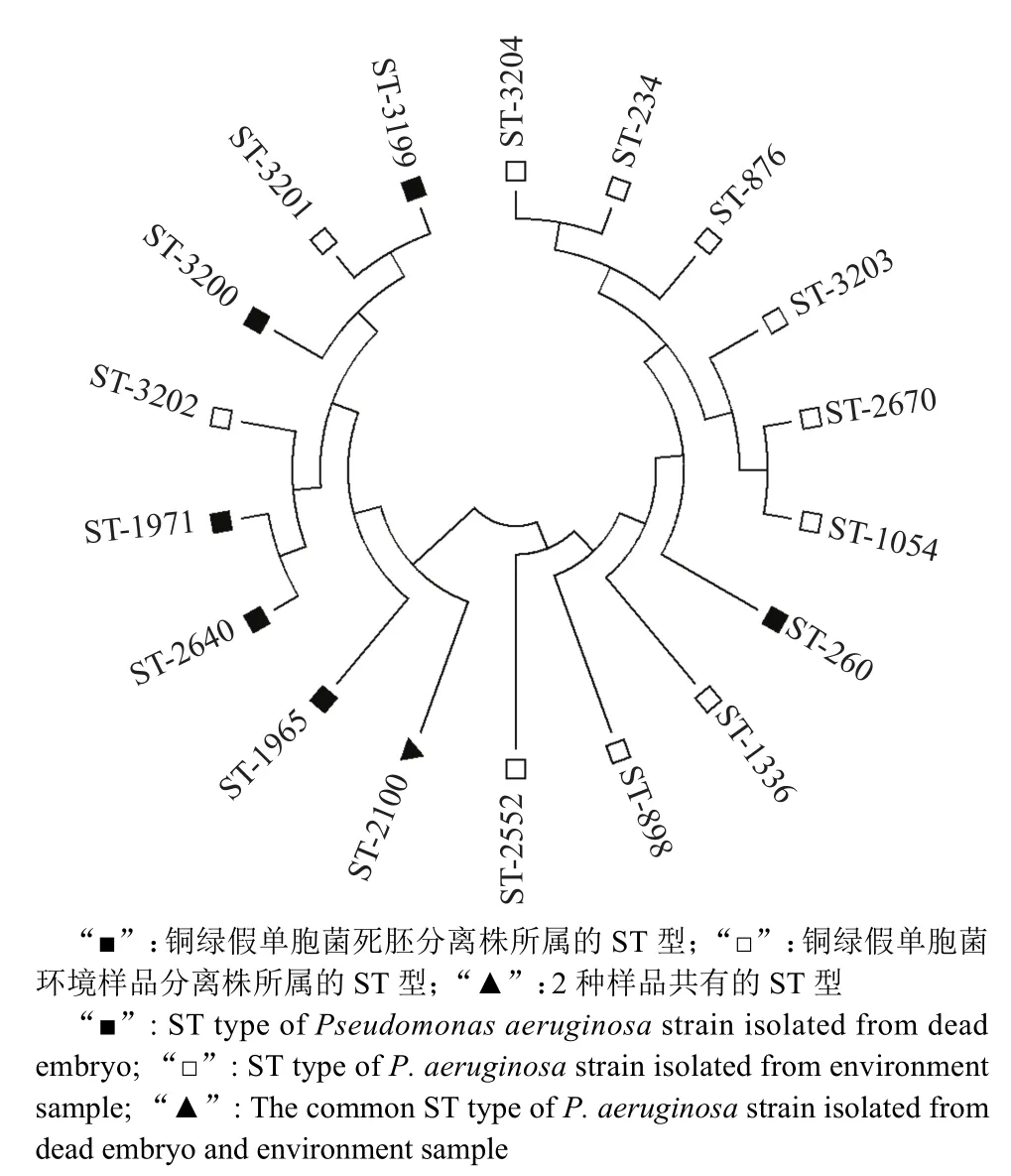
图3 死胚和环境样品中不同铜绿假单胞菌ST型的遗传进化分析Fig.3 Genetic evolution analysis of different Pseudomonas aeruginosa ST types isolated from dead embryo and environment samples
3 讨论与结论
3.1 讨论
铜绿假单胞菌是一种常见的、能引起人类和动物机会性感染的病原体。铜绿假单胞菌具有强大的代谢可塑性和多功能性,能够感染或定殖广泛的生态位,包括水生和土壤生境、动植物等[18-19],尤其危害免疫功能低下的患者[20-21]。目前关于七彩山鸡中铜绿假单胞菌流行情况的报道较少,缺乏该方面的流行病学数据。本研究从3个规模化七彩山鸡养殖场共分离到145株铜绿假单胞菌,分离率为28.2%,七彩山鸡死胚中有比较严重的铜绿假单胞菌感染,周围环境样本也被铜绿假单胞菌污染。其中,A场的死胚中铜绿假单胞菌的感染情况最为严重,这可能是导致该养殖场种蛋出雏率较低的原因之一,而环境样本如孵化机污垢中分离出的铜绿假单胞菌菌株与死胚分离株具有较近的亲缘关系也证明了该推断的合理性,胚胎被孵化机内的铜绿假单胞菌污染,并侵入蛋壳,致其死亡。因此在家禽养殖过程中,要加强饲养管理,采取严格的生物安全措施,防止铜绿假单胞菌污染种蛋,避免损失。
铜绿假单胞菌外膜的低渗透性和主动外排系统的外排作用使其对很多抗生素产生固有耐药,同时该菌还能通过产生β-内酰胺酶、外排泵表达和生物被膜等多种机制产生获得性耐药[22-23]。加之近年来临床上各种插管、导管、机械通气等侵袭性诊疗手段的应用,免疫抑制剂的广泛应用和抗生素的不合理使用导致铜绿假单胞菌的耐药形势严峻,出现了多重耐药铜绿假单胞菌,且数量日益增加,为临床的治疗带来了巨大的挑战,并在全球范围内危害人类健康[24-25]。无论铜绿假单胞菌的耐药机制如何,多重耐药铜绿假单胞菌菌株引起的感染日益增多,严重影响临床上的抗感染治疗,因此常导致较高的死亡率[1,18]。
本研究选取了常用的22种抗菌药进行药敏试验,其中亚胺培南、哌拉西林、头孢吡肟、头孢他啶等都是医院临床治疗铜绿假单胞菌感染性疾病的一线药物,但部分铜绿假单胞菌分离株也对其表现出了耐药现象,即便其耐药率较低,也应当引起重视,特别是医院临床使用频率较高的抗感染药物如亚胺培南。在本研究所调查的养殖场中,均未使用亚胺培南、哌拉西林、头孢吡肟、头孢他啶等医院临床使用的一线抗感染药物,因此推测其耐药性的出现与全球范围内医院中多重耐药铜绿假单胞菌菌株的暴发流行有关。氨苄西林、卡那霉素、萘啶酸是养殖场常用的抗菌药,但铜绿假单胞菌对其100%耐药,发生铜绿假单胞菌感染后往往治疗效果不佳。铜绿假单胞菌对复方新诺明、四环素、氯霉素三者的耐药率也很高。因此养殖场要开展药物敏感试验,根据药敏结果选择敏感的药物,且应注意交替用药,以防产生耐药性。值得注意的是,铜绿假单胞菌分离株对国家禁用的兽药(四环素、氯霉素)表现出高耐药率,一方面可能是早期使用所致;另一方面可能是医院中铜绿假单胞菌泛耐药株的全球流行传播导致的,因为四环素和氯霉素在医院临床抗感染治疗中并没有被禁用。另外,本研究耐药谱分析显示最广耐15种抗菌药,除天然耐药外,耐3类或3类以上抗菌药物的铜绿假单胞菌占比为73.1%(106/145),提示本研究采样的七彩山鸡养殖场中铜绿假单胞菌分离株的耐药情况同样不容乐观;因此在使用抗菌药时,除了要根据药敏试验结果合理运用外,还应尽量避免长期依赖使用同一种或几种抗菌药物,积极探讨抗菌药的组合应用,并开展新的抗感染药物的研发。
MLST分析是通过直接测定菌株的多个管家基因的核苷酸序列来分型的分子分型方法,常常用于细菌的群体遗传演化分析,这种基于遗传学功能的分型比传统的免疫学试验更加准确可靠。本研究对89株耐药谱较广的铜绿假单胞菌分离株进行了MLST分析,这些菌株可分为18个ST型,以ST-260占比最多,这与全球范围医院流行的ST型有所差异[26-28],但也在情理之中,可能是种属差异导致流行特点有所区别。其中有6个ST型是本研究新发现的,提示铜绿假单胞菌的进化速度较快。同时还发现来自饮水(ST-3201)和死胚(ST-3199)、孵化机污垢(ST-3202)和死胚(ST-1971)的铜绿假单胞菌表现出较近的亲缘关系。这进一步证实了我们的推断,即周边环境尤其是孵化机被铜绿假单胞菌污染对孵化率降低有一定的威胁。
3.2 结论
本研究调查的3个七彩山鸡养殖场中,不仅死胚中存在不同程度的铜绿假单胞菌感染,而且周围环境也存在相当比例的铜绿假单胞菌污染,且分离株具有较强的耐药性。铜绿假单胞菌死胚分离株的优势ST型为ST-260,环境分离株以ST-2100和ST-3202为主,且两者表现出较近的亲缘关系。因此建议做好生物安全措施,及时对种蛋、孵化机及周边环境进行清洁和消毒,并根据药敏试验结果选择有效的抗菌药并交替使用。

