微型流化床中生物质半焦水蒸气气化反应特性及动力学研究
王婷婷,曾玺,韩振南,王芳,武鹏,许光文,3
(1沈阳化工大学资源化工与材料教育部重点实验室,辽宁沈阳 110142; 2北京工商大学生态环境学院,北京 100048;3中国科学院过程工程研究所多相复杂系统国家重点实验室,北京 100190)
引 言
气化是生物质热化学转化的主要途径之一,能将低能量密度的生物质能转化为便于输送的气体燃料或合成气,广泛应用于燃气生成、IGCC发电、化学品合成等[1-4]。与生物质热解、挥发分重整和半焦燃烧等子过程相比,半焦气化的反应速率最慢,是整个气化过程的限速步骤,严重影响气化炉的处理量、产物组成和气化效率[5-6]。
在众多气化反应中,半焦-水蒸气反应比较复杂,其反应机理见表1,包含两步:(1)高温下,H2O 解离的·H和·OH自由基被半焦表面的活性位吸附、形成C(H2)和碳氧络合物C(O),碳氧络合物复杂且不稳定,在固体碳表面易分解并释放CO;(2) CO 与中间络合物C(OH)结合发生水煤气变换反应,生成次级产物CO2[7-13]。由于该气化反应的复杂性和产物多样性,准确测试反应行为和求算动力学一直是反应测试和分析的难点。

表1 半焦-水蒸气气化反应Table 1 Reaction mechanism of char and steam gasification
目前,文献中关于半焦-水蒸气气化特性的研究集中在操作条件对气化过程和气体产率的宏观影响上,对产物实时生成特性的研究很少。赵辉等[8]发现高温有利于缩短气化过程的反应时间,提高CO 产率;Tian等[14]认为温度是影响半焦反应活性的主要因素,随温度升高反应活性增大;Zhai 等[15]发现碳转化率随温度和蒸汽分压的增加而升高,且H2和CO含量增大;徐卫等[16]表明随温度升高,相同时间内碳转化率增加,且在1173 K、水蒸气流量为0.32 g/min时,产物中H2达62.53%。该气化反应涉及燃气和合成气生产过程中的重要气体组分(H2,CO),对其实时生成特性进行在线监测有助于反应调控和过程强化。
表2统计了关于半焦-水蒸气气化反应动力学的典型研究,并从反应器结构、操作条件和产物分析等方面进行比较。该研究的常用分析仪/反应器包括:热重分析仪(TGA)、自制固定床分析仪、流化床、沉降炉等[14-21],且动力学计算多基于碳转化率,未能反映气体产物的生成信息。受测量原理和反应器结构的限制,固定床和TGA具有明显局限性,包括:(1)升温速率低(<100 K/min),难以揭示流化床和气流床等高升温速率类装置中的燃料反应特性;(2)等温气化测试需要气氛切换,存在气化剂从0到指定分压下的浓度不稳定区,影响该区域内的数据准确性;(3)难以定温添加样品,半焦样品在二次加热过程物化性质可能改变;(4)存在气化剂向半焦内部的扩散和气体产物向气相主体的扩散[22-23]。沉降炉用于半焦气化具有颗粒停留时间短、碳转化率不高等局限性。而常规流化床反应器仍存在着因物料流化、循环而造成的气体夹带和因气泡生成、合并、破裂而导致的扩散和返混,不适合反应分析。
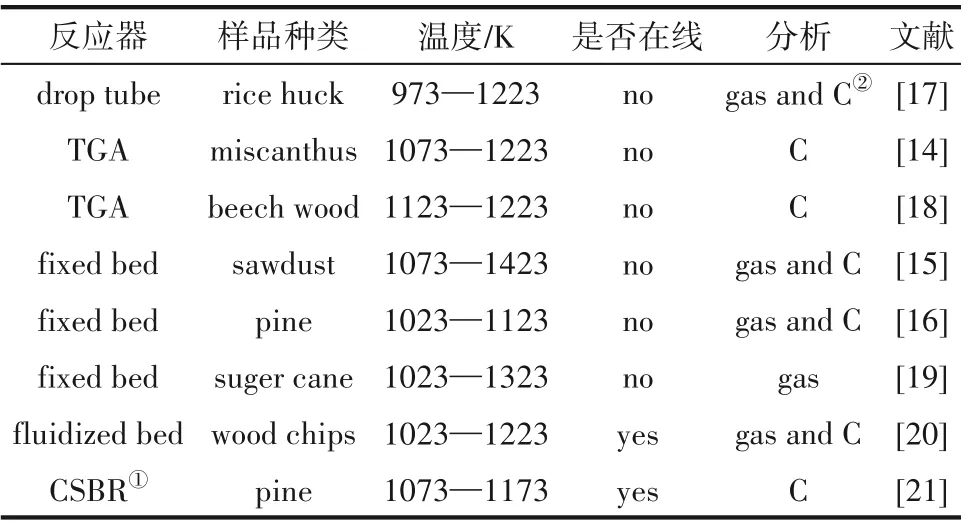
表2 典型半焦-水蒸气气化研究分析Table 2 Analysis of typical researches on char-steam gasification
为表征复杂反应过程中气体产物的实时生成特性并进行动力学求算,研发团队开发了微型流化床反应分析仪(micro fluidized bed reaction analyzer,MFBRA)。与TGA 测量原理不同,MFBRA 通过气体产物浓度-时间变化关系来研究反应性能的改变,具体如下:(1)采用内径为10~20 mm 的反应器,确保气相产物近平推流流动,避免气体产物在反应器中的返混。(2)利用高温流化颗粒强化传热,实现高升温速率,确保反应的等温微分特性。且由于实验样品在流化介质中具有很好的分散性,避免了样品静置于样品池(比如热重坩埚)中存在的反应气体扩散和生成气体释放过程中的扩散,也消除了因样品加热时间过长导致的起始反应段数据偏离实际工况。(3)通过电子脉冲将测试样品快速喷射到反应器中,实现定温条件下瞬时加料。(4)气相产物由快速过程质谱实时监测,并联合色谱定量分析。目前,该分析方法已应用于化工、冶金、材料、能源等领域的反应测试和表征中[24-26]。
基于此,本研究利用MFBRA 研究松木半焦与水蒸气的等温气化反应,考察温度(T,1123~1223 K)和水蒸气分压(SP,10%~40%)对气化行为、气体产物生成特性和总碳转化率的影响,分析气体组分的生成途径,利用缩核模型进行实验数据解析,求取气体产物和总碳转化的活化能,并与文献数据对比,为气化机理的深入研究及工艺开发提供指导。
1 实验材料和方法
1.1 原料及半焦制备
实验用半焦由松木颗粒热解而成,制备程序如下:(1)选用尺寸为0.1~0.5 mm 的原料进行空气干燥(378 K, 24 h);(2)利用高温管式炉对原料脱除挥发分,气氛为Ar,升温速率为10 K/min,在终温1273 K下停留60 min;(3)半焦在Ar 气氛中冷却,将所制样品密封保存。原料和半焦的工业和元素分析见表3,半焦中固定碳含量达93.45%。

表3 松木颗粒及半焦样品的工业及元素分析Table 3 Proximate and ultimate analysis of raw materials and char
1.2 半焦气化实验
实验流程如图1所示,主要由供气系统、蒸汽生成器、脉冲进样系统、MFB反应器、净化系统、控制和数据采集系统等组成。气体包括Ar、O2和水蒸气。蒸汽发生器(573 K)中的流量由高精度恒流泵(P230Ⅱ)调控。Ar和O2的流量通过质量流量计调控。样品加料系统由电磁脉冲阀调控,响应时间小于0.2 s。反应器内径为20 mm,分为气体进样区、气体预热段(200 mm)、主反应区(30 mm)和气体释放区。下、中、上分布板分别用于支撑热载体颗粒、支撑流化颗粒和保障气体均匀分布、防止颗粒和样品逃逸。为避免载气和水蒸气对温度影响,反应器下部填充惰性小球。流化颗粒(高纯石英砂)的粒径为109~120 μm。
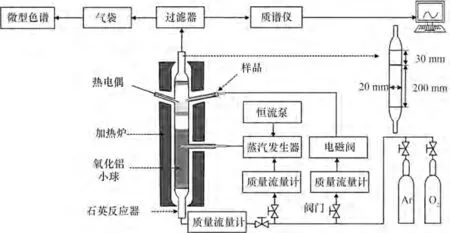
图1 实验装置原理图Fig.1 Schematic diagram of experimental facilities
气化实验前,通过改变原料粒径以及操作气速尽可能消除内外扩散对反应行为的影响。测试表明:当选用反应器内径为20 mm、原料粒径为0.1~0.2 mm、气体流速为400 ml/min时,样品颗粒返混和扩散对半焦气化反应行为的影响很小,仪器测定数据更接近于真实工况,更能揭示气化反应的本征特性。因此,本研究采用的原料粒径为0.1~0.2 mm、流化气速为400 ml/min。具体操作如下:(1)将装填石英砂颗粒(静态床高约20 mm)的反应器置于微型加热炉内,通入一定量Ar使石英砂稳定流化;(2)采用30 K/min的升温速率将反应器加热到设定温度;(3)打开蒸汽发生器,将经Ar携带的水蒸气通入气体预热段;(4)调节气体流量,形成设定水蒸气分压的反应气氛;(5)待温度、气氛、颗粒流化和质谱运行稳定后,将约10 mg 半焦样品通过加料系统喷射到高温流化颗粒中,启动气化反应,利用过程质谱(MS, Ametek Dycorsystem 2000)实时监测气体组分;(6)待气体信号与基线持平并平稳后,停止实验。全部气体产物用气袋收集,并利用气相色谱(GC,Agilent Micro 3000A)分析。为保证数据可靠,实验后更新石英砂,并用氧气焙烧反应器。
1.3 数据处理
MFBRA 中气体组分的质量根据质谱检测的气体组分信号强度实时变化和色谱检测到气体平均组成进行计算。
1.3.1 气体质量计算 图2 展示了1223 K、SP 为20%时气化过程中质谱检测的气体组分信号强度随时间的演变。气体产物以H2、CO 和CO2为主,其他组分(如CH4,C2H4等)含量很少,均在0.01%左右,可忽略。现以CO 为例说明质谱检测信号的处理方法,进而求算所有气体的质量变化。
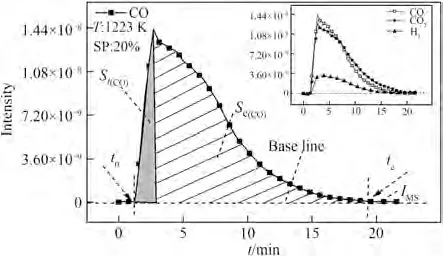
图2 半焦-水蒸气反应过程质谱检测数据Fig.2 Analysis method of char-steam gasification reaction
图中,t0为起始反应时间,即样品通过加料系统喷射到反应器中的时间,min;te为反应结束时间,可通过质谱检测气体组分的强度变化曲线与基线共同确定,min;IMS为质谱检测气体组分的信号强度;Si和Se分别为从t0到ti和从t0到te过程中质谱信号强度曲线与基线间的面积积分,见式(1)和式(2)。

反应过程中,生成气体的总体积可通过反应时间内通入Ar 总体积与生成气体中Ar 体积含量确定,视Ar 为示踪气体;从t0到ti和从t0到te过程中CO的体积由式(3)和式(4)计算。

气体产物(j)的生成率(Xj)定义为该气体的质量与半焦质量(g,daf)之比;总碳转化率(XC)定义为生成气体(CO, CO2)中碳的质量与半焦质量(g, daf)之比,分别见式(10)和式(11)。


当蒸汽分压变化时,忽略气体产物浓度的影响,反应速率k0主要与水蒸气分压和气化温度有关,采用n级反应表达式考察水蒸气分压对气化速率的影响,k可表示为:

对式(19)两边取对数得到式(20),利用lnpH2O对lnk作图,则通过直线的斜率即可求出水蒸气分压的反应级数n。
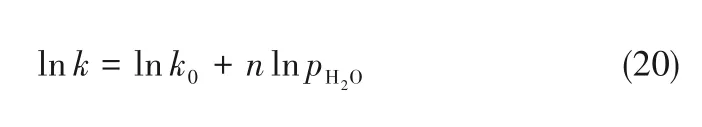
2 实验结果与讨论
2.1 不同温度和蒸汽分压下半焦气化反应特性
图3 考察了不同蒸汽分压(SP, 10%、20%、30%,40%)和温度(T,1123、1173、1223 K)下H2生成率的变化。在相同SP下,随T升高,完成气化反应所需时间减少,且H2生成率增加。以SP 为10%[图3(a)]为例,随T升高,反应时间依次为58.02、38.15和28.39 min;对应H2生成率为0.21、0.41和0.49。高温下,水蒸气分解率增加,中间络合物C(H)和C(OH)生成增多,且扩散加快,导致反应加快和H2生成率增加。

图3 不同温度和水蒸气分压下H2生成率变化Fig.3 Variation of H2 generation yield with reaction time at different T and SP
当T一定时,随SP增加,气化所需的反应时间大幅减少,H2生成率增加。以1123 K 为例,SP为10%、20%、30%和40%时,反应时间分别为57.37、45.63、38.63和30.43 min,对应H2生成率为0.21、0.23、0.38和0.41。随SP增大,气化剂浓度提高,更多水分子在碳表面分解,生成大量C(H)和C(OH)中间络合物,促进基元反应(R-1.2)、(R-2.2)和(R-2.3)向正反应方向进行,生成更多H2。此外,与低温(1123 K)相比,高温(1223 K)下,当SP大于20%时,虽然反应时间缩短,但最终H2生成率变化很小。表明在高SP下,碳表面活性位已饱和,接受气化剂能力受限,SP对反应的影响降低[30]。
图4 考察了不同SP 和T下CO 生成率的变化趋势。当SP 一定,随T增加,反应时间急剧缩短,生成率增大。例如,当SP 为20%时,随T升高,反应时间依次为46.20、28.68 和17.82 min,对应生成率为0.41、0.46 和0.54。反应过程中CO 主要来自碳氧络合物分解(R-1.3)。宏观上,由于反应(R-1)和(R-2)分别为吸热和放热反应,升高温度不仅促进气化反应(R-1),还抑制反应(R-2)发生,导致CO 生成率升高。对于基元反应,随T升高,水分子分解率增加,扩散速率加快,促进反应(R-1.2)进行,生成大量不稳定C(O),瞬间分解为CO,反应时间缩短,生成率增加。

图4 不同温度和水蒸气分压下CO生成率变化Fig.4 Variation of CO generation yield at different T and SP
当T一定,随SP 增加,反应时间缩短,生成率逐渐增加,这与H2类似。以1123 K为例,SP增加,反应时间依次为58.02、46.20、39.60和31.07 min,对应CO生成率为0.40、0.42、0.44 和0.46。高SP 下,水蒸气向半焦表面扩散的速率加快,促使反应(R-1.1)、(R-1.2)和(R-1.3)向右进行,在半焦内表面生成大量CO。不同于H2,部分CO 与络合物C(OH)发生水煤气反应而被消耗。CO 生成率随SP 增加而提高,说明此过程中CO的生成量大于参与反应(R-2)的消耗量[31-32]。
图5 考察了不同SP 和T下CO2生成率的变化趋势。随T升高,反应所需时间缩短,CO2生成率不断增加,这与H2和CO类似。不同的是,当SP大于20%时,CO2生成率变化幅度不大。CO2主要来自水煤气变换反应(R-2)。随T升高,一方面反应物CO 量增加,H2O 分子分解速率加快,使得反应(R-2)向生成CO2方向进行;另一方面,由于反应(R-2)是放热反应,T升高抑制反应进行,导致CO2生成率降低。在低SP 下(<20%),CO2生成率增加幅度较大,表明SP是主要影响因素;在高SP下(≥20%),CO2生成率趋于稳定,说明SP促进作用和T抑制作用达到平衡。

图5 不同温度和水蒸气分压下CO2生成率变化Fig.5 Variation of CO2 generation yield at different T and SP
当T一定时,CO2生成率随SP升高而增大,反应时间缩短。高SP下,体系中H2O浓度增加,CO量增多,促使反应(R-2)生成更多CO2。此外,由于反应(R-2)受T升高制约,在1123、1173 和1223 K 下,CO2在SP 为40%与10%的生成量比值(X40%/X10%)分别为1.38、1.16和1.07,说明随T升高,SP对CO2生成量的影响减小。
图6考察了不同T和SP下总碳转化率的影响。与H2、CO和CO2类似,SP一定,随T升高,反应完全所需的时间缩短,总碳转化率增大。这是由于T升高促进吸热反应进行,半焦孔结构更发达,气化反应的碳活性位增多,生成气体量增加,总碳转化率也明显提高[33-34]。

图6 不同温度和水蒸气分压下总C转化率变化Fig.6 Variation of carbon conversion at different T and SP
另一方面,当T一定,气化反应时间随SP 增大而急剧缩短,而总碳转化率大幅上升。以1123 K 为例,当SP 从10% 增大到40%,气化反应时间从58.02 min 缩短至31.07 min,总碳转化率从0.70 升高到0.88。高SP 下,更多水蒸气通过多孔结构进入半焦颗粒内部,缩短了水蒸气向半焦内表面的扩散时间。此外,水蒸气是重要的半焦活化剂,形成发达的多孔结构。与低温不同,高温(1223 K)下,随SP升高,总碳转化率呈现出先迅速增加后趋于平缓的趋势。特别是当SP 为20%、30%和40%时,总碳转化率为0.97、0.98和0.99,半焦反应完全。
为进一步分析T和SP 分压对各气体组分(H2、CO、CO2)生成率和总C 转化率的影响,本研究考察了SP 为40%与10%条件下各气体产物产率的比值(X40%/X10%)和总C 转化率比值随温度的变化情况,如图7 所示。T从1123 K 升到1173 K 时,H2、CO、CO2和总C 对应的比值快速降低,说明在实验T和SP 范围内,两者均对上述气体生成率及总C 转化率有强烈影响。当T从1173 K 升高到1223 K 时,H2生成率比值几乎不变,CO2、CO 和总C 对应的比值轻微减小,说明在此过程中SP对最终生成率影响变弱。

图7 40%与10%蒸汽分压下气体产物生成率比值及总C转化率比值随T的变化Fig.7 Ratio of gaseous product yield and C conversion with T between SP of 40%and 10%
图8 展示了反应结束时各气体组分(H2, CO,CO2)的体积产率及CO/CO2体积比随温度的变化趋势。SP 一定时,随T增加,各气体的体积产率持续升高。对比三组气体组分,H2体积产率增加尤为明显,而CO 和CO2增幅有限。不同T下,各气体组分的体积产率比值(以1123 K 为基准)变化见表4。以SP 为10%为例[图8(a)],T从1123 K 升高至1173 K时,H2、CO、CO2的体积产率分别从0.56、0.54、0.39 L/g增加至1.10、0.58 和0.51 L/g,对应的涨幅分别为1.96、1.07 和1.31;而进一步升温至1223 K 时,气体的体积产率再次增加至1.32、0.70 和0.56 L/g,涨幅依次为1.20、1.21 和1.10。随T升高,T抑制作用加剧,反应(R-2)逆反应程度加深,导致H2和CO2的增长减缓,而反应物CO 因消耗量减小,呈现出加速增长的趋势。同时,SP 一定,CO/CO2体积比呈现出随T升高先增大后减小趋势。以SP 为20% 为例[图8(b)],T从1123 K 升高至1223 K 过程中,对应值分别为1.29、1.20 和1.25。结果表明从1123 K 升温至1173 K时,反应(R-2)受反应物浓度的促进作用要大于T的抑制作用,但从1173 K 升温至1223 K 时,T的抑制作用更为明显。
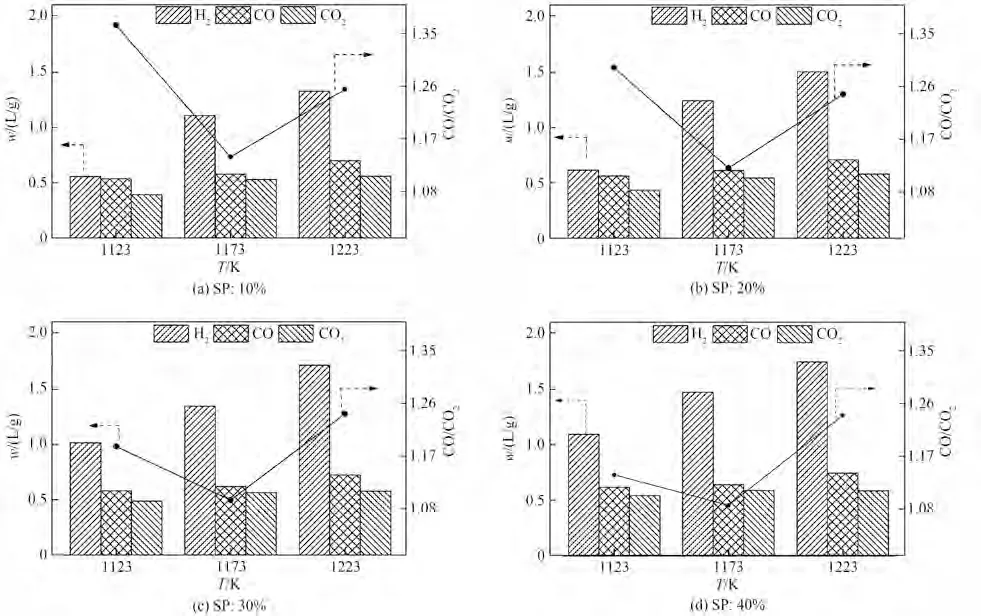
图8 气态产物的体积产率及CO/CO2体积产率比值随温度的变化Fig.8 Variation of volume yield of gaseous products and the ratio of CO/CO2 at different T

表4 不同蒸汽分压下三种气体组分在不同温度下的体积产率比值Table 4 Ratio of volume yield between different T and SP
图9 展示了反应结束时各气体(H2, CO, CO2)的体积产率及CO/CO2体积比随SP 的变化趋势。等温时,各气体的体积产率随SP 升高而增大,且H2增长趋势最为明显。以1123 K 为例[图9(a)],SP 从10%增大到40%时,H2、CO、CO2生成量分别从0.56、0.54、0.39 L/g 升高至1.09、0.62、0.54 L/g,对应增幅为1.97、1.15、1.29;而在1173 K 和1223 K 下,三种气体的增幅分别为1.33、1.11 和1.16 及1.32、1.06 和1.07。低温下(1123 K),三种气体的体积产率受SP影响最明显。随T升高,SP 对体积产率的影响减弱。此外,随SP 升高,CO/CO2的体积比呈减小趋势。在1123 K 下,随SP 升高,CO/CO2体积比由1.36降至1.14;T升高至1173 K 时,比值由1.14 降至1.09。进一步升温至1223 K,随SP 增加,比值稍有减小,维持在1.25 左右。结果表明:低温下(尤其在1173 K时),SP对反应(R-2)影响较为明显。

图9 反应结束时气体产物的体积产率和CO/CO2体积产率比值随SP的变化Fig.9 Variation of volume yield of gaseous product and the ratio of CO/CO2 at different SP
2.2 不同温度和蒸汽分压下半焦气化反应速率
图10 考察了SP 为10%、不同温度下气体组分(H2, CO, CO2)及总C 反应速率分别随气体生成率和碳转化率的变化趋势。无论是对气体产物还是总C,反应启动后,速率曲线几乎在瞬间达到最大值,说明反应器中高升温速率和良好的等温环境;随着气体生成率和碳转化率增加,反应速率逐渐下降。与CO、CO2和总碳不同,H2反应速率达到最大值后存在相对稳定段,尤其是在1173 K 和1223 K。对比发现,在1123 K和1173 K下,CO、CO2和H2的最大生成速率依次为0.013、0.01、0.007 min-1和0.022、0.021、0.018 min-1,顺序为CO>CO2>H2;而在1223 K时,顺序改变为CO>H2>CO2。这是由于SP 为10%时,体系中H2O 分子浓度较低。在低温下(1123~1173 K),H2O 分解率较低,生成C(H)浓度不高,相互结合释放出H2能力较弱,且H2分子不易从活性位点脱附,导致H2生成速率低于CO 和CO2;在高温(1223 K)下,水分子分解率进一步增大,体系中C(H)浓度升高,生成H2能力增强。
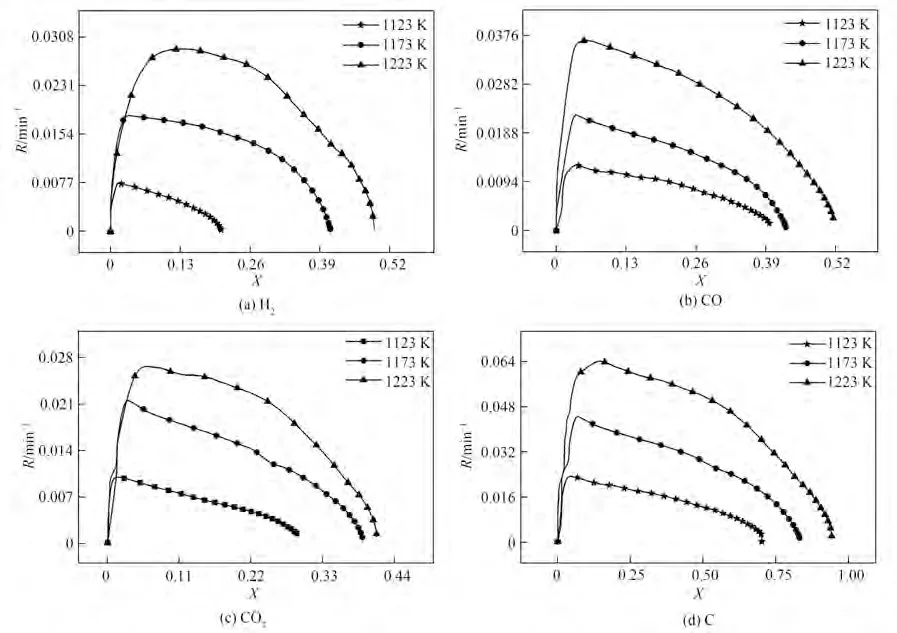
图10 不同温度下H2、CO、CO2及总C的反应速率随转化率的变化(SP-10%)Fig.10 Variation of reaction rate versus yields of H2,CO,CO2 or C conversion at different T and SP of 10%
表5 进一步对比了各SP 和T下气体产物(H2,CO,CO2)和总C 的最大反应速率及对应生成率或转化率。与SP=10%相似,在20%~40%时,气体产物的最大生成速率以及总C最大转化速率也呈现出随T升高而增大的趋势。但与SP=10%不同,当T为1173和1223 K 时,高SP 下最大生成速率依次为H2>CO>CO2。SP 升高会在半焦内部瞬间产生大量H2,因参与反应,碳表面易吸附H2的活性位减少。此外,在高温下(1223 K),随SP 从20%升高至40%,受活性位点数量的制约,气体产物的生成率及总C 转化率变化较小,但由于H2O分子浓度的增加,瞬间产生大量可参与反应的中间络合物,使得气体的最大生成率增大[35]。

表5 不同温度和蒸汽分压下气体产物和总C的最大反应速率及对应的生成率或转化率Table 5 Maximum reaction rate and the corresponding yield and conversion at different T and SP
2.3 半焦水蒸气气化反应动力学
本研究利用体积反应模型(VRM)和缩核模型(SCM)来描述半焦-水蒸气气化反应行为,并进行线性拟合,以SP=10%时总C转化为例,结果如图11所示。在转化率为0~80%范围内,与VRM 模型相比,SCM 模型能更好地拟合实验值。不同温度下两种模型的拟合度也显示,SCM 模型的拟合度平均值在0.998 左右,能更好地描述半焦-水蒸气气化反应行为。因此,本文选择SCM 模型来研究木屑半焦与水蒸气的气化反应行为。
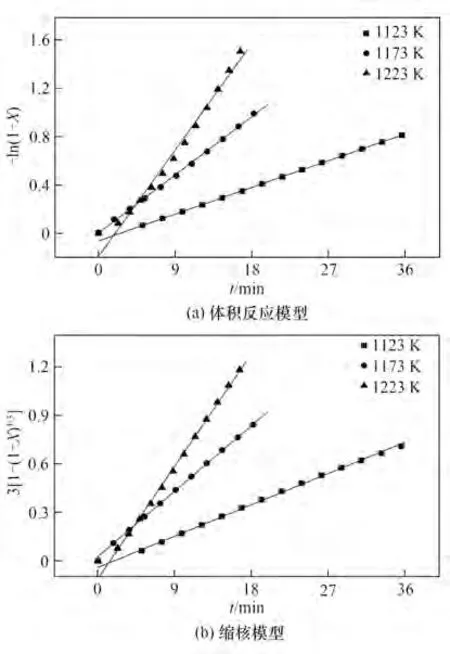
图11 体积反应模型和缩核模型对实验数据的拟合比较Fig.11 Fitting of char steam gasification result by VRM and SCM
基于SCM 模型,利用式(18)对lnkG与1/T作图,并进行线性拟合,实验结果见图12。根据不同实验温度范围内拟合曲线的斜率和截距即可求出反应的活化能和指前因子。

图12 不同蒸汽分压下速率常数与温度倒数的线性拟合Fig.12 Linear fitting of rate constant and 1/T
表6 列出了生成H2、CO 和CO2及总C 转化的活化能随蒸汽分压变化情况,同时求算平均活化能。分析发现10%、20%、30%、40%蒸汽分压下,生成H2、CO2、CO的活化能分别处于95.44~101.82、83.56~89.35 和70.41~74.86 kJ/mol 范围内。半焦-水蒸气气化过程涉及多个化学反应,与CO 和CO2相比,H2生成途径更复杂;且由于生成C(H2)稳定性较强,使得H2不易从活性位脱附到反应体系内,导致H2生成活化能较大[11]。此外,在不同蒸汽分压下,气体产物生成的活化能以及总C 转化活化能波动较小,说明MFBRA对等温气固反应分析的可行性和可靠性。

表6 缩核模型计算所得的气化反应动力学数据Table 6 Kinetic parameters of gasification with the SCM
图13进一步考察了蒸汽分压对反应速率常数的影响,利用lnpH2O对lnk作图并求出不同T下SP的反应级数。不同温度下求算的n值比较接近,在0.274~0.285之间变化,其平均值为0.28,与文献报道近似[36]。不同温度下各曲线的拟合度均大于0.959,表明lnpH2O与lnk具有良好的线性关系。在确定反应级数n后,考虑到SCM 模型能较好描述该气化反应行为,故半焦-水蒸气气化反应速率的表达式如式(21):

图13 气化速率常数与水蒸气分压的关系Fig.13 Relation between reaction rate constant and steam partial pressure

为进一步验证式(21)的准确性,图14 展示了蒸汽分压为40%时总碳反应速率的实验值与式(21)计算值的对比。研究发现当碳转化率处于0.15~0.8之间时,公式计算值与实验值较为接近,其相对误差都小于0.05,表明式(21)能准确描述木屑半焦-水蒸气气化反应速率。

图14 蒸汽分压为40%时总碳反应速率实验值与理论值的比较Fig.14 Comparison of experimental value and theoretical value of total carbon reaction rate at SP=40%
表7 进一步总结了文献中相同生物质半焦(原料、制备方法)及气化条件下,利用固定床、管式炉及沉降炉进行半焦-水蒸气气化所得的动力学数据。统计显示,木屑半焦与水蒸气气化时,基于半焦碳转化率的反应活化能介于68.0~113.9 kJ/mol,本实验所得数据为71.29~78.78 kJ/mol,进一步验证MFBRA求取动力学数据的可靠性。

表7 与文献中所得的水蒸气气化碳转化活化能对比Table 7 Comparison of the activation energy of carbon conversion from steam gasification obtained in literatures
3 结 论
本研究利用微型流化床反应分析仪考察了半焦-水蒸气气化过程中主要气体产物(CO、H2、CO2)及总碳的反应特性并进行动力学计算,得到如下结论。
(1) 随SP 的升高,三种气体的生成率以及总碳转化率增大,但随T的涨幅不同,在1123 K,SP 从10%增大至40%的过程中,H2、CO、CO2以及总碳的转化率增幅分别为1.97、1.15、1.29 和1.25 倍,而在1173 K 和1223 K 下,其对应值分别为1.33、1.11、1.16 和1.13 倍以及1.32、1.06、1.07 和1.06 倍。随T升高,SP 对气化反应的影响减小;特别地,在1223 K下,当SP≥20%时,受到活性位点的制约,SP 对反应的影响甚微。
(2)随T升高,CO/CO2呈现出先减小后增加的趋势;在1123和1173 K下,随SP升高,CO/CO2降低,而在1223 K下,维持在1.25左右。
(3)在低温、低分压(1123 K,10%)下,三种气体的生成速率大小顺序为CO>CO2>H2;随着T和SP 的升高,气体的最大生成速率以及总C 最大转化速率增大,三种气体对应最大生成速率顺序为H2>CO>CO2。
(4) 利用缩核模型计算得到不同SP 下生成H2、CO2、CO 的活化能分别处于95.44~101.82、83.56~89.35 和70.41~74.86 kJ/mol 之间,大小顺序为H2>CO2>CO。与文献数据对比,MFBRA 能很好地测定复杂气化过程中气体产物的生成特性并求算生成动力学。

