术前AFR 水平与同时性结直肠癌肝转移患者临床病理特征关系及预后分析
程晋坤,沈杰,邓科,李琪,崔巍
结直肠癌发病率居世界常见恶性肿瘤第三位,也是全球第二大癌症死亡原因[1]。近年来我国结直肠癌的发病率和死亡率都有显著的上升趋势,居恶性肿瘤发病率和死亡率的前五位[2]。15%~25%的结直肠癌患者往往在确诊时就合并肝转移(CRLM),即同时性肝转移[3]。原发灶及孤立性肝转移灶手术切除被认为是此类患者的首选治疗方法,联合采用包括全身化疗和手术在内的综合治疗,可使此类患者5 年生存率达40%左右[4]。研究显示血浆白蛋白和纤维蛋白原均可对肿瘤预后有较好的预测价值[5-6]。而血浆白蛋白与纤维蛋白原比值(AFR)是基于白蛋白和纤维蛋白原的组合,可能对CRLM 术后患者的预后有潜在价值。目前临床上关于AFR 水平对于CRLM 患者预后的研究相对较少。本研究旨在探讨同时性结直肠癌肝转移患者术前AFR水平与其临床病理特征的关系及影响预后的因素,现报道如下。
1 资料与方法
1.1 一般资料 选取2015 年6 月至2020 年6 月宁波市医疗中心李惠利医院收治的同时性结直肠癌肝转移患者92例。纳入标准:(1)术后病理证实为原发性结直肠癌;(2)术前未接受过任何辅助治疗;(3)行原发灶根治性手术切除伴或不伴同期或分期肝转移灶局部治疗;(4)经超声、CT、MRI 和(或)病理检查证实伴同时性肝转移。排除标准:(1)多原发或非原发结直肠癌;(2)术前行新辅助放化疗;(3)合并其他器官恶性肿瘤史;(4)异时性肝转移;(5)本身存在血液系统疾病或近期服用影响凝血系统功能药物的患者。其中男56 例,女36 例;年龄36~82 岁;行原发灶切除+化疗62 例,行原发灶切除+同期或分期肝转移灶局部治疗(手术切除或射频消融)+化疗30 例。
1.2 方法 收集术前1 周内血浆白蛋白和纤维蛋白原指标,并计算AFR。AFR=血浆白蛋白/纤维蛋白原。AFR 临界值由X-tile 软件计算,其临界值为10.41。以AFR=10.41 为截点,将患者分为低AFR 组(67 例)和高AFR 组(25 例)。
1.3 观察指标(1)临床特征:性别、年龄、原发灶大小、原发灶部位、肿瘤浸润深度、淋巴结转移状态、肿瘤分化程度、有无神经脉管侵犯、肝转移灶数目、肝转移灶最大径、有无肝外转移;(2)生存情况:随访例数、随访时间、总生存期(OS)。(3)影响预后的危险因素:性别、年龄、术前癌胚抗原(CEA)、糖蛋白(CA)199、AFR、原发灶大小、原发灶部位、肿瘤浸润深度、淋巴结转移状态、有无神经脉管侵犯、肝转移灶情况及治疗方式。
1.4 统计方法 采用SPSS 23.0 统计软件进行分析。计量资料以M(P25,P75)表示,采用秩和检验;计数资料采用2检验或Fisher 确切概率法。以Kaplan-Meier 法及log-rank 检验行影响患者OS的单因素分析和生存率比较。以Cox 比例风险回归模型行影响患者OS 的多因素分析。P<0.05 为差异有统计学意义。
2 结果
2.1 术前AFR 水平与患者临床病理特征的关系 高AFR组和低AFR组年龄、肿瘤浸润深度、肝转移灶数目及有无肝外转移差异均有统计学意义(均P<0.05)。见表1。
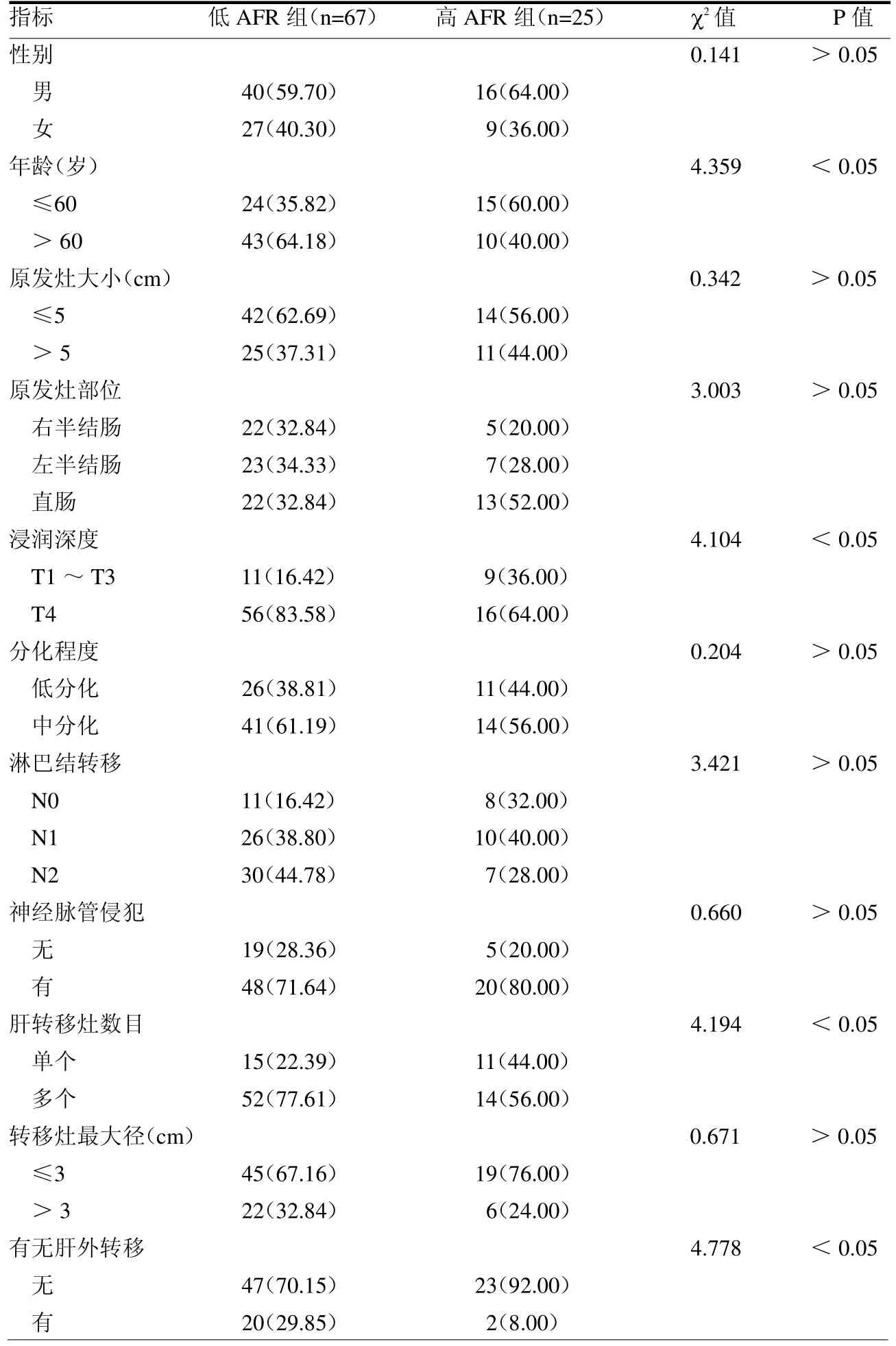
表1 临床病理特征比较 例(%)
2.2 生存情况比较 所有患者均获得随访,随访时间为20(12,31)个月。低AFR 组和高AFR 组患者术后1、2 及3年累计生存率分别为96.6%、26.5%、0%和100.0%、48.7%、20.8%,OS 分别为18(15,25)、24(18,30)个月,差异有统计学意义(均P<0.05),见图1。
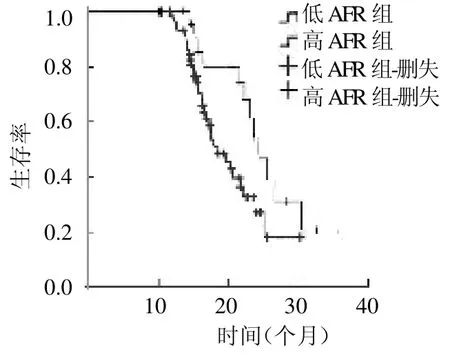
图1 低AFR 组和高AFR 组同时性结直肠癌肝转移患者生存曲线
2.3 危险因素分析 单因素分析显示淋巴结转移、肝转移灶数目、术前CA199水平、术前AFR水平及治疗方式是影响患者预后的危险因素(均P<0.05)。多因素分析结果显示肝转移灶数目、术前AFR 水平及治疗方式是影响患者预后的独立危险因素(均P<0.05)。见表2~3。
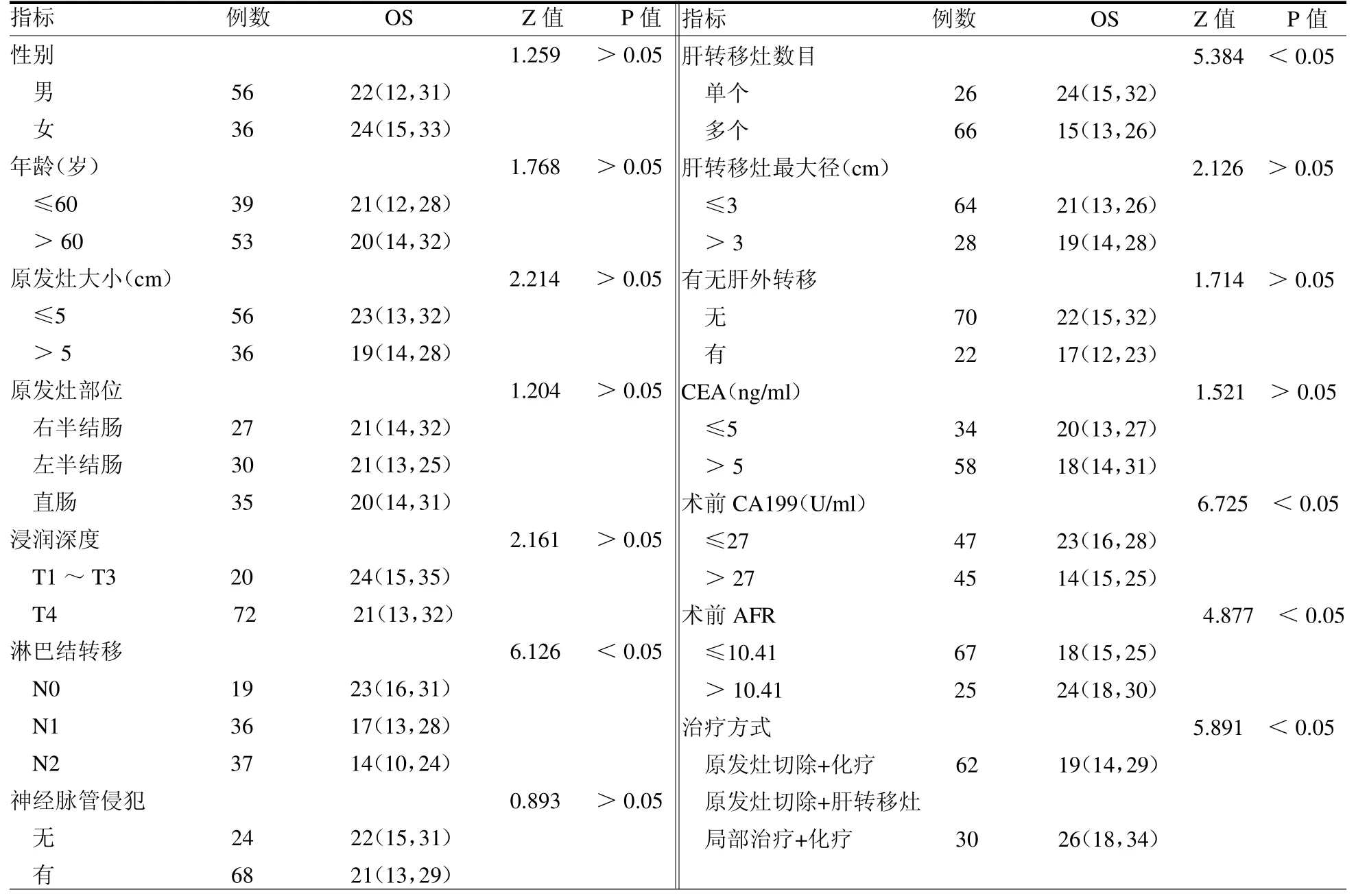
表2 影响同时性结直肠癌肝转移患者OS 的单因素分析 个月
3 讨论
结直肠癌是世界上最常见的消化系统恶性肿瘤之一,肝脏为结直肠癌转移最常见的靶器官,15%~25%的结直肠癌患者在确诊时往往合并肝转移[7],且大多数患者死于CRLM。肝切除术被认为是改善CRLM 患者预后的重要治疗手段,目前手术指征仅要求肝转移灶可达到R0 切除,且能够保留足够的肝脏功能。据报道,孤立性肝转移灶手术切除后的5 年生存率可高达71% [8]。研究显示,行原发灶切除合并肝转移灶局部治疗,包括同期或分期肝转移灶手术切除或行射频消融的患者,较单纯行原发灶切除的患者术后生存时间明显延长,且为影响患者术后生存的独立危险因素。因此对于具备可切除指征的肝转移瘤,原发灶合并转移瘤切除是改善患者术后预后的最佳选择。由于结直肠癌的发病较隐匿,早期诊断率低,大多数患者在确诊时已经处于晚期。因此,需要能够预测早期结直肠癌病变的有效肿瘤标志物,可以对肿瘤病变进行早期干预,较早识别合并复发转移的高危患者。
恶性肿瘤患者体内的凝血-纤溶系统平衡状态往往被打破,多使机体处于高凝状态,而这种高凝状态可能在肿瘤的生长、侵袭和转移过程中起重要作用[9]。因此纤维蛋白原除了是凝血系统的重要组成部分也是肿瘤进展的重要参与者,被认为是反映全身炎症的重要标志物,在肿瘤的增殖、转移和黏附中发挥重要作用[10]。一项Meta 分析结果显示,治疗前血浆纤维蛋白原水平升高与多种消化道肿瘤患者的预后不良显著相关,因此可作为判断消化系统肿瘤预后的有效指标[11]。有研究显示,血浆纤维蛋白原与结直肠癌的发生发展也具备一定的相关性,术前纤维蛋白原水平是非转移性结直肠癌患者预后不良的独立影响因素[12]。
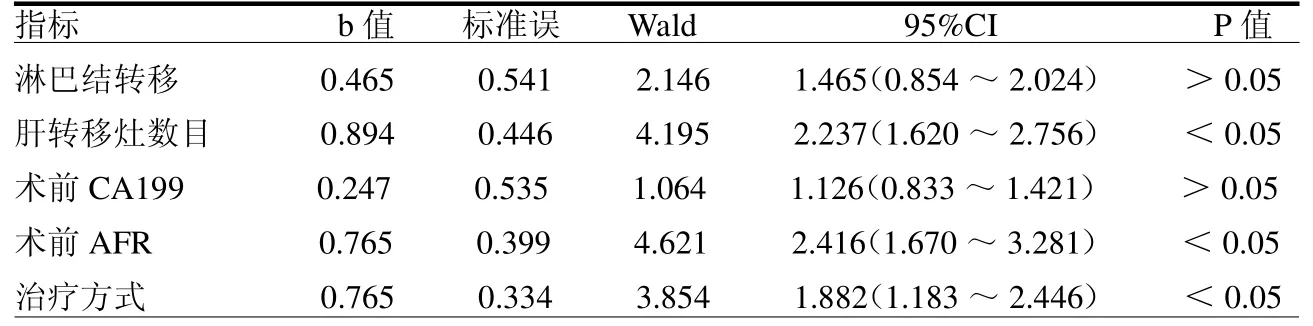
表3 影响同时性结直肠癌肝转移患者OS 的多因素分析
白蛋白是人体血浆中含量最高的蛋白质,是评估全身营养状况的常见指标和参与全身炎症反应的重要因素[13]。恶性肿瘤尤其是高龄的患者往往伴有血浆白蛋白水平的降低,引起免疫功能低下,进一步增加机体感染风险并促进肿瘤细胞的增殖。有研究显示,恶性肿瘤患者治疗前血浆白蛋白水平对其预后有重要意义,因此认为白蛋白水平可用于临床上更好进行癌症患者的风险评估[6]。本院对术前3 个月内体质量下降10%以上或血清白蛋白<35 g/L 的患者,推荐行术前肠内和(或)肠外营养支持,以改善患者的免疫功能,提高对手术的耐受性,以减少术后并发症的发生。
AFR 是基于白蛋白和纤维蛋白原的组合,同时结合了患者的凝血和营养两方面因素,提高评估炎症状态的敏感性,可能对肿瘤患者的预后有潜在价值。Wang 等[14]研究显示血浆纤维蛋白原/白蛋白比值(FAR)可以在某种程度上反映CRLM 患者的肿瘤进展和转移,高FAR患者的生存率显著低于FAR 较低的患者,且术前FAR水平是接受肝切除术后患者预后的独立预测因子。研究显示,FAR是影响肝癌根治性切除术后患者预后的有效因素,其比值升高与肝癌患者较低的存活率和较高的复发风险显著相关[15]。同时,AFR 在卵巢癌、非小细胞肺癌等恶性肿瘤的早期诊断和预后中的价值也得到验证,其降低常常会导致患者预后不佳[16-17]。本研究通过分析发现术前AFR 水平与患者年龄、肿瘤浸润深度、肝转移灶数目及有无肝外转移显著相关。在生存方面,低AFR 患者较高AFR 患者术后生存期短、预后更差,且多因素分析显示术前AFR 水平为患者预后的独立危险因素。
综上所述,肝转移灶数目及治疗方式影响同时性结直肠癌肝转移患者的预后,术前AFR水平对肝转移患者的预后具有较好的预测价值,以手术为主的综合治疗对改善患者预后具有重要意义。

