电针缓解完全弗氏佐剂诱导的炎性痛及对前扣带皮层脑区HMGB1/TLR4信号通路的调控作用
杨 阳,田丹丹,樊晓慧
(西北妇女儿童医院中医科,陕西 西安 710061)
疼痛已成为危害人类健康的重大疾病之一,其发病普遍,严重影响人类身心健康。炎性痛是持续的伤害性超敏反应,包括由炎症细胞因子、组织损伤和神经损伤引起的损伤部位和邻近组织的疼痛和痛觉过敏[1]。目前,常规镇痛药是治疗炎性疼痛的主要药物,并取得了一定的疗效,但是严重不良反应的发生限制了疗效。因此,有必要找到更有效和更新的对抗炎症性疼痛的策略。
炎性痛发病机制复杂,主要与外周系统、中枢神经系统、免疫系统的调节有关。高迁移率蛋白(High mobility group box-1,HMGB1)是一种典型的损伤相关因子,近年来,HMGB1参与了多种中枢神经系统疾病[2]。有关文献表明,通过抗HMGB1单克隆抗体抑制HMGB1已被证明对癫痫、创伤性脑损伤、中风、帕金森病和阿尔茨海默病治疗有效[3]。研究表明,在CFA引起的炎症性疼痛期间,TLR4表达增加,在这一过程中,外周炎症通过TLR4刺激脑内胶质细胞的激活,导致NF-κB核转录增加,从而驱动促炎细胞因子的产生,如白细胞介素-1β等,有助于疼痛过敏的起始和维持[4]。因此,阻断HMGB1介导的TLR4/NF-κB信号通路的激活可以改善疼痛的超敏反应,这意味着靶向HMGB1通路介导的神经炎症疼痛,可能是一种很有前途的治疗方法。
中枢致敏作用在炎症性疼痛的过程中起着重要的作用,其中最重要的结构之一是前扣带皮层(Anterior cingulate cortex,ACC)。越来越多的研究证实,ACC在疼痛研究中越来越受重视,在人类疼痛相关信息的处理和动物对有害刺激或组织损伤的行为反应中起着关键作用[5]。既往研究也表明,炎症细胞因子可以增加前扣带皮层神经递质的释放,并显著增强兴奋性突触传递反应[6]。
针刺镇痛是否通过抑制HMGB1介导的炎症发挥作用尚未有报道。但有研究已证实,针灸对炎症反应以及炎症细胞因子有一定的调控作用,提示调节相关炎性信号通路可能是针灸镇痛的重要效应机制。本研究通过踝关节注射完全弗氏佐剂(Complete freund’s adjuvant,CFA)成功建立炎性痛模型,以HMGB1/TLR4信号通路为切入点,观察电针干预对急性炎性痛小鼠热刺痛及机械痛阈值、HMGB1/TLR4信号通路在前扣带皮层ACC脑区相关蛋白表达的影响,为进一步研究针刺镇痛的机制提供新的方向。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:SPF级雄性6~8周龄C57BL/6小鼠共领取3批,每批每组8只,体重约为20~25 g,饲养于空军军医大学药理学教研室动物房。动物领取后进行随机化分组喂养,室内温度稳定在20~25 ℃,湿度稳定在50%左右,光照12 h昼夜循环,在开始实验前将小鼠适应性喂养7 d,在实验过程中保持所有动物自由活动。之后进行的行为学检测全部在上午实施。本次实验动物的使用及所有的实验方案都经过空军军医大学伦理委员会批准。
1.1.2 试剂与仪器:全自动电泳仪(广州科昊公司);全自动多功能酶标仪(德国 Thermo 公司);Bio-Rad 680 酶标仪(美国 BioRad 公司);冰冻切片机(德国 Leica 公司);Tanon 4200 发光成系统(上海 Tanon 公司);CFA(美国 Sigma 公司);Glycyrrhizin(上海 Selleckchem 公司);Mouse 抗-β-actin(美国 Sigma 公司);Rat 抗-HMGB1 (美国 Abcam 公司);Rat 抗-IL-1β (美国 Abcam 公司);Rat 抗-TLR4 (美国 CST 公司)。
1.1.3 配制溶液:制备转膜液:天平上称3.03 g Tris及14.4 g甘氨酸放置在器皿中,往其中加去离子水使其溶解,然后定容至800 ml,后加入200 ml甲醇,充分混匀备用。制备丽春红溶液:在天平上称取0.2 g丽春红放置于器皿中,往其中加去离子水使其溶解,然后用量筒定容至90 ml,后倒入约10 ml冰乙酸充分混匀,常温保存备用。制备PBST缓冲液:用器皿制备500 ml PBS缓冲液,然后往其中加入500 μl吐温-20,充分混匀待用。备牛奶封闭液:将100 ml的PBST缓冲液放置于器皿中,放在摇床上左右摆动,缓慢往其中加5 g脱脂奶粉,混匀至没有颗粒感。
1.2 实验方法
1.2.1 建立动物模型及其分组:将C57BL/6小鼠随机分成五组。空白组(Control)、模型组(Model),电针组(Model+EA)、抑制剂组(Model+GLY)、电针加抑制剂组(Model+GLY+EA),每组各8只小鼠。建立炎性痛小鼠模型参考相关文献[7],以75 %酒精消毒左踝关节周围皮肤,后向左踝关节腔内注射10 μl CFA。常规24 h内出现炎症反应,表现为左后肢踝部出现红肿,行动减少,跛行或抬腿不能着地为造模成功。
1.2.2 针刺方法:按照相关动物穴位图谱选取“足三里”穴,用一次性使用无菌针灸针0.18 mm×10 mm进行针刺[8]。针刺完成后,接通电针仪的电源连接在针柄上,电针时间15 min,强度为0.3 mA,以小鼠肌肉轻度抽搐为标准对小鼠进行电针治疗。电针结束后,小鼠恢复30 min后,再进行下一步实验。EA组小鼠连续治疗7 d。
1.2.3 GLY的剂量与用法:GLY溶于2%二甲基亚砜(Dimethyl sulfoxide,DMSO)中制成溶液,从CFA注射1 h后开始连续腹腔注射GLY4 mg/(ml·d),7 d,与EA治疗时间一致。
1.2.4 热敏痛实验:将小鼠放置于红外热爪痛觉测试仪平台的鼠盒内,自由活动1 h后开始实验。将热辐射光源发射中心对准小鼠左后足,自照射开始起计时,记录迅速抬起后肢的时间,即为缩足反射潜伏期(Paw withdrawal latency,PWL)。每只小鼠重复测试5次,间隔时间不少于 5 min。设定照射自动停止时间为20 s,以免造成足底损伤[9]。
1.2.5 机械痛实验:将小鼠放置于Von Frey纤维丝测痛仪工作台的鼠盒内,自由活动1 h后开始测试。参照文献[10],按照其试验方案,测得正常小鼠50%机械痛缩足阈值为0.4 mN(#2.44)filament。调整Von Frey纤维丝的伸出长度,垂直刺激小鼠左后足底中央,以缩足反射或者舔足反应为阳性反应。重复6次,每次刺激持续时间不超过8 s,间隔时间不少于15 s,阳性反应率=阳性反应次数/6×100%。
1.2.6 冰冻病理切片制备:行为学检测结束后,每组随机进行心脏灌注,取出全脑放于装有多聚甲醛的EP管中,4 ℃放置8 h,然后将全脑放置于20%和30%蔗糖水中脱水,最后冰冻切片机切片,收集脑片,4 ℃保存,免疫荧光染色备用。
1.2.7 免疫荧光:将脑片用含0.3% Triton X-100的滤过的PBS液打孔30 min。打孔完成后,将各组脑片加入标记好的24孔板中,加入正常山羊血清封闭液,常温1 h封闭。封闭完成,吸走封闭液,按照相应比例,配制一抗,每孔加入配制好的一抗,放4 ℃冰箱过夜。次日,继续孵二抗。将24孔板从4 ℃冰箱取出,放在摇床上摇40 min至2 h进行复苏。将脑片用滤过的PBS液在打孔板里洗3次×7 min/次。用滤过的PBS为基础液,按照一定比例,避光配制荧光二抗,避光置于室温1 h。将脑片用滤过的PBS液在打孔板里洗3次×7 min/次。进行贴片,将载玻片按不同的实验组做好标记,再将所有脑片按序贴于载玻片上,稍晾干后,50%的甘油封片,4 ℃避光保存。显微镜下观察结果。
1.2.8 Western blot检测:①样品制备:将标本从-80 °C冰箱取出后置于冰上,组织称重,按组织重量(g)与裂解液体积(ml)为1∶9的比例加入裂解液(RIPA 裂解液+1%蛋白酶抑制剂及磷酸酶抑制剂,使得最终浓度为1 mmol/L)。用电动组织匀浆机进行匀浆,匀浆每次进行10 s,间隔10 s再一次重复操作,直至无肉眼可见组织碎片即可。将组织匀浆后放于1.5 ml的EP管中,离心机(12000 r/min,4 ℃)离心20 min后,吸取上清液。蛋白定量:准备好BCA工作液(A液∶B液=50∶1)于室温备用,用超纯水将标准品稀释为7个梯度,加入96孔板,做复孔。再用超纯水将上清按原液、1∶5、1∶10、1∶20、1∶50的梯度稀释,加入96孔板,做复孔,混匀后于37 ℃孵育30 min。开启酶标仪,读取OD值。②按操作流程进行电泳、转膜和封闭、染色、一抗和二抗。③使用多功能分子成像仪进行显影读条带。
1.3 统计学方法 将实验所得的实验数据录入Graph Pad Prism 7.03和SPSS 20.0统计学软件进行分析。组间比较采用单因素方差分析,实验结果用均数±标准差形式表示,以P<0.05为差异具有统计学意义。
2 结 果
2.1 各组小鼠痛敏比较 机械痛实验结果显示(图1A),与正常组相比,模型组小鼠的阳性反应率显著增加(P<0.001)。与模型组相比,电针组小鼠的阳性反应率减少(P<0.01)。在热敏痛实验中(图1B),模型组小鼠缩足反射潜伏期明显缩短(P<0.001)。与模型组相比,电针组小鼠缩足反射潜伏期显著增加(P<0.01)。见图1。

A:小鼠在机械痛实验中的阳性反应率; B:小鼠在热敏痛实验中的缩足反射潜伏期。与正常组比较,*P<0.001;与模型组比较,#P<0.01
2.2 各组小鼠ACC脑区HMGB1蛋白表达的比较 在炎性痛的病理过程中,HMGB1介导的炎症反应至关重要[11]。采用免疫荧光技术观察小鼠ACC脑区HMGB1蛋白表达的情况。与正常组相比,模型组小鼠ACC脑区HMGB1蛋白表达升高。与模型组相比,电针组小鼠ACC脑区HMGB1蛋白表达降低。见图2。
2.3 各组小鼠HMGB1/TLR4信号通路相关蛋白表达水平比较 采用蛋白免疫印迹法检测小鼠ACC脑区HMGB1/TLR4信号通路相关蛋白表达情况。Western blot结果显示,与正常组比较,模型组HMGB1、TLR4、IL-1β蛋白表达水平明显升高(P<0.001)。与模型组比较,电针组HMGB1、TLR4、IL-1β蛋白表达水平明显下降(P<0.01,P<0.001)。见图3。
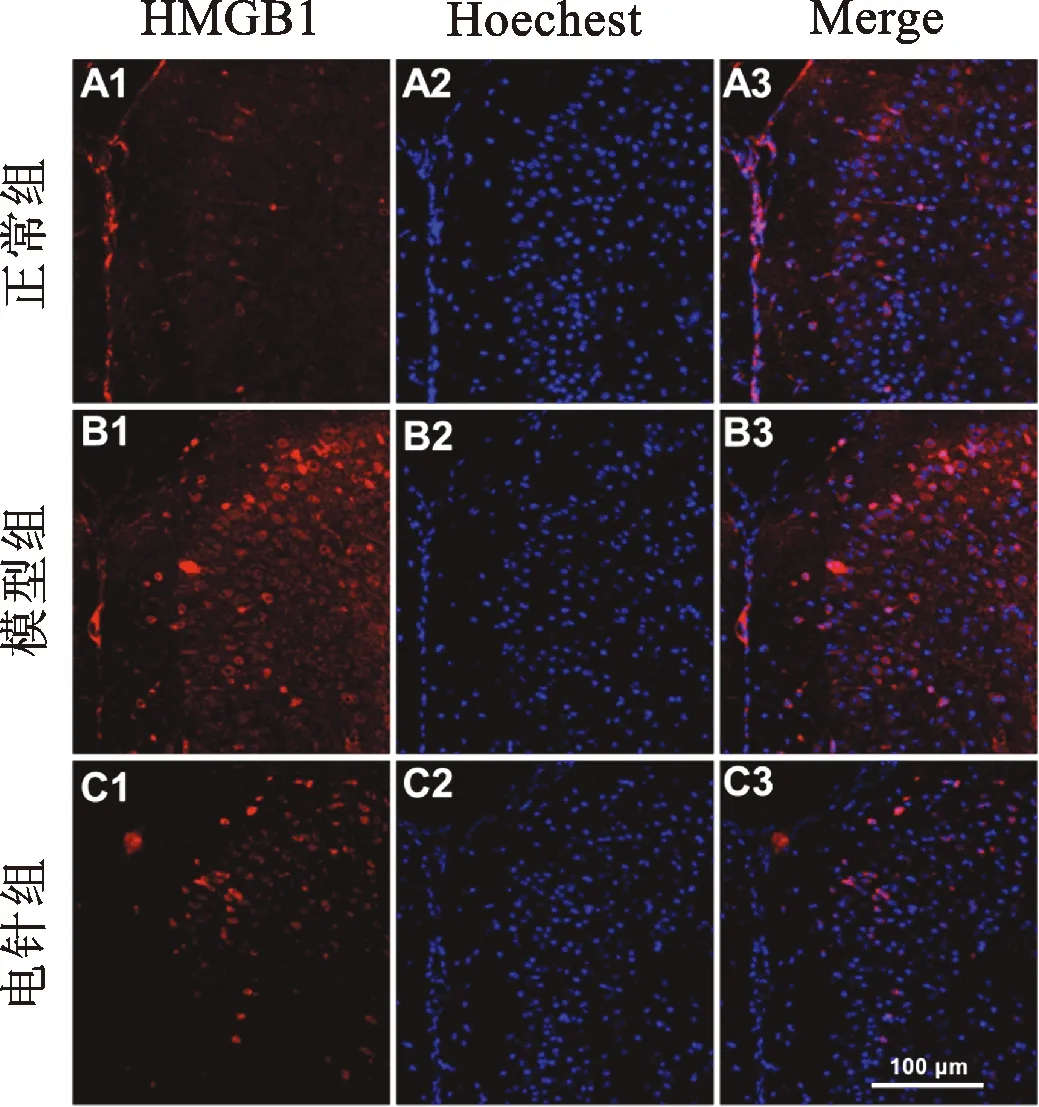
HMGB1:红色,细胞核Hoechest:蓝色,标尺=100 μm
2.4 腹腔注射HMGB1蛋白抑制剂GLY后,各组小鼠痛敏比较 为了验证HMGB1在电针介导的镇痛作用中的重要作用,使用了一种HMGB1的直接性抑制剂GLY,它可以抑制HMGB1的分裂活性。机械痛实验结果显示(图4A),与正常组相比,模型组小鼠的阳性反应率增加(P<0.001)。与模型组相比,电针组、抑制剂组、电针加抑制剂组小鼠的阳性反应率减少(P<0.01,P<0.001)。在热敏痛实验中(图4B),与正常组相比,模型组小鼠缩足反射潜伏期明显缩短(P<0.001)。与模型组相比,电针组、抑制剂组、电针加抑制剂组小鼠缩足反射潜伏期显著增加(P<0.01,P<0.001)。见图4。
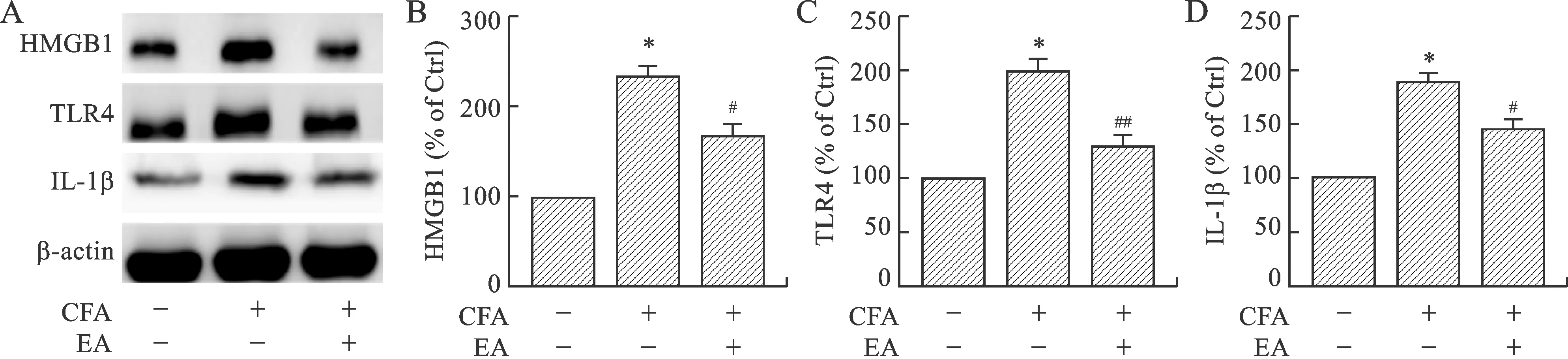
A:HMGB1、TLR4、IL-1β蛋白表达水平,β-actin作为上样对照;B:HMGB1 蛋白表达水平;C: TLR4蛋白表达水平; D: IL-1β蛋白表达水平。与正常组比较,*P<0.001;与模型组比较,#P<0.01,##P<0.001
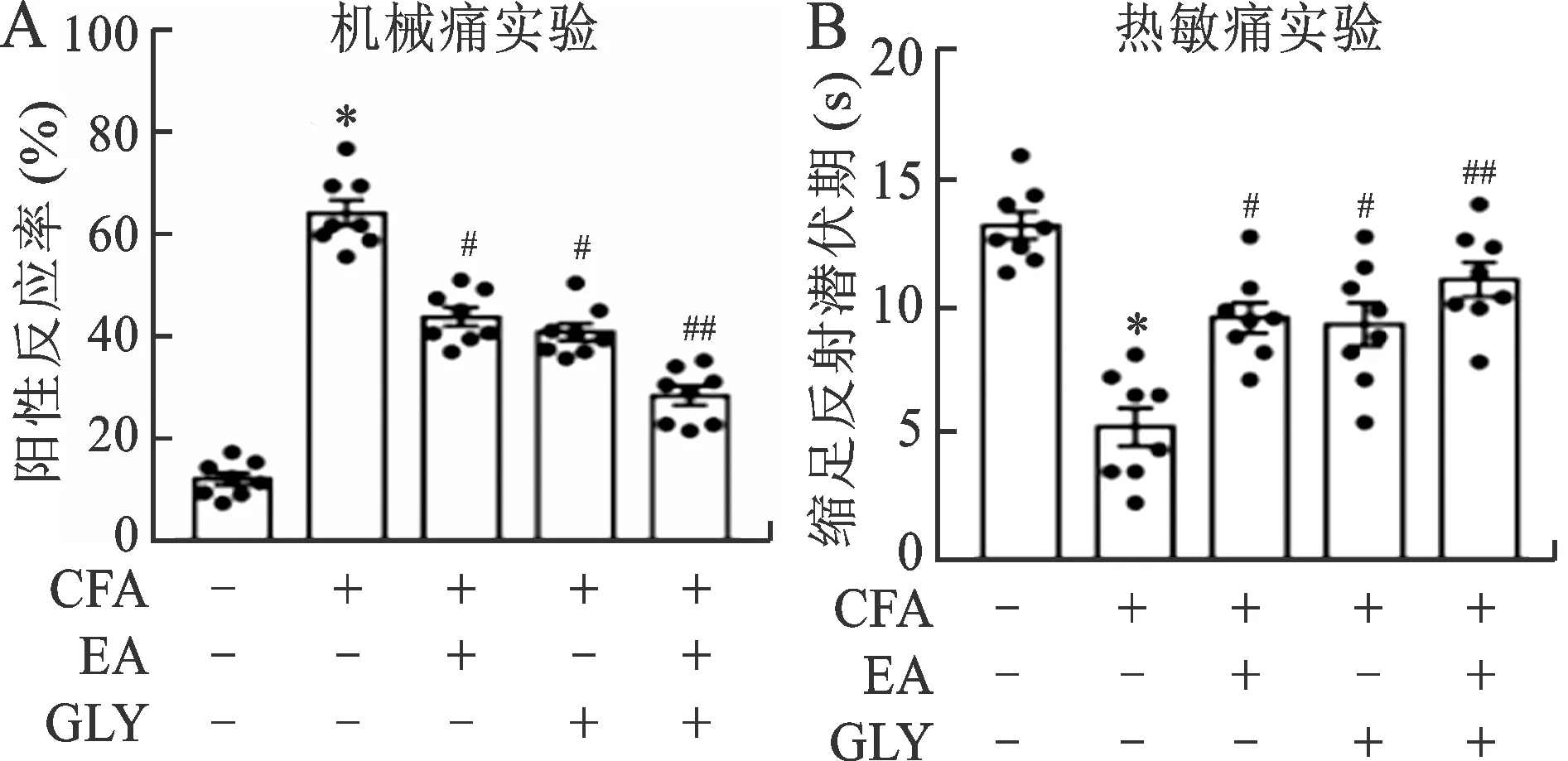
A:各组小鼠在机械痛实验中的PWL; B:各组小鼠在热敏痛实验中的阳性反应率。与正常组比较,*P<0.001;与模型组比较,#P<0.01,##P<0.001
2.5 腹腔注射HMGB1蛋白抑制剂GLY后,各组小鼠HMGB1/TLR4信号通路相关蛋白表达水平比较 为了进一步证明HMGB1及其下游蛋白TLR4、IL-1β是否参与了电针介导的镇痛作用,我们检测了HMGB1/TLR4通路中各蛋白的表达水平。Western blot结果显示,与正常组比较,模型组HMGB1、TLR4、IL-1β蛋白表达水平明显升高(P<0.001)。与模型组比较,电针组HMGB1、TLR4、IL-1β蛋白表达水平明显下降(P<0.01,P<0.001)。与电针组比较,电针加抑制剂组HMGB1、TLR4、IL-1β蛋白表达水平下降更显著(P<0.05,P<0.01,P<0.001)。见图5。
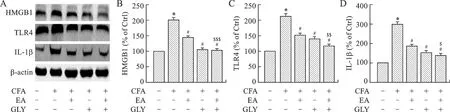
A:HMGB1、TLR4、IL-1β蛋白表达水平,β-actin作为上样对照;B:HMGB1蛋白表达水平;C:TLR4蛋白表达水平;D: IL-1β蛋白表达水平。与正常组比较,*P<0.001;与模型组比较,#P<0.001;与电针组比较,$P<0.05,$$P<0.01,$$$P<0.001
3 讨 论
炎性痛在中医古籍中无明确记载,根据其症状可归于“痹病”范畴,气血逆乱,阴阳失调,气血运化失司,经筋失于濡养,“宗筋主束骨而利关节也”,筋脉痹阻,不通则痛,关节失于荣养,不荣则痛。痹症可使局部气血运行不畅,唯有用疏散之法,行气活血为宜,以远端循经取穴为主,采用强刺激针法,使气至病所,必要时配合局部的阿是穴行浅刺法,采取对应取穴法,包括以左治右,以右治左,以上治下,以下治上等[12]。本研究选用电针“足三里”,探究电针治疗对CFA诱导的炎性痛的作用及其中可能机制。本研究采用机械痛实验和热敏痛实验观察电针镇痛的作用,结果显示,模型组小鼠PWL缩短,说明炎性痛模型成功;相较于模型组,电针组PWL显著增加,说明电针干预可产生明显的镇痛作用。
大量的研究已经证实,CFA诱导的炎症变化发生在脊髓和皮层区域,ACC是一个关键的皮层区域,在疼痛感觉的传递中起着重要作用[13-14]。丘脑、杏仁核和其他与疼痛相关的区域大脑皮层将伤害性感受信息传递到ACC中。有研究表明,减少ACC的活动可以减少疼痛感觉,这表明ACC参与了疼痛的调节。ACC中炎症细胞因子的表达增强是导致疼痛感觉的重要原因[15]。本研究显示,电针治疗后,ACC中IL-1β的表达增加被抑制,这表明电针的镇痛作用与抑制这些炎症细胞因子表达有关。
神经元-神经胶质细胞的相互作用在维持正常的大脑功能中起着重要的作用。然而,它也参与了神经系统疾病的发展,包括各种疼痛性疾病[16-17]。神经胶质细胞是炎症介质的主要来源之一,星形胶质细胞和小胶质细胞的激活促进促炎细胞因子的释放来增强神经元的传递[18-19]。小胶质细胞相当于大脑和脊髓中的巨噬细胞,是中枢神经系统中第一道免疫防线,也是大脑中促炎细胞因子的主要来源,有害刺激可触发小胶质细胞的异常激活,导致炎症细胞因子如IL-1β、IL-6和TNF-α的产生,这些细胞因子诱导炎症攻击、突触神经元损伤[20]。在本研究中,我们观察到注射CFA的小鼠ACC中小胶质细胞激活,而电针的干预降低了ACC中小胶质细胞的激活及HMGB1、TLR4等蛋白的表达。本研究的Western blot和免疫荧光的结果提示,在CFA注射后ACC中HMGB1、TLR4和IL-1β的表达显著增加,而给予电针干预后HMGB1、TLR4和IL-1β的表达显著下降。表明电针发挥镇痛作用是通过抑制HMGB1/TLR4信号通路发挥作用。为了阐明电针抗炎镇痛的潜在机制,我们进一步使用了一种HMGB1的直接性抑制剂GLY[21]。研究结果表明,电针与GLY合用具有协同作用,共同发挥镇痛作用,进一步说明电针发挥镇痛作用是通过抑制HMGB1/TLR4信号通路,降低神经炎症。
综上所述,本研究结果表明电针发挥镇痛作用,有可能是通过抑制HMGB1/TLR4信号通路,降低神经炎症。我们的成果揭示了针刺镇痛可能的分子机制,今后我们将进一步研究针刺镇痛其他可能的分子机制,以及与其他疾病的潜在联系。

