瘦素对猪原代脂肪细胞脂滴相关基因mRNA 表达的影响*
何永江,肖 慧,黄 英,杨明华,赵素梅,潘洪彬,刘 琛,彭泽琴
(1.云南农业大学 动物科学与技术学院,云南省动物营养与饲料重点实验室,云南 昆明 650201;2.迪庆藏族自治州民族中等专业学校,云南 迪庆 674499;3.滇西科技师范学院 生物技术与工程学院,云南 临沧 677000)
脂肪细胞承担机体的能量存储及供给,以甘油三酯(triglyceride,TAG)为主要形式储存能量,TAG 脂解为游离脂肪酸(free fatty acids,FFAs)和甘油向外周细胞供给能量[1];脂肪细胞作为内分泌细胞分泌肿瘤因子和瘦素(leptin,LEP)等脂肪因子[2]。LEP 通过下丘脑途径和外周途径调节脂代谢,抑制外周脂肪合成并调节食欲,从而促进机体质量减小[3]。同时,LEP 在机体质量减小后抑制利于机体质量恢复的代谢、自主神经、神经内分泌和行为适应[4]。
脂滴(lipid droplets,LDs)作为第二细胞器,参与脂质的储存、脂解和内质网应激反应[5]。LDs 在内质网形成,其表面由单层磷脂和各类蛋白质包裹,形成过程中LDs 的转运和TAG 的分配通过诱导脂肪沉积跨膜蛋白(fatstorage-inducing transmembrane protein,FITM)介导,从内质网释放进入细胞质[6]。大多数真核生物中,FITM1主要在肌肉组织表达,FITM2 表达于全身各组织。脂滴包被蛋白1(perilipin 1,PLIN1)在脂肪细胞的脂解和脂质储存调节中起重要作用[7],基础状态下PLIN1 作为LDs 屏障阻止脂肪酶介导的TAG 脂解[8],脂解刺激下PLIN1 磷酸化[8-9],促进脂解过程。脂滴包被蛋白2(perilipin 2,PLIN2)是一类脂滴蛋白,利于抑制胰岛素拮抗和TAG 沉积,促进参与小鼠肝脏脂肪和胆固醇生物合成途径相关的SREBP-1和SREBP-2靶基因表达[10]。成熟脂肪细胞中,基础状态下多数PLIN2 通过泛素—蛋白酶途径降解,极少部分定位在LDs 表面[11]。在嵌合蛋白作用下,定位于LDs 表面的PLIN2 N 端与PLIN1 C 端发生融合,维持LDs 与脂肪酶激活因子α/β 水解酶结构域蛋白5(comparative gene identification-58,CGI-58)的相互作用,抑制基底脂解[12]。研究表明:LEP在皮下前脂肪细胞中可调控脂类代谢相关基因的表达,调节脂肪细胞TAG 水解和游离脂肪酸的氧化[13-15],但目前关于LEP 对细胞脂滴相关基因表达的研究较少。
本研究以猪原代脂肪细胞为材料,通过不同质量浓度LEP 处理猪原代脂肪细胞,以TAG 含量以及PLIN1、PLIN2和FITM2mRNA 表达水平为分析指标,探究LEP 对脂滴相关基因表达的影响。
1 材料与方法
1.1 试验动物及处理
麻醉放血处死3 头15 日龄健康状况良好的三元杂交仔猪(Duroc×Landrace×Yorkshire,DLY),取背部皮下脂肪。试验动物来自云南农业大学实验猪场。
1.2 猪原代脂肪细胞分离培养及诱导分化
参照李永能等[15]对猪皮下脂肪细胞处理的方法并混合所得脂肪细胞,用基础培养基进行猪皮下脂肪细胞分离培养,向诱导分化培养液中添加不同质量浓度LEP(0、50、100 和150 ng/mL)诱导分化猪原代脂肪细胞48 h。在细胞培养第1 和5 天采集细胞图片,并对加入不同质量浓度LEP 诱导分化48 h 后的细胞进行油红O 染色,观察细胞分化结果。
1.3 TAG 含量测定
通过氧化酶法对不同质量浓度LEP 处理的猪原代脂肪细胞进行TAG 测定,操作步骤严格按照甘油三酯试剂盒-TG(酶法)(北京北化康泰临床试剂有限公司,北京)说明书进行。
1.4 总RNA 提取及测定
分别收集0、50、100 和150 ng/mL LEP 处理48 h 后的猪原代脂肪细胞,用总RNA 提取试剂盒(离心柱型)[ 天根生化科技(北京)有限公司,北京 ]提取总RNA,每个处理做3 次平行;采用琼脂糖凝胶电泳检测总RNA 完整性,通过分光光度计NanoDrop 2000(Thermo Scientific,美国)测定总RNA 含量与纯度。
1.5 qPCR 表达分析
根据测定的总RNA 含量,取2 µg 总RNA,用EasyScript First-Strand cDNA Synthesis Super-Mix(全式金生物技术有限公司,北京)进行反转录,反应体系20 μL:总RNA 2 µL,Anchored Oligo(dT)181 µL,2×TS Reaction Mix 10 µL,RNase-free water 补全体系;反应条件为:37 ℃反转录60 min,95 ℃灭酶活5 min,其他操作参照说明书进行。反转录产物于-20 ℃冰箱保存。目的基因FITM2、PLIN1和PLIN2以及内参基因18S rRNA 引物根据GenBank 猪的基因序列,采用Primer Primer 5.0 软件设计,由上海生物工程有限公司合成,引物登录号及引物序列见表1。qPCR 反应体系为20 µL:反转录产物1.5 μL,SYBR®Premix ExTaqTM(宝生物工程有限公司,大连)10 µL,上、下游引物各0.4 µL,ddH2O 补全体系至20 µL。经不同质量浓度LEP 处理所得细胞各做6 次重复,同时用ddH2O 代替反转录产物和SYBR®Premix ExTaqTM中含有的荧光试剂,排除外源基因和基因组DNA 污染。反应程序为:预变性94 ℃ 30 s,94 ℃变性5 s,退火30 s,延伸72 ℃ 10 s,共35 个循环,72 ℃延伸10 min。18S rRNA 基因退火温度为55 ℃;PLIN1、PLIN2和FITM2基因退火温度为60 ℃。

表1 内参基因与目的基因的引物序列、产物长度和登录号Tab.1 Primer sequence,product length and entry number of reference gene and target gene
1.6 数据分析
各处理组基因相对表达水平以内参基因18S rRNA 为参照,计算不同质量浓度LEP 处理下PLIN1、PLIN2和FITM2的相对表达量。TAG 含量和qPCR 数据经初步分析,选择单因素方差分析模型进行计算:
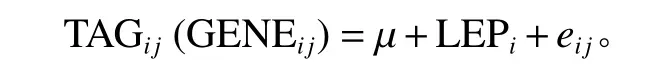
式中:TAGij为第i水平处理时细胞的TAG 含量,GENEij为第i水平处理时基因的表达水平;µ为基因表达水平的总体平均数;LEPi为LEP 处理的第i个效应;eij为试验误差)。
采用SAS 9.2 软件对试验数据进行单因素方差分析和描述统计分析,方差分析结果通过Duncan 法进行多重比较,结果以“平均值±标准差”表示,P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 脂肪细胞形态学观察
诱导分化前,细胞呈成纤维状(图1);猪原代脂肪细胞诱导分化48 h,经油红O 染色,LDs 呈深红色(图2)。说明本试验分离细胞为脂肪细胞。
图1 原代脂肪细胞观察结果 (100×)Fig.1 Observation results of primary adipocytes
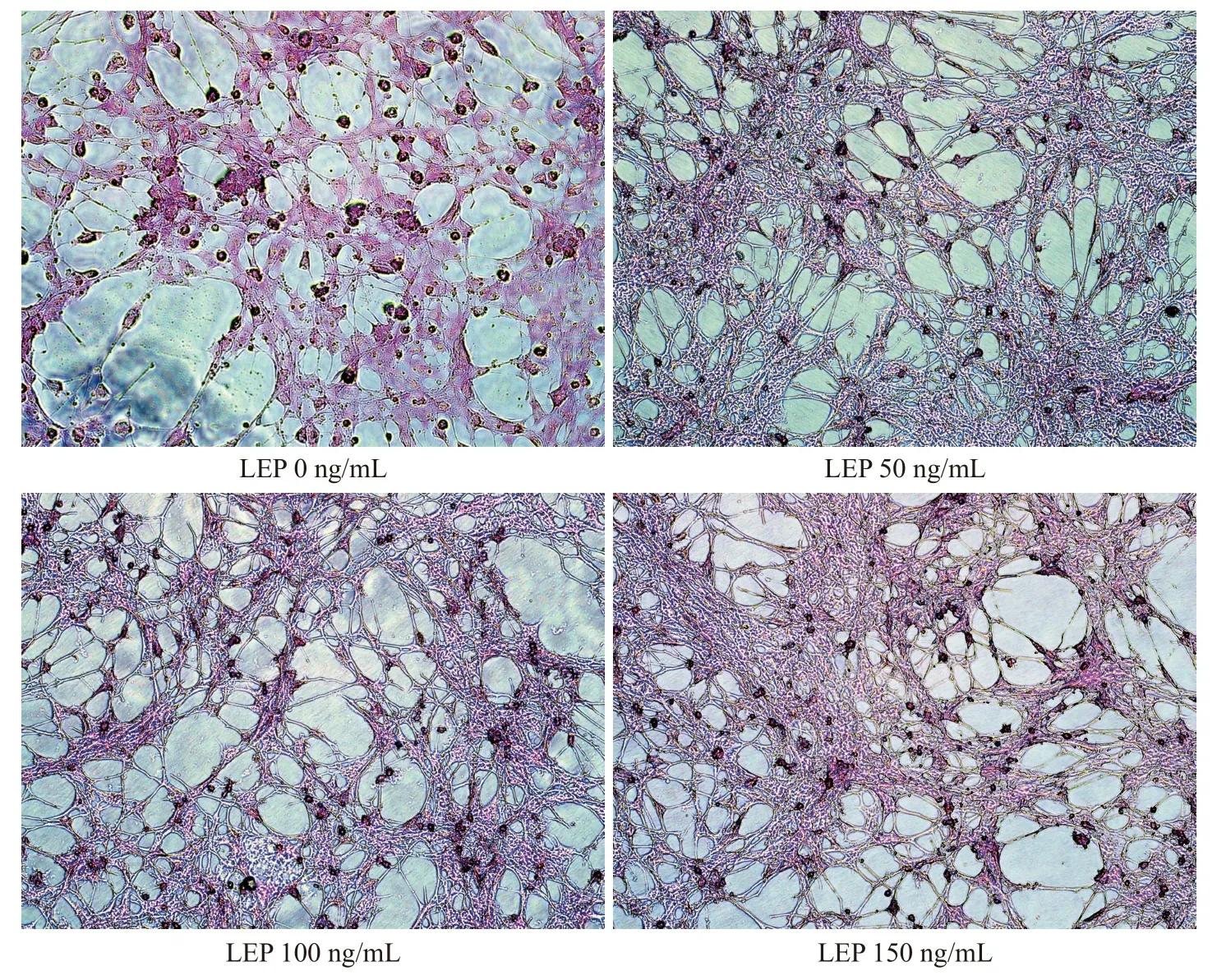
图2 油红O 染色结果 (400×)Fig.2 Results of oil red O staining
2.2 不同质量浓度LEP 对猪原代脂肪细胞TAG含量的影响
由图3 可知:与0 ng/mL LEP 组相比,50和100 ng/mL LEP 可显著增加猪原代脂肪细胞TAG 含量(P<0.05);与50 和100 ng/mL LEP 组相比,150 ng/mL LEP 可显著降低猪原代脂肪细胞TAG 含量(P<0.05)。
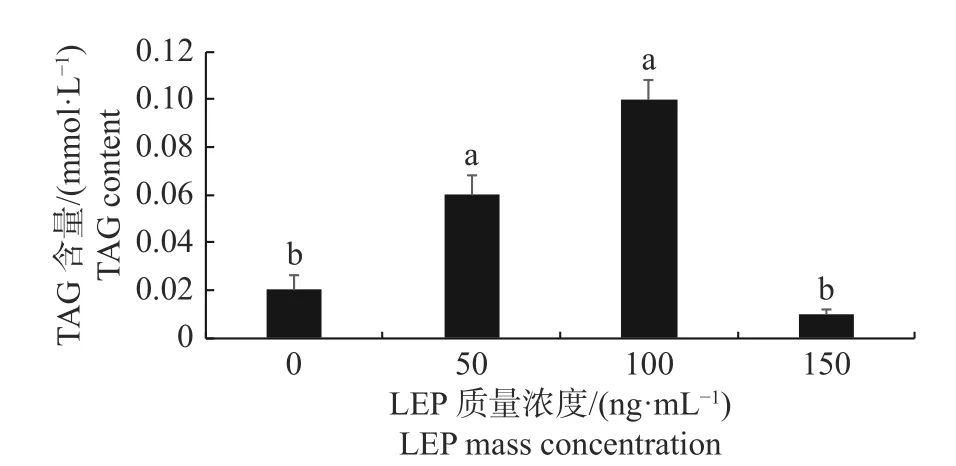
图3 不同质量浓度LEP 下原代脂肪细胞TAG 含量Fig.3 TAG content of primary adipocytes at different LEP mass concentrations
2.3 不同质量浓度LEP 对PLIN1、PLIN2 和FITM2 基因mRNA 表达的影响
由图4 可知:与0 和150 ng/mL LEP 组相比,50 和100 ng/mL LEP 可显著抑制PLIN1基因mRNA 相对表达(P<0.05);与0 和50 ng/mL LEP 组相比,100 和150 ng/mL LEP 可显著促进PLIN2基因mRNA 相对表达(P<0.05),LEP 呈质量浓度依赖性上调PLIN2基因mRNA 表达的趋势;与0 ng/mL LEP 组相比,50 和100 ng/mL LEP可显著促进FITM2基因mRNA表达(P<0.05),同时100 ng/mL 为LEP 促进FITM2基因表达的最佳质量浓度。
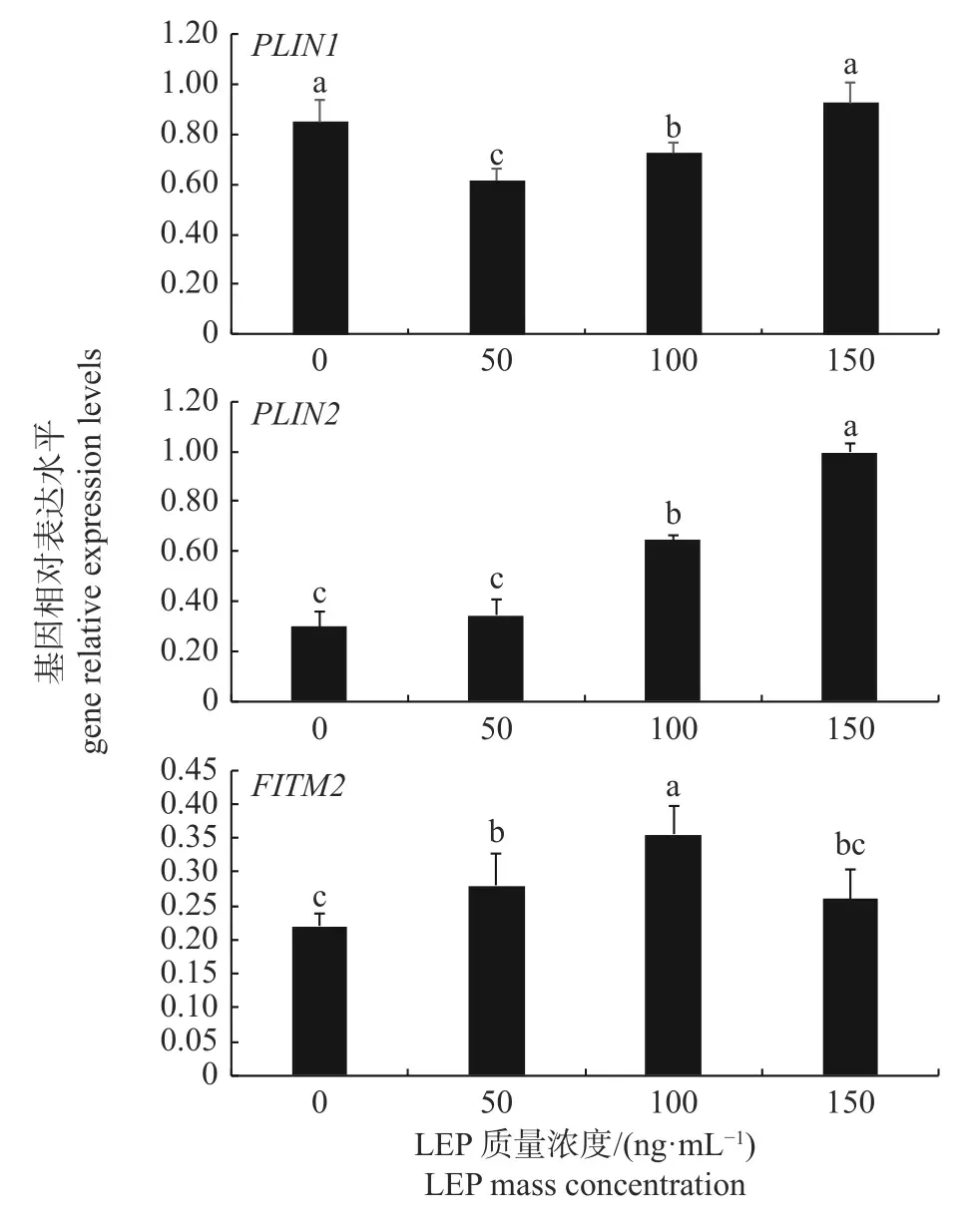
图4 不同质量浓度LEP 下PLIN1、PLIN2 和FITM2基因相对表达水平Fig.4 Relative expression levels of PLIN1,PLIN2 and FITM2 genes at different LEP mass concentration
3 讨论
3.1 不同质量浓度LEP 对猪原代脂肪细胞TAG含量的影响
LEP 由白色脂肪组织分泌,调节脂代谢平衡,脂代谢紊乱时,机体脂肪合成增加以及分泌功能改变[2]。LEP 通过间接抑制葡萄糖氧化和脂肪生成,减少对胰岛素介导的脂肪刺激,抑制脂肪酸酯化的同时刺激脂肪酸氧化[16]。相关研究[13-15]表明:LEP 促进猪皮下脂肪细胞TAG 水解,降低猪皮下脂肪细胞中的TAG 含量。此外,TOKGÖZ 等[17]调查发现:肥胖青少年血液LEP 水平与肥胖具有正相关性;相关研究[18]通过LEP 治疗精神病患者肥胖,患者血清LEP 水平升高,患者皮下脂肪沉积减少。上述研究表明:不同质量浓度LEP 对脂代谢调节作用存在差异。
本研究发现:LEP 对猪原代脂肪细胞脂代谢的调节作用存在质量浓度差异。50 和100 ng/mL LEP 促进猪原代脂肪细胞中TAG 沉积;当LEP达150 ng/mL 时,LEP 可促进猪原代脂肪细胞中TAG 脂解(与50 和100 ng/mL LEP 组比较)或对猪原代脂肪细胞TAG 含量无显著影响(与0 ng/mL LEP 组比较)。本试验通过不同质量浓度LEP 处理猪原代脂肪细胞得到不同的结果,原因可能为150 ng/mL LEP 触发了脂肪细胞的LEP 拮抗[19],使猪原代脂肪细胞对LEP 敏感性降低,导致猪原代脂肪细胞中TAG 含量无明显变化。
3.2 不同质量浓度LEP 对脂滴相关基因mRNA表达的影响
机体内脂类物质由循环系统运输至各组织细胞,在细胞内以LDs 的形式沉积。FITM2 负责LDs 生产过程中TAG 的分配以及LDs 成熟后由内质网释放进入细胞质的转运[5-6,20]。CHOUDHARY 等[5]测定哺乳动物中FITM2表达时发现:FITM2参与TAG 分配,但与TAG 合成无关;过表达FITM2基因,细胞中中性脂质含量急剧增加。本研究表明:50 和100 ng/mL LEP 在增加猪原代脂肪细胞TAG 含量的同时显著上调FITM2基因表达水平,而150 ng/mL LEP 对猪原代脂肪细胞TAG 含量以及FITM2基因表达无显著影响。以50 和100 ng/mL LEP 组为参照,结合上述研究结果,表明FITM2基因表达水平的上升与原代脂肪细胞TAG 沉积相关。
PLIN1 作为脂滴表面蛋白,对脂代谢具有双向调节作用。一方面,PLIN1 作为LDs 屏障,通过黏附在LDs 表面阻止脂肪酶直接接触LDs中的TAG,起到保护LDs 免受脂解的作用[9,21];同时,PLIN1 的脂解活性受PLIN1基因甲基化[22]和PLIN1 蛋白磷酸化[11]的影响,抑制或促进脂解反应发生。研究证明:PLIN1基因表达有利于机体沉积TAG;PLIN1基因缺乏则表现出更多且更小的LDs,导致LDs 与酶的接触面积增加,促进脂解[21]。本研究发现:当LEP质量浓度升高至50 和100 ng/mL 时,猪原代脂肪细胞TAG 含量显著增加,降低PLIN1基因的表达水平;当LEP质量浓度继续升高至150 ng/mL 时,猪原代脂肪细胞中TAG 含量显著低于50 和100 ng/mL 组,而细胞PLIN1基因表达水平随着LEP 质量浓度的逐渐升高表现出递增的趋势,与0 ng/mL 组PLIN1基因表达持平。负调控细胞中PLIN1基因表达能够抑制或促进细胞TAG 沉积[8,21],但PLIN1基因对细胞TAG 代谢可能存在物种差异性。本研究所得结果与利用小鼠[21]和人[22]脂肪细胞作为研究材料所得的结果存在差异,不同的研究方法可能是本研究中PLIN1基因表达水平与细胞TAG 含量结果出现差异的原因。
高能量饮食饲喂条件下,PLIN2基因缺失小鼠避免了高脂饮食导致的肥胖[10]。此外,TAKAHASHI 等[11]诱导小鼠胚胎成纤维细胞分化为脂肪细胞,用慢病毒介导脂肪细胞PLIN2基因敲除,发现缺失PLIN2基因的小鼠分化细胞脂解过程时间依赖性减弱。本研究表明:LEP 诱导猪原代脂肪细胞TAG 生成过程中,PLIN2基因表达呈现上升趋势,并且随LEP 质量浓度的升高,PLIN2基因表达随之上升。可见,PLIN2对细胞脂解过程的调控具有双向性。结合本研究结果,表明猪原代脂肪细胞PLIN2基因的表达在一定程度上与LEP 质量浓度正相关,且LEP 质量浓度为0~100 ng/mL 时,PLIN2基因表达表现为促进原代脂肪细胞沉积TAG,而LEP 质量浓度达到150 ng/mL 时,PLIN2基因表达表现为促进细胞水解TAG。
4 结论
LEP 调节猪原代脂肪细胞脂滴相关基因表达具有质量浓度差异性。50 和100 ng/mL LEP 促进猪原代脂肪细胞中TAG 的沉积,而150 ng/mL LEP 促进其降解;LEP 促进TAG 沉积过程中,LEP促进FITM2和PLIN2基因表达,降低PLIN1基因表达;LEP 促进脂解过程中,LEP 促进PLIN2基因表达,并有上调PLIN1基因表达的趋势。

