降糖消渴颗粒对糖尿病小鼠肝脏糖原储备量及糖代谢相关基因表达的影响*
张毅,赵丹丹,莫芳芳,高思华
(1.北京开放大学,北京 100081;2.北京中医药大学,北京 100029)
2型糖尿病(T2DM)是与遗传、环境污染、免疫、年龄、生活方式等多因素密切相关的内分泌代谢性疾病之一,在全球的发病率呈持续升高趋势[1-2]。随着人口老龄化的加剧和肥胖人群的增多,再加之巨大的人口基数,目前中国已居T2DM人数高发国家前列[3]。肝脏是人体内参与糖类代谢的重要器官之一,血液中的胰岛素可以与肝脏胰岛素受体底物-2(IRS-2)结合促进肝脏合成糖原,减少肝糖的输出,以降低循环系统中葡萄糖的含量,从而维持正常血糖水平[4]。胰岛素抵抗在T2DM继发肝脏合成糖原功能异常环节中起着非常重要的作用。在胰岛素抵抗状态下,肝脏储备糖原能力降低,糖异生作用加强,葡萄糖输出增多,循环系统中葡萄糖含量增加,T2DM患者的血糖水平升高[5-7]。
降糖消渴颗粒是以《黄帝内经》中关于“消渴病”病因病机的论述为理论指导,结合导师多年的临床经验创制而成的治疗糖尿病的方剂,由丹参、生地黄、黄连、茯苓、山萸肉、生晒参等10味药组成,组方旨在肝、脾、肾3脏同调。根据糖尿病的发病特点,以疏肝、健脾、固肾为本,兼以清热燥湿、益气升阳,临床根据所病脏腑的先后顺序灵活调整方中药物的剂量,效果显著[8-9]。同时,该方经前期基础实验研究证实具有良好的改善胰岛素抵抗、降低血糖、延缓或逆转糖尿病靶器官轻度损伤的作用[10-13]。
本实验选用自发性2型糖尿病KK-Ay小鼠为研究对象,以高脂饲料喂养诱导发病,模拟人类T2DM发病中遗传因素、饮食不节等病因,探讨降糖消渴颗粒对糖尿病小鼠肝脏糖原合成及储备能力的影响。
1 材料
1.1 实验动物 雄性8周龄KK-Ay小鼠、C57BL/6J小鼠,均由北京华阜康生物科技有限公司[许可证号SCXK(京)2012-0001]提供,饲养于北京中医药大学屏障环境动物实验室 [合格证号SCXK(京)2011-0024],实验室环境温度22~24℃,相对湿度(40±10)%,12/12 h 光照/黑暗循环,饲养期间,动物自由进食、饮水。高脂饲料(20%蔗糖、2.5%胆固醇、10%猪油、1%胆酸钠、66.5%基础饲料)及普通饲料由北京科澳协力饲料有限公司。本动物实验经北京中医药大学医学与实验动物伦理委员会批准。
1.2 实验药物 降糖消渴颗粒及制备方法详见前期研究文献[10-13],规格:每克颗粒含5.01 g生药。吡格列酮片由北京太洋药业有限公司生产。
1.3 主要仪器与试剂 光学显微镜(日本奥林帕斯)、Trizol试剂(美国 Invitrogen公司)、SYBR Mix试剂盒(美国ABI公司)、引物设计合成(上海生物工程有限公司)、Carnoy固定液(无水乙醇、冰醋酸、三氯甲烷3种试剂,配置体积比例为6∶1∶3,使用前将三者混匀,分装入各标记离心管中,现用现配)、50 mL过碘酸溶液(称取0.4 g过碘酸,加入10 mL去离子水中混合为A液,95%乙醇35 mL与0.2 mol/L醋酸钠5 mL混合为B液,使用前将A液加入B液中充分混匀)、Schiff反应剂(称取1 g碱性品红加入盛有200 mL加热至沸的去离子水的三角瓶中,搅拌至溶解,继续加热10 min,冷却至50℃后过滤,缓缓加入20 mL浓盐酸,冷却至室温后加入1 g无水偏重亚硫酸钠,密封瓶口,室温避光处放置2 d至成熟,4℃冰箱保存)。若有色可加入1 g活性炭后过滤使用。
2 方法
2.1 动物模型制备及分组给药方法 KK-Ay小鼠40只,C57BL/6J小鼠8只,适应性饲养1周后给予KK-Ay小鼠高脂饲料饮食造模,C57BL/6J小鼠给予普通饲料喂养。继续饲养4周,禁食12 h后检测KK-Ay小鼠空腹血糖,以空腹血糖≥13.9 mmol/L为糖尿病小鼠成模标准。将糖尿病小鼠按照血糖水平及体质量随机分为模型组,吡格列酮组,降糖消渴颗粒高(7.00 g/kg)、中(3.50 g/kg)、低(1.75 g/kg)剂量组,每组8只。中剂量由人鼠等效剂量换算得出,高、低剂量分别是人鼠等效剂量的2倍和0.5倍。降糖消渴颗粒治疗各组实验小鼠给予等体积,不同浓度中药混悬液灌胃,吡格列酮组实验小鼠给予剂量计算方法如下:给药剂量=6.5 mg/kg体质量×给药体积(0.1 mL/10 g体质量),模型组和正常组予等体积蒸馏水灌胃。治疗周期为10周,各组实验动物饲养延续造模期间饮食模式,期间于每日上午灌胃1次。
2.2 检测指标与方法
2.2.1 摄食量及体质量增长率检测 给药的0~10周期间,于每周同一时间段记录小鼠摄食量;于第0周和第10周称取小鼠体质量,计算体质量增长率。公式如下:体质量增长率=(治疗后体质量-治疗前体质量)/治疗前体质量。
2.2.2 采用过碘酸雪夫染色法检测肝脏中糖原情况 动物麻醉后开腹,摘取肝脏,取相同部位肝组织,放入Carnoy固定液中固定至少4 h,余下肝组织液氮保存备用。固定后的肝组织梯度浓度乙醇脱水,经二甲苯透明后石蜡包埋、切片、烘干;梯度浓度乙醇水化,浸入过碘酸液30 min后浸入Schiff液,室温避光,待糖原显色后冲洗、脱水、透明后中性树胶封片,于光学显微镜下观察肝脏糖原分布情况。通过IOD/Area值计算肝糖原含量。
2.2.3 采用逆转录-聚合酶链式反应(PCR)法检测肝脏糖代谢相关基因的表达 IRS-2引物上游序列:5′-CCA GTA AAC GGA GGT GGC TA-3′;下游引物序列:5′-GCT TAG GGT CTG GGT TCT CC-3′。AKT-1引物上游序列:5′-ATG TGG ATC AGC GAG AGT CC-3′;下游引物序列:5′-GCA GCG GAT GAT AAA GGT GT-3′。GSK-3α 引物上游序列:5′-TCT GAG CAA GCA GGT CTG TG-3′;下游引物序列:5′-TCT AGC ACG CAC ACC AAG TC-3′。剪取 5 mm×5 mm体积肝组织,应用Trizol法提取肝组织中的RNA,根据反转录试剂盒操作说明,将肝组织总RNA转录成单链cDNA,将反转录所得cDNA用DEPC水10倍稀释后加入下述20 μL反应体系中:SYBR MIX(10 μL)+c DNA 模板(2 μL)+上/下游引物(各1 μL)+无核酸酶超纯水(6 μL),每组取 4 个样本,各样本设2个复孔进行上样。上样后PCR膜封板,放入荧光定量PCR仪中进行扩增反应,反应条件如下:50 ℃,2 min;95 ℃,10 min;95℃,15 s;60℃,60 s,40个循环,结束后4℃保存。扩增结果以Ct值表示,导出至EXCEL中,各样本mRNA表达结果以样本中β-actin的Ct值为基准进行标准化计算,得到相对表达量,结果用 2-ΔΔCt表示。ΔΔCt计算公式如下:ΔΔCt=(Ct目的基因-Ctβactin)实验组-(Ct目的基因-Ctβactin)对照组。
2.3 统计学方法 实验结果用SPSS 19.0软件进行数据分析处理,计量资料以均数±标准差(±s)表示。组间比较采用单因素方差分析(One-way ANOVA),P<0.05表示差异性具有统计学意义。使用Graph Pad Prism 6.0软件绘制结果图。
3 结果
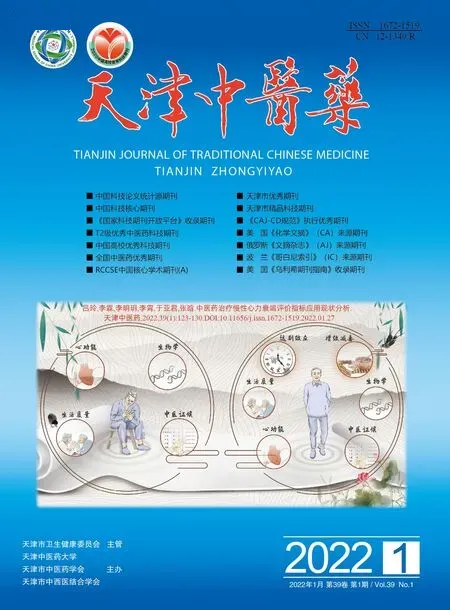
3.1 降糖消渴颗粒对T2DM小鼠摄食量及体质量增长率的影响 如图1所示,治疗前,KK-Ay各组小鼠摄食量显著高于正常组小鼠(P<0.01),组间无统计学差异(P>0.05)。在为期10周的治疗过程中,小鼠饮食量虽无明显增减(P>0.05),但每周都有所波动。摄食量曲线下面积显示,KK-Ay小鼠摄食量明显高于正常组小鼠(P<0.01),各KK-Ay小鼠的摄食量比较无差异(P>0.05)。各治疗组均未明显影响小鼠摄食量。
图1 降糖消渴颗粒及吡格列酮对各组小鼠日均摄食量的影响(±s,n=8)Fig.1 Effect of JTXK Granule and pioglitazone on daily food intake in mice of each group(±s,n=8)
如表1所示,各组小鼠体质量在治疗结束后均有所增加,KK-Ay小鼠较正常小鼠增质量明显(P<0.01),体质量增长率也有统计学差异(P<0.05)。但各治疗组小鼠增质量情况及体质量增长率较模型组无统计学差异(P>0.05)。
表1 降糖消渴颗粒及吡格列酮对各组小鼠体质量增长率的影响(±s)Tab.1 Effect of JTXK Granule and pioglitazone on the rate of weight gain in mice of each group(±s)
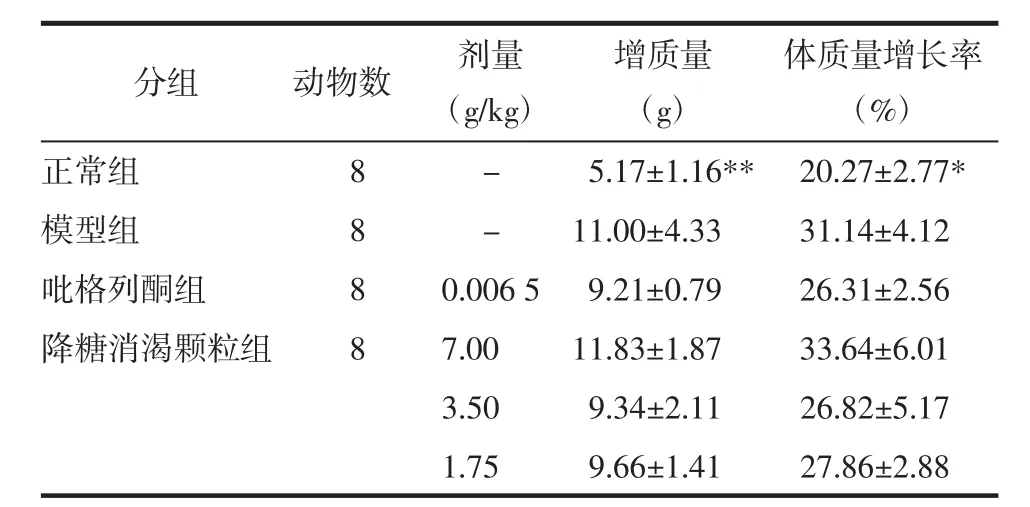
表1 降糖消渴颗粒及吡格列酮对各组小鼠体质量增长率的影响(±s)Tab.1 Effect of JTXK Granule and pioglitazone on the rate of weight gain in mice of each group(±s)
注:正常组为C57BL/6J小鼠,其余为KK-Ay小鼠。与模型组比较,*P<0.05,**P<0.01。
分组正常组模型组吡格列酮组降糖消渴颗粒组动物数 剂量(g/kg)增质量(g)8 8 8 8体质量增长率(%)- 5.17±1.16** 20.27±2.77*- 11.00±4.33 31.14±4.12 0.006 5 9.21±0.79 26.31±2.56 7.00 11.83±1.87 33.64±6.01 3.50 9.34±2.11 26.82±5.17 1.75 9.66±1.41 27.86±2.88
3.2 降糖消渴颗粒对T2DM小鼠肝脏糖原含量的影响 如图2所示,正常小鼠肝组织致密,细胞形态规则,门管区结构清晰,肝索排列有序,包浆中均匀散布大量紫红色糖原颗粒。KK-Ay小鼠较正常小鼠肝组织内存在不等量脂肪性空泡,细胞形态肿胀,门管区结构改变,肝索排列紊乱,胞浆中散在分布紫红色肝糖原颗粒。各治疗组肝脏病理改变均有不同程度减轻,降糖消渴颗粒治疗各组尤为明显。
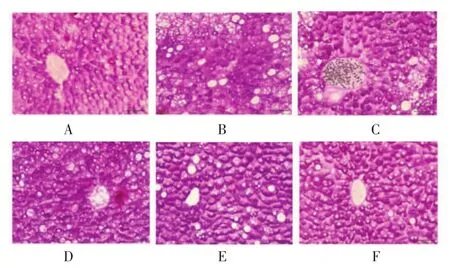
图2 降糖消渴颗粒及吡格列酮对各组小鼠肝脏糖原储备量的影响(PAS染色,×40)Fig.2 Effect of JTXK Granule and pioglitazone on the liver glycogen stores in mice of each group(PAS stain,×40)
如表2所示,KK-Ay小鼠经药物治疗后,肝脏糖原储备能力均有不同程度增强,但吡格列酮组和高剂量降糖消渴颗粒组小鼠与模型组比无统计学意义(P>0.05),中剂量降糖消渴颗粒作用最佳(P<0.05)。
表2 降糖消渴颗粒及吡格列酮对各组小鼠肝脏内糖原储备量的影响(±s)Tab.2 Effect of JTXK Granule and pioglitazone on the liver glycogen stores in mice of each group(±s)
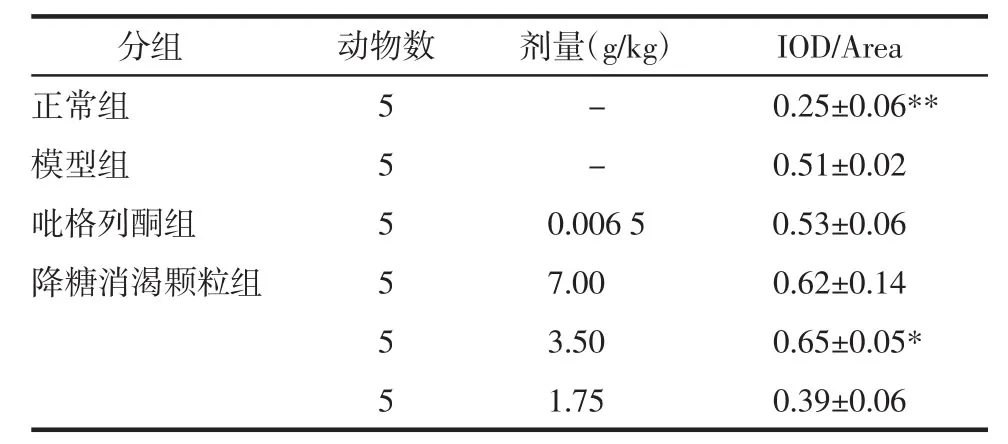
表2 降糖消渴颗粒及吡格列酮对各组小鼠肝脏内糖原储备量的影响(±s)Tab.2 Effect of JTXK Granule and pioglitazone on the liver glycogen stores in mice of each group(±s)
注:正常组为C57BL/6J小鼠,其余为KK-Ay小鼠。与模型组比较,*P<0.05,**P<0.01。
分组正常组模型组吡格列酮组降糖消渴颗粒组动物数5 5 5 5 5 5剂量(g/kg) IOD/Area-0.25±0.06**-0.51±0.02 0.006 5 0.53±0.06 7.00 0.62±0.14 3.50 0.65±0.05*1.75 0.39±0.06
3.3 降糖消渴颗粒对T2DM小鼠肝脏调控糖代谢相关基因表达的影响 如表3所示,与正常小鼠比较,模型组小鼠肝脏 IRS-2、Akt、GSK-3α mRNA 的表达均显著上调(P<0.01);与模型组比较,吡格列酮组、高、中剂量降糖消渴颗粒组IRS-2 mRNA的表达明显升高(P<0.01),低剂量也可发挥一定作用(P<0.05);在Akt mRNA的表达方面,吡格列酮组、中剂量组作用明显(P<0.01),而在 GSK-3α mRNA的表达方面,中、高剂量降糖消渴颗粒则具有显著优势(P<0.01)。
表3 降糖消渴颗粒及吡格列酮对各组小鼠肝脏IRS-2、Akt、GSK-3αmRNA 表达的影响(±s)Tab.3 Effect of JTXK Granule and pioglitazone on the liver IRS-2,Akt,GSK-3αmRNA expressions in mice of each group(±s)
注:正常组为C57BL/6J小鼠,其余为KK-Ay小鼠。与模型组比较,*P<0.05,**P<0.01。
分组 IRS-2RQ AktRQ GSK-3αRQ动物数 剂量(g/kg)正常组 1.01±0.18** 1.01±0.13** 1.01±0.16**模型组 0.04±0.01 0.38±0.05 1.89±0.32吡格列酮组 0.21±0.06** 0.63±0.03** 1.56±0.27降糖消渴颗粒组 0.22±0.03** 0.46±0.12 1.19±0.15**0.27±0.11** 0.82±0.19** 1.37±0.28**0.16±0.06* 0.48±0.05 1.67±0.43 4 4 4 4 4 4- -0.006 5 7.00 3.50 1.75
4 讨论
《素问·经脉别论》有云:“饮入于胃,游溢精气,上输于脾,脾气散精,上归于肺,通调水道,下输膀胱,水精四布,五经并行。”这段原文描述了食物进入胃内,通过脾气“散精”的功能将饮食物中的精微物质布散至全身,与其他脏腑协同合作,发挥脾胃后天之本作用的过程。其间除脾脏功能的正常发挥起到决定性作用外,还需依赖肝主疏泄与肾主水液功能的正常。糖类、脂肪、蛋白质三大营养物质均属于中医“水谷精微”范畴,正常情况下负责为机体维持生命活动提供能量[14]。在糖尿病状态下,肝脾肾3脏功能的失调导致水谷精微物质无法正常流转,在体内积聚成痰浊、瘀血等病理产物,堆积日久化热反过来影响三脏功能,进一步加剧糖尿病的糖脂代谢紊乱状态[15]。
肝糖原是机体内葡萄糖的有效储存形式之一,糖异生及肝脏内糖原合成是机体血糖的重要来源和消耗途径,肝糖原的合成减少或分解增多都会引起血糖升高,与糖尿病的糖代谢紊乱密切相关[16]。IRS-2是胰岛素信号通路的重要信号蛋白之一,在肝脏中大量表达,可促进肝糖原的合成及抑制肝脏中葡萄糖的输出,其功能异常不仅会减少肝糖原的合成,还会减弱肝脏对葡萄糖输出的抑制作用,产生糖代谢的障碍[17-18]。蛋白激酶B(PKB)是胰岛素信号通路中的关键因子,调控机体糖代谢的关键酶,可阻止肝脏的糖异生作用[19],还可抑制糖原合成酶激酶-3α(GSK-3α)活性,从而使糖原合成酶活性增强,糖原合成量增加,起到降低血糖的作用[20]。GSK-3α是介导糖原合成的关键酶[21],受胰岛素调控,可磷酸化糖原合成酶使其失活,负反馈调节糖原合成,维持体内葡萄糖的相对稳态。肝组织内GSK-3α mRNA表达的减少可降低对糖原合成酶的抑制作用,导致糖原合成酶活化,促进肝细胞摄取利用血液中的葡萄糖,合成肝糖原储存在肝脏中,从而起到降低血糖,缓解体内糖代谢异常的作用[22-23]。降糖消渴颗粒发挥其降糖效应的可能机制之一是通过提高肝脏的糖原合成能力,促进血糖向肝糖原转化的作用实现的。
本实验中高、中剂量降糖消渴颗粒对糖尿病小鼠的食欲均有不同程度的抑制作用,中、低剂量降糖消渴颗粒还具有降低糖尿病小鼠体质量增长率的趋势,这说明降糖消渴颗粒调节糖代谢的途径之一可能是在一定程度上改善糖尿病的“多食”状态,以减少血糖的来源。在肝脏胰岛素信号通路方面,各剂量降糖消渴颗粒通过上调实验小鼠肝脏胰岛素信号通路中IRS-2的表达来促进肝脏对葡萄糖的摄取和利用,合成肝糖原并抑制肝脏葡萄糖的输出;中剂量同时上调Akt的表达来减少肝脏糖异生,调节糖代谢。在肝脏糖原储备方面,糖尿病小鼠肝脏发生了不同程度的脂肪化变性,破坏了细胞正常结构,肝糖原合成及储存能力遭到破坏。结合IOD/Area值可以看出,经吡格列酮及高、低剂量降糖消渴颗粒治疗后的糖尿病小鼠肝糖原变化不明显,而中剂量体现出了增加肝糖原含量的优势。除此之外,高、中剂量降糖消渴颗粒明显下调了肝组织中GSK-3α的mRNA表达,负反馈活化糖原合成酶,肝脏合成糖原能力增强。但本实验中正常组小鼠肝糖原含量低于各组糖尿病小鼠,这可能是由于基础饲料和高脂饲料营养物质含量的差异性引起的。
综上所述,中剂量降糖消渴颗粒可以减少摄入体内的葡萄糖;增加肝脏中IRS-2和调节机体糖代谢关键酶Akt的表达,以减少糖异生,与此同时下调GSK-3α的表达,促进葡萄糖转化成肝糖原储存在肝脏中。