丙泊酚抑制人子宫内膜癌细胞系RL95-2增殖
李勇晓,孙 燕,张瑞生
(郑州市妇幼保健院 麻醉科,河南 郑州 450000)
子宫内膜癌(endometrial carcinoma)为发生于子宫内膜上皮的恶性肿瘤,易发人群为绝经期及绝经后女性[1]。近年来,子宫内膜癌的发病率明显上升,对于早期子宫内膜癌患者一般采取手术治疗,对于无法手术或复发的子宫内膜癌患者大多采取放射治疗和化学治疗,但对患者正常身体机能的副作用较大。因此,探索新的治疗策略对于子宫内膜癌的临床治疗具有重要意义。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是细胞增殖过程中的重要调节因子,它可由蛋白激酶B(protein kinase B, PKB,又称Akt)启动并活化,活化的mTOR调控下游效应蛋白核糖体蛋白S6激酶1(ribosomal protein S6 kinase 1, S6K1)的表达,影响细胞周期从而调节细胞的增殖、凋亡等[2-3]。研究发现,mTOR信号通路的激活与肿瘤的不良预后有关[4]。抑制mTOR信号通路的激活,可在抗肿瘤方面起到重要作用,这也成为了一种预防和治疗肿瘤的新策略[5-6]。丙泊酚(propofol)是一种短效的静脉麻醉药物,因其具有起效快、副作用小等优点而被广泛应用于临床中。近年来,研究者们发现丙泊酚可抑制癌细胞增殖并且诱导其凋亡,对肿瘤具有调控作用[7]。目前,关于丙泊酚对子宫内膜癌的作用鲜有报道。本研究采用丙泊酚干预子宫内膜癌细胞系细胞,以观察癌细胞增殖及凋亡情况的变化,从分子水平上去探究丙泊酚对mTOR信号通路的影响,为子宫内膜癌治疗提供一定的理论及实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞系:人子宫内膜癌细胞系RL95-2(武汉云克隆动物有限公司)。
1.1.2 试剂及试剂盒:丙泊酚(propofol)(北京普天同创生物科技有限公司);DMEM培养基和胎牛血清(FBS)(Hyclone公司);二甲基亚砜(DMSO)、0.2%胰蛋白酶溶液和细胞裂解液(Invitrogen公司);caspase-3和caspase-9活性测定试剂盒(北京索莱宝科技有限公司);蛋白提取试剂盒和蛋白浓度测定试剂盒(上海碧云天生物技术研究所);Annexin V-FITC/PI细胞凋亡检测试剂盒(BD公司);抗-Akt、-p-Akt、-mTOR、 -p-mTOR、 -S6K1和-p-S6K1抗体[赛默飞世尔科技(中国)有限公司]。
1.2 方法
1.2.1 实验的分组及处理:将RL95-2细胞随机分为:对照组:10 %胎牛血清+DMEM培养基培养、丙泊酚低(1.25 mmol/L)、中(2.5 mmol/L)和高剂量组(5 mmol/L)。每组10例,均在37 ℃、5% CO2条件下培养24 h。
1.2.2 CCK-8法检测RL95-2细胞增殖:将RL95-2细胞以浓度为2×104个/mL接种于96孔板中,加入10 μL的CCK-8溶液,继续培养1 h,利用酶标仪检测490 nm处吸光度(A)值。细胞增殖率%=丙泊酚处理组(A)/对照组(A)×100%。
1.2.3 克隆形成实验检测RL95-2细胞克隆形成:将RL95-2配制成浓度为1×106个/mL的单细胞悬液,2 mL/孔接种于6孔板中,培养24 h,弃去上层培养基并加入胰蛋白酶对细胞进行消化,加入新的培养基终止消化后,4 ℃、1 500 r/min离心10 min收集细胞。将各组细胞重悬并以1 000个/10 cm皿的密度接种于含DMEM培养基的平板培养皿中,37 ℃、5% CO2条件下培养2~3周,期间经常观察,当出现肉眼可见的细胞克隆时,终止培养并对细胞进行固定和染色,显微镜下观察并计数大于50个细胞的克隆数。克隆形成率%=克隆数/接种细胞数×100%。
1.2.4 流式细胞测量术检测RL95-2细胞凋亡:将RL95-2以浓度为1×106个/mL接种于6孔板中,培养24 h,用胰蛋白酶消化细胞,离心收集细胞。无菌磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤细胞2次,随后用annexin V-FITC/PI细胞凋亡检测试剂盒中的缓冲液将细胞重悬,再次调整细胞浓度为1×106个/mL。取各组100 μL重悬后的细胞分别加入流式管中,做好分组标记,再向流式管中加入5 μL抗 annexin V-FITC抗体和抗5 μL annexin V-PI抗体,快速混合均匀后避光孵育15 min,加入400 μL缓冲液混匀后上样流式细胞仪,分析细胞凋亡情况,注意全程冰上操作。
1.2.5 比色法检测RL95-2细胞caspase-3和caspase-9活性:将RL95-2细胞以1×106个/mL的接种于细胞培养瓶中,加入胰蛋白酶对细胞进行消化,1 500 r/min离心10 min,弃去培养基,用无菌PBS洗涤1次,收集细胞并加入细胞裂解液作用15 min,4 ℃低温10 000 r/min离心10 min。按照试剂盒说明书,取离心后上清液进行caspase-3和caspase-9活性测定,通过酶标仪测定405 nm吸光度(A)值。
1.2.6 蛋白质免疫印迹法(Western blot)检测细胞Akt、mTOR和S6K1蛋白磷酸化水平:将RL95-2细胞以浓度为1×106个/mL接种于6孔板中培养过夜。弃去培养基后用胰蛋白酶消化细胞,终止后低温1 500 r/min离心10 min,无菌PBS洗涤细胞2次,再次离心弃上清,加入细胞裂解液,按照试剂盒说明书提取细胞总蛋白。蛋白定量后进行SDS-PAGE,小心取出凝胶并用蛋白转膜仪进行PVDF转膜,在室温下用5%脱脂奶封闭1 h,加入稀释(1∶1 000)的对应一抗,4 ℃摇床孵育过夜,弃去一抗溶液并洗涤PVDF膜,加入稀释(1∶2 000)的二抗溶液,室温摇床1 h,洗膜3次,ECL显色并用凝胶成像系统拍照。
1.3 统计学分析

2 结果
2.1 丙泊酚对RL95-2细胞增殖的影响
当丙泊酚浓度为10 mmol/L时,RL95-2细胞增值率下降至77.36%±4.55%,说明丙泊酚浓度大于等于10 mmol/L会对RL95-2细胞有明显的细胞毒性(表1)。因此,在后续试验中将丙泊酚的浓度设定为:低(1.25 mmol/L)、中(2.5 mmol/L)和高剂量组(5 mmol/L)。
相比于对照组,丙泊酚各组RL95-2细胞增殖率和细胞克隆形成能力显著降低(P<0.05)(图1,表2)。
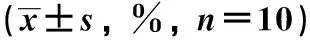
表1 不同浓度丙泊酚对RL95-2细胞增值率的影响
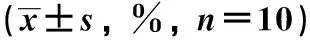
表2 丙泊酚对RL95-2细胞增殖率和细胞克隆形成能力的影响
2.2 丙泊酚对RL95-2细胞凋亡的影响
丙泊酚各组相比于对照组,RL95-2细胞凋亡率显著升高(P<0.05)(图2,表3)。
2.3 丙泊酚对RL95-2细胞caspase-3和caspase-9活性的影响
相比于对照组,丙泊酚各组RL95-2细胞caspase-3和caspase-9活性明显升高(P<0.05)(表4)。
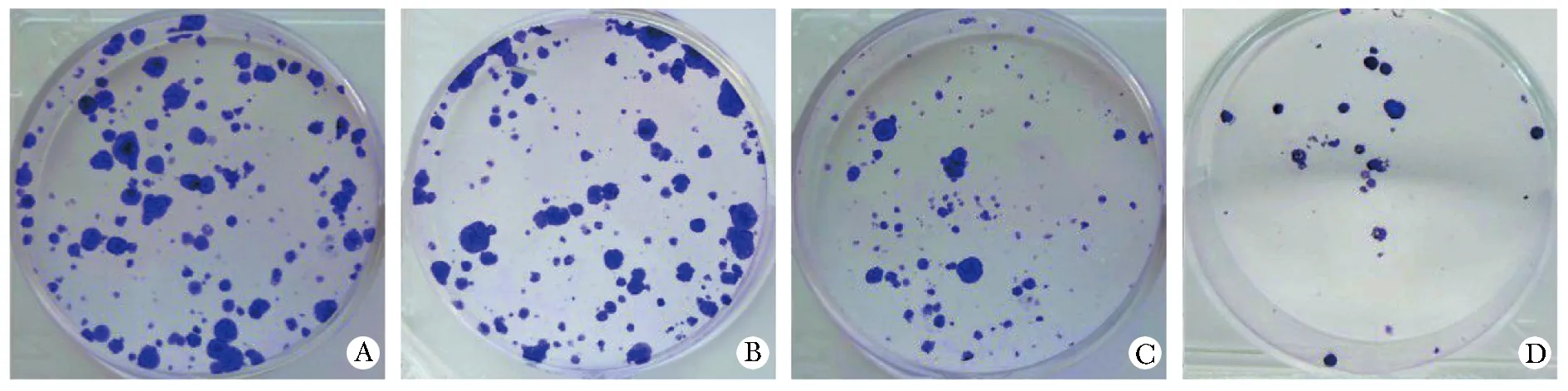
A.control group; B.propofol low dose group; C.propofol medium dose group; D.propofol high dose group图1 丙泊酚对RL95-2细胞克隆形成能力的影响Fig 1 Effect of propofol on the clone formation ability of RL95-2 cells
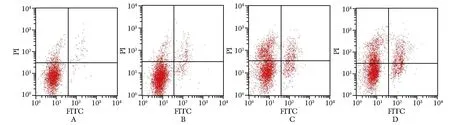
A.control group; B.propofol low dose group; C.propofol medium dose group; D.propofol high dose group图2 丙泊酚对RL95-2细胞凋亡的影响Fig 2 Effect of propofol on apoptosis of RL95-2 cells
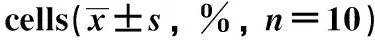
表3 丙泊酚对RL95-2细胞凋亡的影响
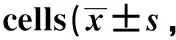
表4 丙泊酚对RL95-2细胞caspase-3和caspase-9活性的影响
2.4 丙泊酚对RL95-2细胞Akt、mTOR、S6K1和STAT3蛋白磷酸化水平的影响
丙泊酚各组RL95-2细胞中Akt、mTOR和S6K1蛋白磷酸化水平均显著低于对照组(P<0.05)(图3,表5)。
3 讨论
子宫内膜癌是一种常见的女性生殖系统恶性肿瘤, 发病率仅次于宫颈癌和卵巢癌, 多见于55岁左
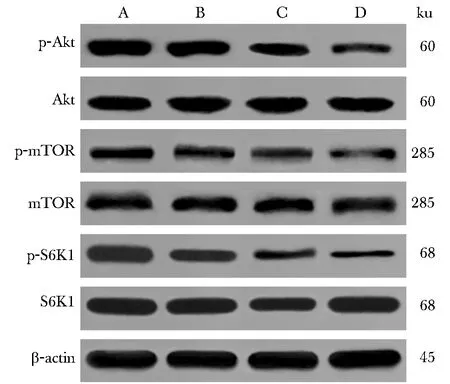
A.control group; B.propofol low dose group; C.propofol medium dose group; D.propofol high dose group图3 丙泊酚对RL95-2细胞p-Akt、Akt、p-mTOR、mTOR、p-S6K1和S6K1蛋白表达水平的影响Fig 3 Effects of propofol on the protein expressions of p-Akt, Akt, p-mTOR, mTOR, p-S6K1 and S6K1 in RL95-2 cells
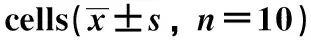
表5 丙泊酚对RL95-2细胞p-Akt/Akt、p-mTOR/mTOR和p-S6K1/S6K1水平的影响
右的绝经妇女。患者症状表现为出血、阴道排液、疼痛以及腹部包块等。患者持续出血或会导致继发性贫血;肿瘤扩散可于腹股沟等多处发现肿大的或融合的淋巴结转移病灶;长期病痛和消耗使患者出现持续发热、消瘦及恶病质等全身衰竭的表现[8]。目前,子宫内膜癌的发病率逐年升高,严重威胁女性身心健康。寻求安全高效的子宫内膜癌治疗策略成为专家学者们亟待解决的问题。
丙泊酚为静脉麻醉药物,于80年代中期开始应用于临床。鉴于其显著的优势:起效迅速、可控性强、维持时间短、苏醒较快、副作用小并且无积蓄等,目前已被广泛应用于临床手术麻醉及镇静。近年来,发现丙泊酚参与许多与癌相关的病理生理过程,它可通过调节多种信号通路、下游分子和微小RNA等的表达,抑制肿瘤的生长和转移;还可以增强化疗药物或一些小分子化合物的抗肿瘤作用[9-10]。研究报道,丙泊酚可抑制低氧诱导的食管癌细胞迁移、侵袭和上皮间质转化[11]。有报道[12]用丙泊酚对肺、结肠、神经胶质瘤、肾和卵巢癌细胞进行干预培养后发现,丙泊酚可下调细胞中的6个促癌基因、上调8个抗癌基因,并且干扰癌细胞的代谢,引起糖代谢紊乱,降低肿瘤的恶性程度。本研究结果表明,丙泊酚可抑制子宫内膜癌细胞的增殖和克隆形成能力,上调凋亡相关的caspase-3和caspase-9活性,促进细胞凋亡。提示,丙泊酚在子宫内膜癌中可起到抗肿瘤作用,在子宫内膜癌治疗手术中用丙泊酚作为麻醉剂或可能改善患者预后。
研究报道,mTOR信号通路在多种人类肿瘤中存在高表达和高活化,如宫颈癌、肺癌、乳腺癌、前列腺癌和结肠癌等,抑制mTOR在肿瘤治疗中具有重要作用[13-14]。近年,随着对mTOR信号通路的逐步研究,该通路在肿瘤相关发展进程(例如细胞增殖、新陈代谢和细胞凋亡等)中的机制日益清晰,靶向抑制mTOR信号通路的激活成为癌治疗的一个较有潜力的研究方向。本研究结果显示,丙泊酚干预后的子宫内膜癌细胞中Akt、mTOR和S6K1磷酸化水平均显著降低。结合已有的研究报道[15],抑制mTOR通路可下调其下游介质(如S6K1)的激活,引起细胞周期阻滞从而诱导癌细胞凋亡,推测本研究中,丙泊酚可能通过抑制mTOR信号通路的激活,诱导癌细胞凋亡。
综上所述,丙泊酚可抑制子宫内膜癌细胞增殖,可能调控mTOR信号通路,降低S6K1蛋白活化水平,促进癌细胞凋亡。但丙泊酚对子宫内膜癌的临床效用还需更多临床验证。

