GSK650394对慢性应激抑郁症模型大鼠行为及海马神经营养的调节作用
刘 丹,蔺晓源,杨 蕙,刘彤彤,刘平安,孟 盼*
(湖南中医药大学第一附属医院 1.风湿科; 3.医学实验中心,湖南 长沙 410007;2.湖南中医药大学 科技创新中心, 湖南 长沙 410208)
据世界卫生组织估计,全球约有3.5亿人患有抑郁症,高达40%的患者对抗抑郁药物反应不充分[1]。在过去的30年里,临床上多数抗抑郁药均通过增加脑内单胺神经递质起效,有效率仅为60%至65%,缓解率为30%,尽管这些药物在给药后数小时内会影响神经递质系统,但症状的改善通常需要治疗数周(4至6周)后才显现[2]。故而,亟待从新的角度和视野研发更为有效的抗抑郁药物。血清和糖皮质激素调节蛋白激酶1(serum and glucoc orticoid-regulated kinase 1,SGK1)是多种抑郁症相关信号传导通路和细胞磷酸化级联反应的交汇点[3]。多项研究表明,SGK1表达或功能的增加与抑郁症的致病性应激假说有关,其机制主要包括两方面,其一SGK1是介导下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal axis,HPA)轴失调的关键介质,其二SGK1可负调控脑源性神经营养因子(brain derived neurotrophic factor,BDNF)等神经营养素家族成员,从而抑制神经发生[4]。GSK650394是一个新颖的SGK1抑制剂,研究表明,GSK650394可抵消HPC03A/07人海马祖细胞中皮质醇诱导的神经再生的减少及Hedgehog信号通路的改变[5]。GSK650394具有良好的抗抑郁功效,然其机制尚不清楚。基于此,本实验拟通过SGK1抑制剂,初步探明SGK1在抑郁症大鼠抑郁样情绪行为中发挥的保护作用及其对神经营养的调节机制,以期为基于SGK1激酶的现代抗抑郁药物提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性SD大鼠,体质量220~240 g, 35只,购自湖南斯莱科景达动物中心,动物合格证号:43004700015235。
1.1.2 药物与试剂:GSK650394(Sigma-Aldrich公司);BDNF一抗(Ambion试剂公司);羊抗兔IgG二抗(Vector公司产品);ECL化学发光试剂盒、组织蛋白抽提试剂盒(北京中衫金桥有限公司);Protein Marker(MBI Fermentas公司产品);聚偏二氟乙烯膜(PVDF)(Merck公司)。
1.2 方法
1.2.1 大鼠的分组及处理:将大鼠分为对照组、抑郁模型组、GSK650394组。取GSK650394药物粉末,溶解于2 μL的DMSO中,采用蒸馏水配成终浓度为2.8 g/L的溶液,现用现配。按照1 mL/kg腹腔注射,每周注射1次。空白组注射等体积的蒸馏水,模型组注射等体积的配药溶剂。
各组单笼孤养,每天随机给予不同刺激,共21 d,包括:倾笼45°、潮湿垫料(24 h)、禁食(24 h)、夹尾(4 min)、禁水(24 h)、昼夜颠倒(24 h)、4 ℃冰水浴(5 min)、噪音(1 h),每天随机实施1种刺激且每种刺激5 d之内不重复。21 d后,各组大鼠分别进行行为学检测。空白组每笼5只饲养,不给予任何刺激。
1.2.2 行为学检测
1.2.2.1 糖水偏好实验[6]:禁水12 h,测试期间给予每只大鼠一瓶1%蔗糖水和一瓶蒸馏水,分别测定大鼠1 h摄入1%蔗糖水、蒸馏水的重量,并计算糖水偏好度。计算公式为:糖水偏好度=糖水消耗/总消耗×100%)。
1.2.2.2 强迫游泳实验:将大鼠置于玻璃圆柱体的水缸中(高、直径分别为50 cm、20 cm),水深约40 cm。实验开始后适应1 min,采用小动物行为分析系统(西班牙Panlab,Smart3.0)记录4 min内大鼠的游泳不动时间。
1.2.2.3 Morris水迷宫测试:实验第19天开始对大鼠进行训练,若1 min内未找到平台,则将其牵引至平台处停留20 s,学习持续4 d。第23天将大鼠从平台正对的象限处面向池壁放入,采用小动物行为分析系统记录其爬上平台的时间,即逃避潜伏期(escape latency,EL);于第23天撤除平台,由同一入水点将大鼠面向池壁放入水中,记录大鼠穿越目标象限的次数(target quadrant)和目标象限的潜伏时间(latency time,Lat.T)。
1.2.3 血液及脑组织样本的采集:腹主动脉取血,每组一半数量的大鼠血液采用抗凝管收集,另一半大鼠血液采用常规采血管放置直至凝血,3 000 r/min离心10 min,分别取上清-0 ℃冰箱保存。冰上取海马组织后,立即放入液氮中速冻,再转移至-80 ℃冰箱备用。
1.2.4 ELISA检测血液中CORT、5-HT、NE的含量:根据试剂盒说明书,采用ELISA测定各组大鼠血浆中皮质酮(corticosterone,CORT)及血清中5-羟色胺(5-hydroxytryptamine,5-HT)、去甲肾上腺素(norepinephrine,NE)的含量。
1.2.5 Western blot检测海马中蛋白的表达:冻存的海马中加入RIPA裂解液冰上匀浆,4 ℃、12 000 r/min离心15 min后取上清液,测定蛋白质含量,保存待用。配置15%浓缩胶与10%分离胶,上样、电泳、转膜、封闭,4 ℃过夜,加入相应的一抗,孵育,以GAPDH为内参。采用近红外双色激光成像系统测量吸光度值,计算各组目标蛋白的相对表达量,进行统计分析。
1.3 统计学分析
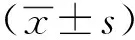
2 结果
2.1 各组大鼠糖水偏好度和强迫游泳不动时间的比较
与对照组比较,抑郁模型组大鼠蔗糖水偏食度显著降低,游泳不动时间增加(P<0.01);与模型组比较,GSK650394组大鼠蔗糖偏食度升高,不动时间显著下降(P<0.01或P<0.05)(表1)。
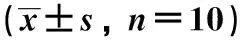
表1 GSK650394对抑郁大鼠糖水偏好和不动时间的影响
2.2 各组大鼠Morris水迷宫测试结果比较
与对照组比较,模型组大鼠EL、Lat.T均显著延长(P<0.05或P<0.01);与模型组比较,GSK650394组大鼠的EL、Lat.T均显著缩短(P<0.05)(表2)。
2.3 各组大鼠血浆CORT含量的变化
与对照组比较,模型组的血浆CORT明显增高(P<0.01)。与模型组比较,GSK650394组可降低血浆CORT的含量(P<0.05)(表3)。
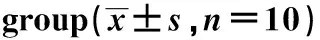
表2 GSK650394对各组大鼠水迷宫学习记忆的影响Table 2 Effect of GSK650394 on learning and memory in water maze test on rats in each
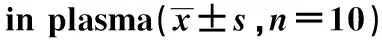
表3 GSK650394对血浆CORT含量的影响
2.4 各组大鼠血清5-HT、NE、BDNF的变化
与对照组比较,模型组的血清5-HT、NE、BDNF显著降低(P<0.05或P<0.01)。与模型组比较,GSK650394组可增加血清5-HT、NE、BDNF的含量(P<0.05或P<0.01)(表4)。

表4 GSK650394对血清5-HT、NE和BDNF含量的影响
2.5 各组大鼠海马BDNF、NT-3、NGF表达的影响
与对照组比较,模型组海马NT-3、BDNF、NGF表达明显减少(P<0.01或P<0.05);与模型组比较,GSK650394组大鼠海马NT-3、BDNF、NGF表达明显增加(P<0.01或P<0.05)(图1,表5)。
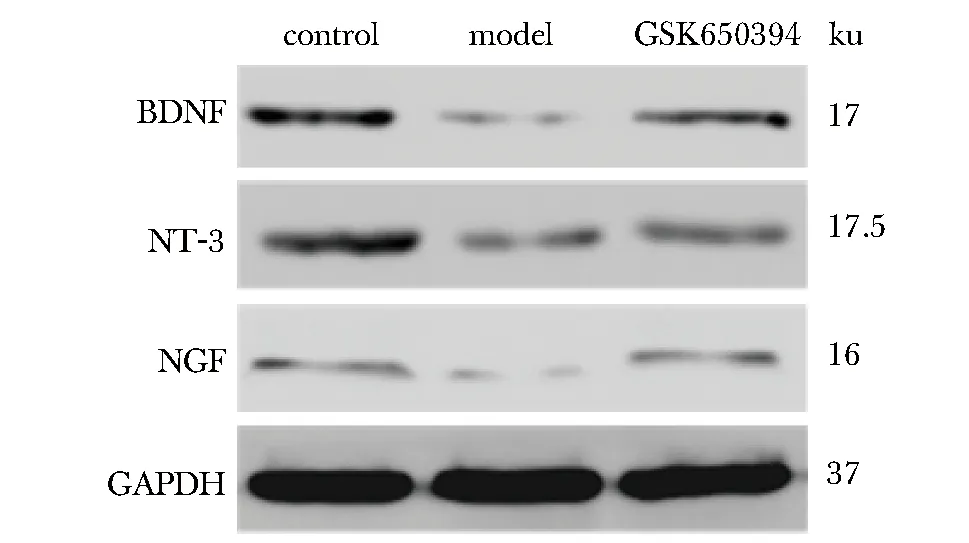
图1 GSK650394对海马BDNF、NT-3、NGF表达的影响Fig 1 Effect of GSK650394 on the expression of BDNF, NT-3, NGF in hippocampus

表5 GSK650394对海马BDNF、NT-3、NGF表达的影响
3 结论
目前,抑郁症是最常见的精神疾病,且全球每年80万自杀者中约有50%发生在抑郁症患者中,与普通人群相比,进行性肌营养不良症(major depressive disorder,MDD)患者死于自杀的风险高出20倍[7]。其特征是显著且持续的情绪低落、兴趣丧失、自尊低下、认知障碍、意志力下降和学习记忆能力减退等[8]。本研究结果表明,SGK1抑制剂GSK650394可显著增加蔗糖水偏食度、降低游泳不动时间,缩短EL、Lat.T,说明SGK1抑制剂能显著改善抑郁样情绪行为。
应激所调控的糖皮质激素信号和抑郁症存在复杂的交互关系已得到了广泛的证实,即糖皮质激素与其受体结合后以二聚体形式转位入核, 通过结合糖皮质激素受体(glucocorticoid receptor,GR)反应元件促进SGK1基因的转录表达[9]。SGK1不仅是CORT信号系统的下游靶点, 而且能在无糖皮质激素的条件下潜在维持GR的活性,增强CORT的负面效应[10]。本研究结果表明,SGK1抑制剂能显著降低血浆CORT的水平,提示GSK650394可有效阻断机体HPA轴的高亢状态。抑郁症发生时,CORT水平升高以及HPA轴功能亢进是比较典型的病理学特征。应激引起的高水平CORT与GR结合后可活化肝脏酪氨酸氨基转移酶和色氨酸吡咯化酶,降低血液中5-HT和NE前体的数量,继而减少5-HT和NE的合成,加剧抑郁症的发生发展[11-12]。本研究结果表明,SGK1抑制剂能显著增加血清5-HT、NE的含量,提示GSK650394具有良好的抗抑郁功效,其发挥抗抑郁的功效可能与阻断机体的持续应激高亢状态,导致单胺递质水平增加有关。
神经营养障碍是神经可塑性受损的关键基础,且越来越多的证据表明抗抑郁治疗可能通过增强神经营养保护神经元细胞的结构和功能并对突触可塑性发挥有益作用。BDNF、NGF、NT-3被认为是神经营养素家族中的重要成员,其中BDNF已成为公认的抑郁症诊断的生物标志物,在神经元的维持和存活、促进神经再生、加快突触生长和突触可塑性中均起到重要作用[13-14]。NGF可参与受损神经元的修复,并对病理状态下海马可塑性起到了重要的调节作用[15]。NT-3可调节神经干细胞的增殖和分化,并能促进神经祖细胞增殖分化为功能成熟的神经元[16]。研究表明,神经营养信号可直接或间接受到SGK1的调控[17],SGK1可能通过影响BDNF等神经营养因子而发挥神经保护的作用。本实验结果表明,GSK650394可上调海马BDNF、NT-3、NGF的表达,说明SGK1抑制剂可能通过维持海马神经元的增生和存活、促进神经干细胞的增殖和分化、加强神经营养的突触可塑性等不同角度,共同发挥营养神经的功效。
综上所示,SGK1抑制剂具有显著的缓解抑郁样行为及抑制HPA轴高亢的功效,其发挥抗抑郁的机制可能与促进海马神经营养相关。

