柯萨奇病毒B组5型感染的人恶性胚胎横纹肌肉瘤细胞系lncRNA表达谱分析
滕培英,李 静,师玉露,杨 帆,欧 霞,陈 伟
(昆明理工大学 医学院, 云南 昆明 650500)
柯萨奇病毒B组5型(Coxsackie virus group B type 5,CVB5)属小RNA病毒科肠道病毒属,无包膜,基因组为单股正链RNA[1]。CVB5是引起手足口病(hand-foot-and-mouth disease,HFMD)的主要病原体之一,主要感染5岁以下婴幼儿,临床症状通常表现为发热,黏膜皮疹和疱疹等,病情严重者会导致无菌性脑膜炎和急性弛缓性麻痹等神经性并发症,乃至死亡。近年来,由CVB5感染导致的HFMD呈爆发流行趋势,对幼儿健康造成了严重威胁[2-4]。然而,目前尚无针对CVB5感染引起HFMD的有效治疗手段和预防措施。
长链非编码RNA(long non-coding RNAs,lncRNA)是转录本长度大于200个核苷酸且不具备蛋白编码功能的非编码RNA总称,具有导向、海绵、分子诱饵以及与蛋白质相互作用等多种生物学功能[5]。同时,越来越多的研究证明,lncRNA与病毒-宿主之间存在密切关系[6-7]。病毒感染宿主细胞后,可引起宿主编码lncRNA的差异表达,它们通过调控免疫信号通路、病毒基因组转录翻译和宿主细胞代谢产物等方式发挥了重要作用[8-9]。
LncRNA在肿瘤的研究中已有大量的报道应用,然而关于lncRNA与病毒-宿主相互作用机制研究尚处于起步阶段。因此,本研究通过分析CVB5感染人恶性胚胎横纹肌肉瘤细胞系RD(human malignant embryonic rhabdomyosarcoma cell line,RD),细胞中差异lncRNA表达谱,从而为深入研究lncRNA调控CVB5与宿主之间的相互作用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试剂:DMEM(Hyclone公司),RNAiso Plus、One Step PrimeScriptTMRT-PCR Kit(TaKaRa公司)。
1.1.2 细胞及病毒:人恶性胚胎横纹肌瘤肉瘤细胞系RD(中国科学院昆明细胞库)及CVB5病毒均由本实验室保存。RD细胞接种于含有10% FBS的DMEM完全培养基,37 ℃、5% CO2培养箱培养。
1.2 方法
1.2.1 样品制备:1×106个RD细胞铺于6孔板中,待细胞完全贴壁后,1×PBS缓冲液洗2次,换为含2% FBS的DMEM维持液,使用感染复数(multiplicity of infection,MOI)为1的CVB5感染RD细胞,在37 ℃、5% CO2培养箱中孵育24 h,倒置显微镜下观察RD细胞的细胞病变效应(cytopathic effects,CPEs)。
1.2.2 CVB5 TCID50的测定:取增殖状况良好的RD细胞,1×PBS洗涤2次,0.25%胰蛋白酶消化细胞。按每孔3×104个细胞加入96孔板中,每孔100 μL,于37 ℃、5% CO2培养箱培养过夜。第2天,用DMEM维持液将病毒液按10倍的梯度进行稀释,稀释至10-1~10-12,按每孔50 μL病毒液加入过夜培养的细胞中,每个稀释度4个复孔,同时设置空白对照。盖上盖子做好标记,37 ℃、5% CO2培养箱连续培养7 d,每天观察并记录CPE。第7天,统计病变情况并根据Reed Mench法计算病毒滴度。
1.2.3 RNA提取及转录组测序技术(RNA sequencing,RNA-seq):1MOI CVB5接种RD细胞24 h后,收集细胞,使用Trizol法提取总RNA。采用分光光度计Nanodrop检测总RNA浓度,琼脂糖凝胶电泳及Agilent 2100检测RNA完整性。采用RNA-Seq PE150策略进行lncRNA表达图谱分析(由北京诺和致源公司完成)。
测序完成后,获得CVB5感染RD细胞lncRNA表达图谱。随后,采用去除核糖体RNA的方法构建cDNA文库,Qubit2.0进行初步定量,Aglient2100对文库质量进行评估。以相对表达量变化倍数(fold change,FC)>2,P<0.05作为差异显著基因的筛选标准,筛选得到的差异mRNA和lncRNA进行数据分析。
同时,使用Cuffdiff和ClusterProfiler软件对差异lncRNA进行聚类分析、GO分析和KEGG富集等生物信息学分析。
1.2.4 RT-qPCR验证差异lncRNA的表达:对筛选得到的差异性显著lncRNA进行实时荧光定量(quantitative real-time PCR,RT-qPCR)验证,反应程序为:42 ℃,5 min反转录为cDNA;95 ℃预变性10 s;95 ℃变性5 s,60 ℃退火/延伸34 s,40个循环。使用2-△△Ct方法分析RNA的相对表达水平。引物名称及其序列(表1)。

表1 引物序列Table 1 Primer sequences
1.2.5 二级结构的预测:采用RNAfold软件对筛选的lncRNA二级结构进行预测,从而更好的预测lncRNA保守性及潜在结合区域。
1.3 统计学分析
2 结果
2.1 CVB5感染RD细胞模型建立
1MOI CVB5感染RD细胞0、6、12、24、48和60 h时,通过测定病毒TCID50(半数组织培养感染剂量,median tissue culture infective dose)可知,CVB5感染24 h时,TCID50值最高(图1A)。同时,CPE结果显示,与对照细胞相比,CVB5感染24 h后,细胞产生显著CPE(图1B)。
2.2 差异mRNA和lncRNA表达分析
与对照组相比,CVB5感染RD后,共获得4 860个差异表达的mRNAs(1 754个mRNAs上调表达和3 106个mRNAs下调表达)和1 268个lncRNAs(508个lncRNAs上调表达和760个lncRNA下调表达)(转录组数据库No.GSE180816)。表2显示了CVB5感染后RD细胞中20个上调和下调最显著的lncRNA。对所有差异mRNA和lncRNA聚类分析结果表明,与对照组相比,CVB5感染RD细胞后,宿主细胞中mRNA和lncRNA表达图谱均发生了显著变化(图2)。

A.RD cells were inoculated with the CVB5, and supernatant cultuers were collected at 6, 12, 24, 48 and 60 hours post-infection and virus titers were determined using TCID50; B.typical CPEs caused by RD infected with CVB5 were observed and photographed using inverted microscope at 24 hours post-infection
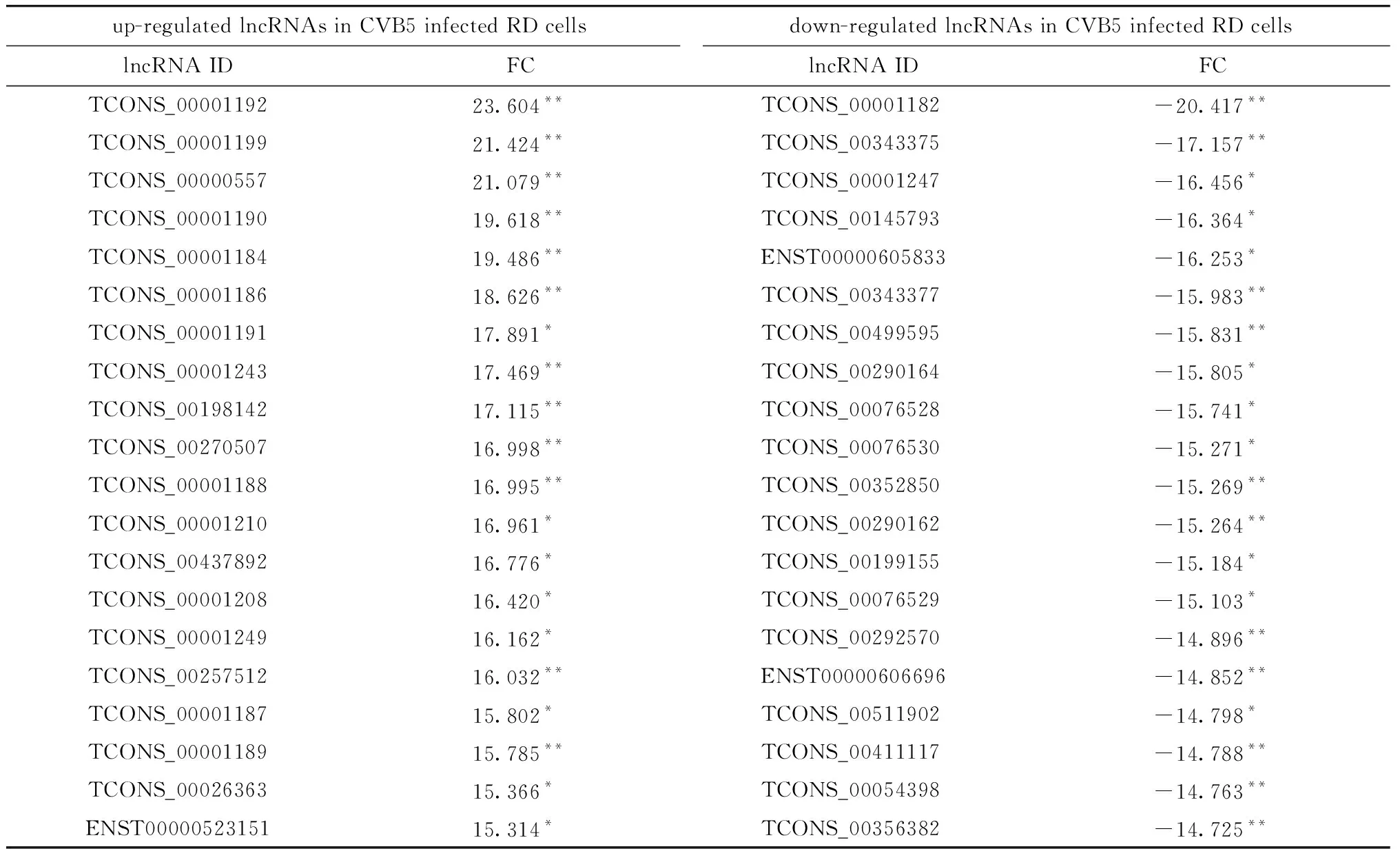
表2 CVB5感染的RD细胞中20个上调和20个下调最显著的lncRNATable 2 20 most significantly each up-regulated and down-regulated lncRNAs in CVB5 infected RD cells
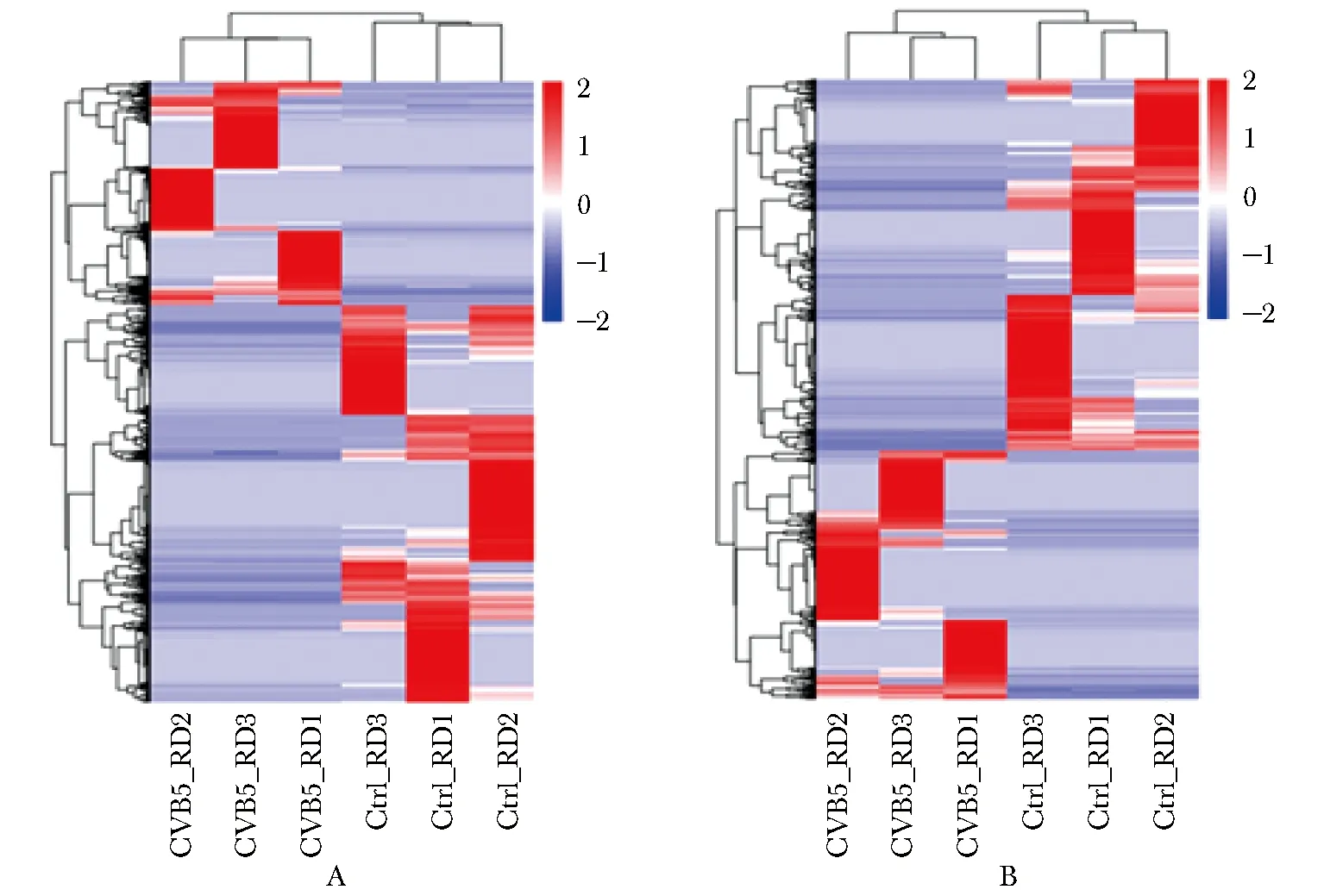
Compared with the control group, clustering profiles of mRNA (A) and lncRNA (B) expression in RD cells infected with CVB5; red represented genes with increased expression, and blue represented genes with decreased expression
2.3 LncRNA与mRNA特征比较
与mRNA相比,lncRNA转录本长度主要集中在5 kb以内,外显子个数小于10个,ORF长度小于300个核苷酸(图3)。
2.4 GO分析和KEGG通路富集预测lncRNA生物功能
与下游靶基因共表达的lncRNA主要富集在结构分子活性、细胞因子活性和嗅觉感受过程等20个显著富集的GO条目中(图4A);差异表达lncRNA靶基因主要参与嗅觉传导途径、细胞因子受体相互作用和神经活性配体受体相互作用等20条显著富集通路(图4B)。
2.5 RT-qPCR检测lncRNA表达水平
对随机选择的7个lncRNA进行验证,lncRNA表达水平与RNA-seq结果一致(图5)。
2.6 LncRNA二级结构预测
通过预测7个lncRNA的二级结构,鉴定了lncRNA的假结和茎环结构,标尺蓝色(0)至红色(1)表示碱基配对概率(图6)。
3 讨论
随着测序技术的不断发展,lncRNA在病毒与宿主相互作用中起着重要的作用。多种病毒感染宿主细胞后,可以引起宿主lncRNA的差异表达是一种普遍现象[10-11]。因此,研究lncRNA在病毒感染与复制中的作用机制,对病毒性疾病的诊断预防及治疗具有重要意义。对于同属且引起HFMD的重要病原体中, 在肠道病毒71(entero virus 71,EV71)感染RD细胞和小鼠骨骼肌中分别发现了23个和104个差异表达的lncRNA。进一步对差异lncRNA进行生物学功能和通路富集显示,lncRNA可能通过调节免疫应答,与蛋白质结合,生物代谢等途径参与EV71感染过程[12]。此外,有研究将柯萨奇病毒A16(Coxsackie virus A16,CVA16)感染RD细胞后鉴定出60个上调表达和1 210个下调表达的lncRNA。通过预测差异lncRNA的二级结构、修饰作用和顺反式功能等,初步阐明了病毒致病机制[13]。然而,关于CVB5感染后差异lncRNA表达情况及如何调控病毒与宿主相互作用尚未可知,仍需进一步验证。
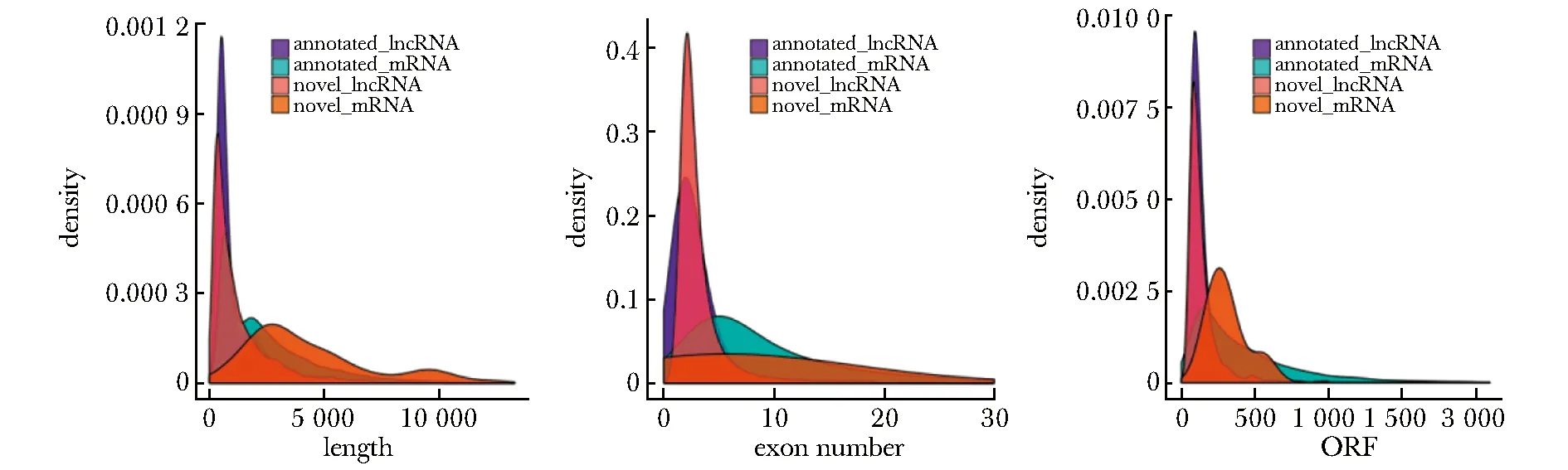
图3 LncRNA与mRNA特征比较Fig 3 Comparison of lncRNA and mRNA characteristics
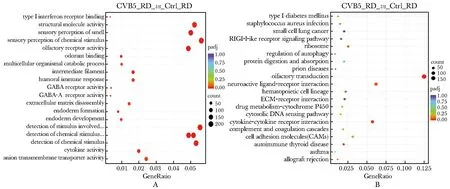
图4 GO和KEGG分析差异表达lncRNA高度富集基因的相关生物学途径Fig 4 Analyzing biological pathway that differentially expressed lncRNA highly enriched genes by GO and KEGG
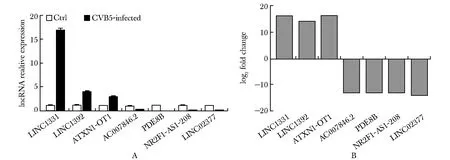
A.validation results of qPCR; B.primary results of RNA-seq图5 RT-qPCR验证RNA-seq结果Fig 5 Comparisons of RT-qPCR with RNA-seq results
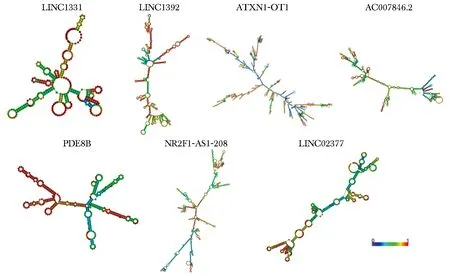
图6 利用RNAfold软件对lncRNA二级结构预测Fig 6 Secondary structures prediction of lncRNAs were performed using RNAfold software
本研究首先成功构建了CVB5感染RD细胞的模型,随后通过RNA-seq分析,获得了1 268个差异表达lncRNA,且在多种生物学过程被富集,包括分子结构活性、蛋白质分子结合和体液免疫反应等生物过程,其主要参与嗅觉传导途径、细胞因子受体相互作用和神经活性配体受体相互作用通路等过程。由于lncRNA具有较长的核苷酸序列,其复杂的二级结构通过与蛋白或核酸相互作用发挥多种功能,如在MALAT1中,高度保守的富含尿嘧啶的区域通过形成三重螺旋而有助于RNA稳定[14];LncRNA MEG3由于两个次级折叠基序的存在从而可发挥抑制肿瘤的功能[15]。因此,lncRNA的特定二级结构与其生物学功能具有重要关系。本研究挑选了经RT-qPCR验证正确的7个lncRNA二级结构进行了预测,结果表明lncRNA具有保守的二级结构,可能通过与蛋白质、DNA或RNA相互作用发挥生物学调控作用,但其编码能力有待进一步验证。
CVB5感染后可导致HFMD及中枢神经系统损失,严重者甚至死亡。然而关于CVB5感染复制的机制还有待进一步阐明。本研究旨在探索CVB5感染RD细胞后差异表达lncRNA表达谱变化以及对差异显著lncRNA的结构功能预测,从而为后续研究lncRNA如何调控病毒与宿主之间的相互作用奠定基础,同时为CVB5感染引起疾病的防治提供一种新思路。

