PATL2复合杂合变异致卵母细胞成熟障碍
霍明珠,张轶乐,徐家伟,史 昊,刘益栋,牛文彬
(郑州大学第一附属医院 生殖医学中心 河南省生殖与遗传重点实验室,河南 郑州 450052)
人类卵母细胞的发育开始于胚胎,然后停止于减数分裂前期的双线期和偶线期,这种停滞可长达几十年,此时期的卵母细胞称为生发泡(germinal vesicle, GV)[1],进入青春期后可在促黄体生成素峰的作用下恢复减数分裂。生发泡的破裂(germinal vesicle breakdown, GVBD)和第一极体的排出标志着卵母细胞核成熟[2],卵母细胞发育到减数第二次分裂中期停滞,受精后可继续完成减数第二次分裂。任何时期的改变都有可能导致卵母细胞成熟障碍以及胚胎发育异常或停滞。卵母细胞成熟障碍主要的临床表现是产生未成熟的卵子,并且体外不能培养成熟而导致原发性不孕[3]。卵母细胞成熟缺陷4型(OMIM:617743)是一种以卵母细胞成熟停滞为特征的不育症,卵母细胞可在生发泡期显示成熟停滞,也可在减数分裂中期Ⅰ(meiotic metaphase Ⅰ, MI)或者卵母细胞受精失败和早期胚胎停滞[4],其相关PATL2的突变是致病突变,但是目前关于PATL2遗传突变图谱尚不完全。本研究对1例原发不孕伴卵子成熟障碍患者进行全外显子测序,对其父母进行Sanger测序验证以及生物信息学分析探讨遗传学病因,为后续治疗提供遗传咨询。
1 材料与方法
1.1 材料
1.1.1 对象:患者,女,32岁。结婚9年,性生活正常,未避孕未孕9年,男方精液检查正常。患者无家族史。患者分别于2017、2018、2019年在郑州大学第一附属医院进行3次促排取卵,3次取卵情况总结(表1)。因卵子发育停滞在GV和MI时期,体外培养后仍不成熟,取消试管周期,显微镜下卵子形态(图1)。本研究通过郑州大学第一附属医院伦理委员会批准(批准号为KY-2021-0102),患者及家属签署相关知情同意书。
1.1.2 试剂:QIAamp DNA 纯化mini试剂盒(QIAGEN,51306);MGIEasy外显子组捕获V5探针试剂套盒(深圳华大基因股份有限公司,1000007746)。
1.2 方法
1.2.1 DNA的提取:采集患者及父母外周血样,采用QIAamp DNA 纯化mini试剂盒提取基因组DNA。
1.2.2 患者全外显子组的测序(whole exome sequencing, WES):采用MGIEasy外显子组捕获V5探针试剂套盒制备测序文库,首先将DNA 打断并制备杂交文库,然后通过外显子芯片对目标基因外显子及临近剪切区的 DNA 进行捕获和富集,对捕获文库进行扩增和纯化,最后使用 MGISEQ-2000 平台对文库进行高通量测序。
1.2.3 Sanger测序:根据WES结果对患者及父母进行Sanger测序验证,针对PATL2(NM_001145112)第14及13外显子,采用Primer3软件(Primer3webversio n4.1.0)设计引物。c.1 289_1 291delTCC的上游引物:5′-CAGTGTGCTGAGGAGGTCTG-3′, 下游引物: 5′-GACTGTCCCCCAACTTACCC-3′;c.1 374A>G的上游引物:5′-AGTGCCTCTTAAAGTGGGGTC-3′,下游引物: 5′-AGAAACCGAAACTCTAGGGCA-3′。
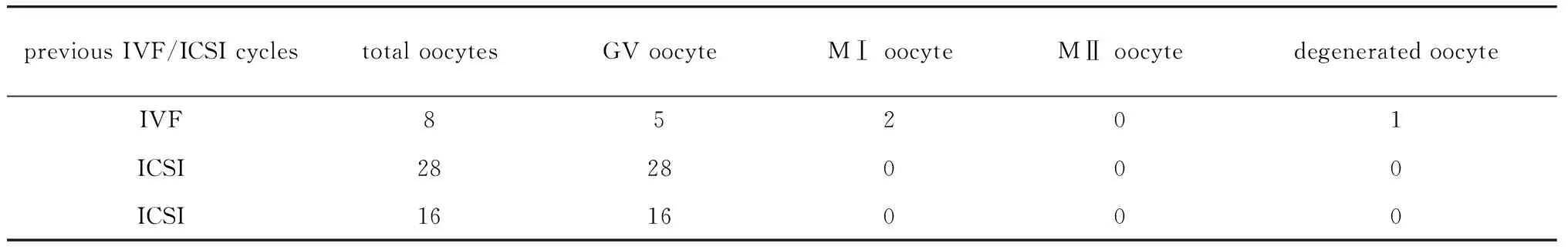
表1 患者取卵情况表Table 1 Oocyte extraction of the patient
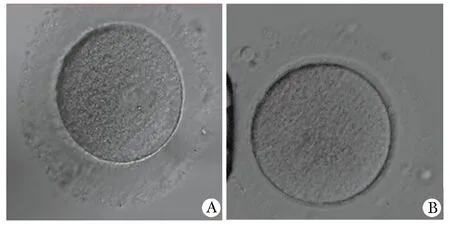
A.oocyte in germinal vesicle stage; B.oocyte in the first meiosis stage图1 光学显微镜下患者卵母细胞形态Fig 1 Morphology of patient’s oocytes under light microscope(×200)
1.2.4 变异位点生物信息学分析:应用SIFT、Polyphen及Mutation对变异位点进行蛋白功能预测,应用UniProt(https://www.uniprot.org/)获取PATL2的氨基酸序列,运用UCSF Chimera1.14软件在PATL2编码的蛋白质结构图上对c.1 374A>G(p.Ile458Met)变异位点标记以及位点变异后所致蛋白结构的变化图,并绘制PATL2c.1 289_1 291del TCC(p.Leu430del)位点在蛋白质中的位置。
2 结果
2.1 患者全外显子组测序结果
患者PATL2第14外显子存在c.1 374A>G(p.Ile458Met)的杂合变异,第13外显子上存在c.1 289_1 291delTCC(p.Leu430del)的缺失变异。HGMD对这两种变异位点暂无收录。根据美国遗传学与基因组学学会 (American College of Medical Genetics and Genomics, ACMG)指南,c.1 374A>G(p.Ile458Met)变异被判断为疑似致病变异(PM1+ PM2+ PP2+ PP4),c.1 289_1 291delTCC(p.Leu430del)变异(PM1+ PM2+ PM4+ PP4)同样被评为疑似致病变异。SIFT、Polyphen及Mutation预测其对蛋白功能影响,结果提示为有害变异(表2)。
2.2 Sanger测序结果
Sanger测序发现患者父亲存在与患者PATL2第14外显子上相同的杂合变异(c.1 374A>G),患者母亲存在与患者PATL2第13外显子上相同的缺失变异(c.1 289_1 291delTCC)(图2)。
2.3 变异位点生物信息学分析
PATL2第14外显子上c.1 374A>G(p.Ile458Met)变异,使第458位异亮氨酸变异为甲硫氨酸,并导致蛋白质结构发生变化(图3),PATL2第13外显子上c.1 289_1 291delTCC(p.Leu430del)的缺失变异使第430位亮氨酸缺失(图4),突变位点均位于PAT1结构域,所有的PATL1蛋白都有此结构域,其主要影响mRNA结合。
3 讨论
PATL2蛋白是一种mRNA结合蛋白,在未成熟卵母细胞中特异性表达,抑制细胞内转录后翻译过程;随着卵母细胞的成熟,PATL2的表达逐渐消失。在卵母细胞增殖过程中,卵母细胞中积累了大量增殖和成熟所需的稳定的mRNA。大多数合成的mRNA被立即翻译来支持卵母细胞的增殖和发育,但有30%的mRNA被储存起来,用于随后的翻译、恢复减数分裂,而PATL2被视为与其他mRNA结合蛋白如CPEB[cytoplasmic polyadenylation element(CPE)-binding protein]和Xp54作用相关,控制着mRNA的稳定性[5-6]。PATL2中的致病变异大多集中在PATL2蛋白的PAT1结构域(第252位至491位氨基酸),主要负责mRNA结合[7]。陈[8]等人对具有PATL2变异的原发不孕家系研究发现在卵母细胞成熟停滞患者中,PATL2变异使其蛋白表达减少,表明基因的表达水平对卵母细胞成熟有重要作用。
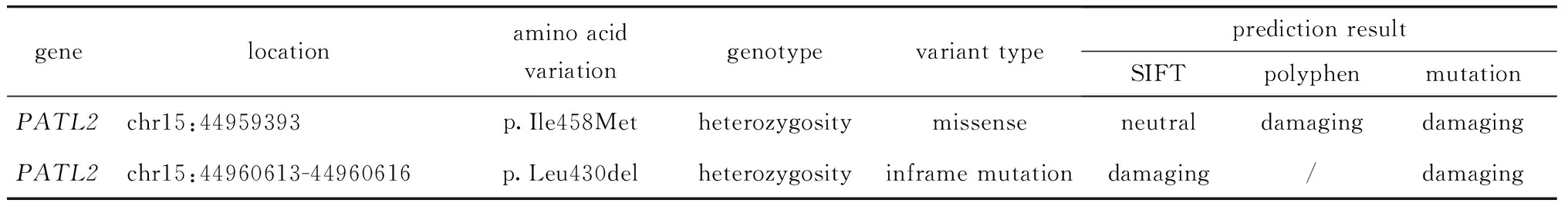
表2 PATL2位点变异预测表Table 2 Prediction of PATL2 locus variation

A,C.the patient and her father carried the mutation site of c.1 374A>G (p.Ile458Met);B,D.the patient and her mother carried the mutation site of c.1 289_1 291delTCC (p.Leu430del)
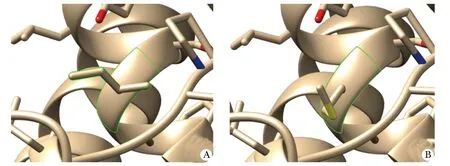
A.protein structure diagram without site mutation; B.protein structure diagram after mutation at this site c.1 374A>G(p.Ile458Met)

图4 变异位点在蛋白的位置Fig 4 Position of the mutation site in the protein
本例患者所取的卵母细胞均处于GV期或MI期,且在体外培养后仍不成熟,全外显子测序发现在第14和13外显子存在c.1 374A>G(p.Ile458Met)及c.1 289_1 291delTCC(p.Leu430del)的复合杂合变异,该变异位于PAT1结构域,使蛋白质结构发生改变,致PATL2功能的缺失。Marie Christou等[9]对PATL2缺陷的小鼠卵母细胞进行测序实验,发现与卵母细胞成熟相关基因表达显著下调。
卵母细胞成熟缺陷4型为常染色体隐性遗传,患者父母均具有生育力,至于PATL2变异可能只限于影响女性生育能力,因为存在具有PATL2截断变异的男性是具有生育能力的[4]。母亲的缺失变异虽然具有生育力,但母亲能把这种变异传递给子代,这也是具有卵母细胞GV阻滞的原发性不育女性中PATL2变异比例高的因素之一[10]。在非洲爪蟾卵母细胞中PATL2的过表达抑制了mRNA的翻译,导致卵母细胞成熟障碍,而在多个卵母细胞成熟障碍的患者中发现PATL2的表达降低,说明PATL2表达上调或者下调都不能促进卵母细胞的成熟[8, 11-12]。
对于卵母细胞成熟障碍的患者,研究发现[13]对于TRIP13双等位错义致病变异导致卵母细胞成熟障碍,通过将TRIP13 cRNA注射到卵母细胞中可以促进卵母细胞的成熟。对本例患者,能否采用cRNA注射到卵母细胞的方式来治疗由于[13]变异导致的卵母细胞成熟障碍需要进一步实验来验证,目前主要考虑供卵治疗。

