双锯鱼(Amphiprion)胚胎不同发育阶段和成鱼不同组织中内参基因的筛选及应用*
李迎娣 孙志宾 马爱军 杨敬昆 刘志峰 于 宏 赵亭亭 常浩文 朱理光 刘诗颖 曲江波
双锯鱼()胚胎不同发育阶段和成鱼不同组织中内参基因的筛选及应用*
李迎娣1, 2, 3, 4孙志宾2, 3, 4马爱军2, 3, 4①杨敬昆2, 3, 4刘志峰2, 3, 4于 宏2, 3, 4赵亭亭2, 3, 4常浩文2, 3, 4朱理光2, 3, 4刘诗颖2, 3, 4曲江波5
(1. 上海海洋大学水产与生命学院 上海 201306; 2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 山东青岛 266071; 3. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室 山东青岛 266237; 4. 中国-东盟海水养殖技术“一带一路”联合实验室 广东广州 510275; 5. 烟台开发区天源水产有限公司 山东烟台 264003)
双锯鱼()亦称为海葵鱼, 又称为小丑鱼, 是一类经济价值较高的海水观赏鱼。目前国内在双锯鱼的胚胎发育、人工饲养以及形态学观察等方面已经取得了有效成果, 但在分子生物学水平上对其基因表达的研究较少。为了筛选出适用于双锯鱼胚胎不同发育阶段以及成鱼组织的内参基因, 分析酪氨酸酶(TYR)基因的表达情况, 以眼斑双锯鱼()和白条双锯鱼()为材料, 利用实时定量聚合酶链式反应(qPCR)对、(甘油醛-3-磷酸脱氢酶基因)、(转录延伸因子基因)和(β-肌动蛋白基因)这4个候选内参基因的表达水平进行检测, 同时通过geNorm和Norm Finder软件对其稳定性进行评估, 最后以合适的内参基因作为参考, 研究TYR mRNA的表达水平。结果表明, 在双锯鱼胚胎的不同发育阶段,和的表达量相对于其他基因较为稳定; 在双锯鱼的不同组织中, 稳定性依次为>>>。以作为内参基因时分析发现TYR基因的表达在双锯鱼胚胎发育过程中呈先上升后下降的趋势, 在体节期表达量最高; 在双锯鱼各组织中均有表达, 且在眼、尾和红皮中表达量最高。
双锯鱼; 内参基因; TYR基因; qPCR; geNorm; Norm Finder
双锯鱼隶属于鲈形目(Perciformes)、雀鲷科(Pomacentridae)、双锯鱼属() (白海锋等, 2011)。其与海葵共生, 为海葵去除坏死组织, 海葵为其提供保护, 亦被称为海葵鱼(叶乐等, 2008)。双锯鱼体表都有一条或两条白色条纹, 神似戏剧中的丑角, 因此俗称“小丑鱼”。双锯鱼色彩绚丽、性情温和, 且经济价值高, 是海水观赏鱼的首选品种(章霞等, 2015; 张薇等, 2018)。国内在其人工繁育和饲养、形态学观察、性别分化等方面取得了较多成就, 如滕力平等(2005)对二线小丑鱼()的发育进行了生态学和形态学两方面的研究, 发现胚后仔、稚、幼鱼阶段的二线小丑鱼体表色素会逐渐增加并积累; Amonrat等(2013)用富含蛋白质、脂质和虾青素的饲料对眼斑双锯鱼进行投喂, 结果表明, 在一定范围内, 蛋白质含量较高的饲料更适合双锯鱼的生长, 而虾青素和脂质则有利于色素的积聚。但目前在分子水平上对双锯鱼体色相关基因表达模式的研究还比较匮乏。
TYR (酪氨酸酶, tyrosinase)基因参与生物体黑色素(melanin)的合成, 其表达量决定了生物的体色变化, 在鱼类的胚胎时期就已经开始表达(蒋燕玲, 2016)。通过实时定量PCR (quantitative real-time polymerase chain reaction, qPCR)技术对TYR的表达进行分析有助于了解基因的功能、阐明相关基因在胚胎发育和体色变异中的调控机制(杨爱馥等, 2010; Tang, 2017; 何丽斌等, 2018)。且生物体内mRNA水平的变化是生理变化的最早信号, 会因为处于不同的发育时期或实验条件的不同而表现出不同的浓度, 因此可以用来预测生物组织更高层次的变化(Franzellitti, 2015)。
内参基因(reference gene)又称管家基因(house-keeping gene), 其表达水平受环境因素影响较小, 在所有细胞中都能够相对稳定的表达, 不同实验条件下选用的内参基因有所不同(邓红平等, 2006; 刘颖等, 2013; Szczygieł, 2021)。常用的内参基因有基因、重组蛋白基因()、肌动蛋白基因()、甘油醛-3-磷酸脱氢酶基因()、转录延伸因子基因()、多聚泛素酶基因()、β-肌动蛋白基因()、α-微管蛋白基因()和β-微管蛋白基因() (蒋素华等, 2018)。内参基因在qPCR技术分析基因表达的过程中非常关键, 其稳定表达是目标基因表达数据标准化的先决条件, 可以作为数据分析的参考标准(Pfaffl, 2004; Mitter, 2009; 吴萍等, 2017)。研究表明, 在同一物种中, 即使内参基因在某一条件下能够相对稳定的表达(Mughal, 2018), 但不一定在所有实验条件下都适用, 因此在qPCR之前需要筛选出合适的内参基因(Dheda, 2005)。若内参基因有较大的表达误差, 实验结果中存在的干扰就会增加, 从而限制双锯鱼分子生物学方面的研究(Iwata, 2008; 吕梁等, 2019)。
目前对双锯鱼内参基因筛选的研究较少, 为了进一步探索TYR基因的表达机制, 本实验以白条双锯鱼和眼斑双锯鱼的组织及不同发育阶段的胚胎作为样品, 综合利用Norm Finder和geNorm软件对、、和这4个候选内参基因的稳定性进行分析, 并选出相对稳定的内参基因, 以TYR基因作为目的基因检测其表达规律, 为获得最优内参基因提供理论依据, 为双锯鱼相关基因的分析奠定应用基础。
1 材料与方法
1.1 实验材料
供试胚胎、组织均取自黄海水产研究所实验室内经驯化后的野生白条双锯鱼(番茄小丑鱼) ()和眼斑双锯鱼(公子小丑鱼) () (图1)。实验期间将双锯鱼成对饲养在养殖缸中, 即一对白条双锯鱼, 一对眼斑双锯鱼, 水温用加热棒维持在(27±1) °C, 盐度为30~35, 光照周期为14L : 10D, 每天在8:00和14:00投喂人工饵料。白条双锯鱼通常在12:00~13:00产卵, 孵化期为8~9 d; 眼斑双锯鱼通常在15:00~16:00产卵, 孵化期为9~10 d。分别取这两种双锯鱼的6个胚胎发育时期(25个胚胎/时期, 三个重复): 2 hpf (hours post fertilization, 受精后小时数) (卵裂期)、33 hpf (体节期, 出现黑色素细胞, 图 2)、57 hpf (翻转期)、81 hpf (血管形成期)、105 hpf (器官形成期)、225 hpf (孵化期) (图 3, 图 4)。取这两种双锯鱼的成鱼组织(三月龄, 三个重复): 心脏、脑、脾脏、眼、肠、鳃、白皮、红皮、肌肉、尾(图 5, 以眼斑双锯鱼为例)。将取得的胚胎和组织样品迅速浸泡在RNA保护液中, 然后储存在–80 °C冰箱中, 用于后续总RNA的提取。

图1 眼斑双锯鱼和白条双锯鱼外观
注: a、c: 眼斑双锯鱼; b、d: 白条双锯鱼
1.2 实验方法
1.2.1 总RNA的提取及cDNA的合成 根据总RNA提取试剂盒(TIANGEN)中的操作说明, 从胚胎和组织样品中提取总RNA。由于RNA易污染, 提取完成后迅速将其储存在–80 °C中。随后, 用1%的琼脂糖凝胶电泳检测总RNA的完整性, 并使用分光光度计(260 nm)检测总RNA的浓度和纯度(王玉成等, 2006)。取5 μL总RNA, 根据TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(TransGen, 北京)提供的说明书将mRNA反转录成cDNA, 然后用无菌去离子水稀释5倍(1︰5), 置于–20 °C中保存备用。

图2 两种双锯鱼体节期胚胎的黑色素细胞
注: a. 白条双锯鱼; b. 眼斑双锯鱼
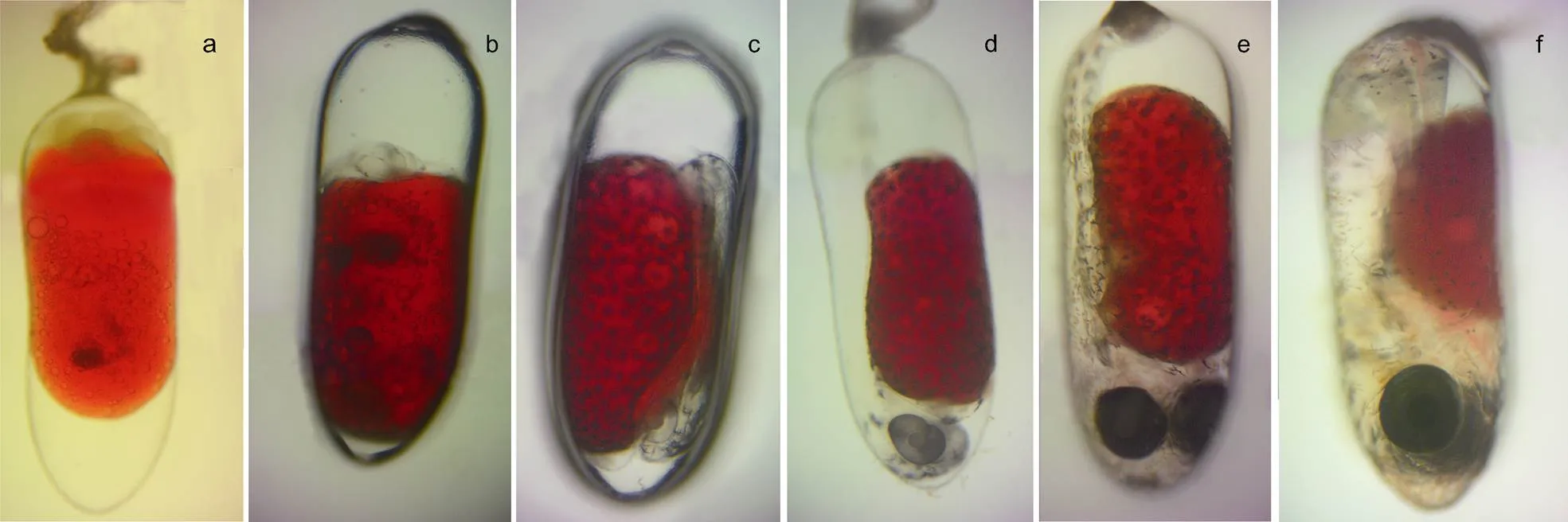
图3 白条双锯鱼胚胎不同发育时期
注: a. 卵裂期; b. 体节期; c. 翻转期; d. 血管形成期; e. 器官形成期; f. 孵化期
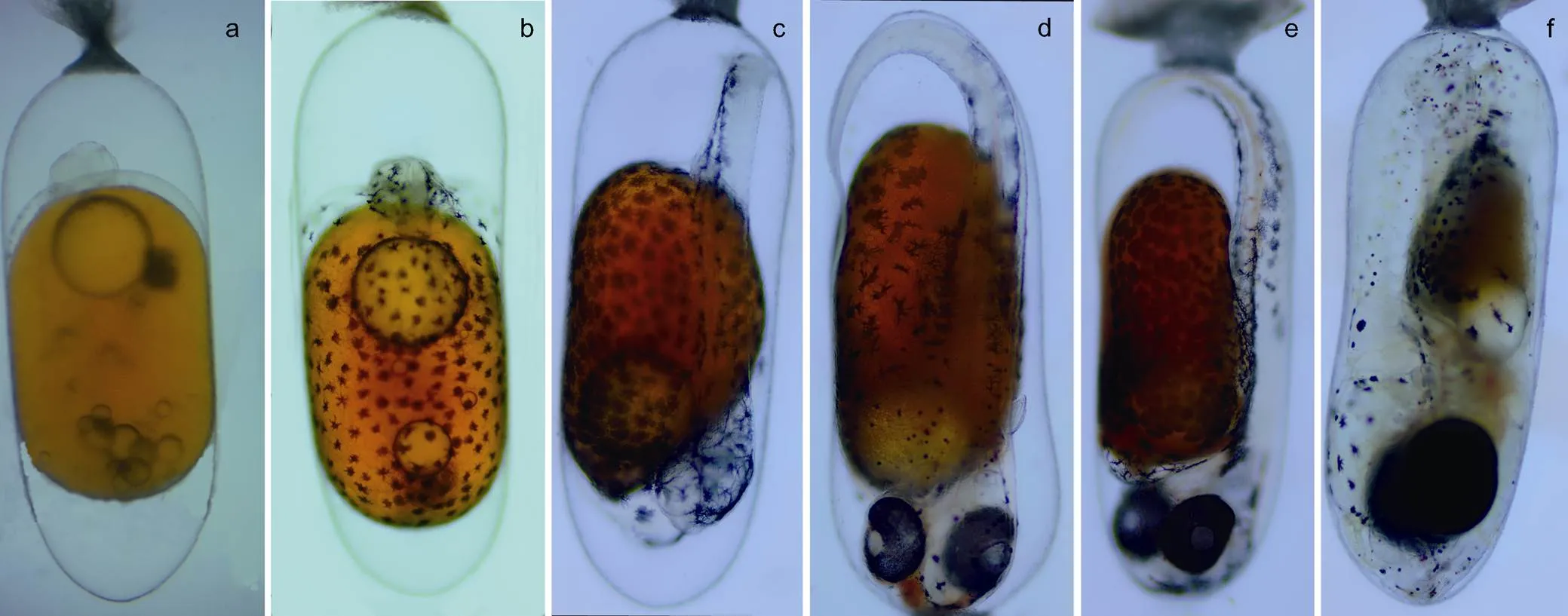
图4 眼斑双锯鱼胚胎不同发育时期
注: a. 卵裂期; b. 体节期; c. 翻转期; d. 血管形成期; e. 器官形成期; f. 孵化期

图5 成鱼组织(以眼斑双锯鱼为例)
注: a. 眼; b. 肌肉; c. 红皮; d. 尾; e. 鳃; f. 心; g. 肠; h. 白皮
1.2.2 引物设计 从NCBI (National Center for Biotechnology Information)数据库中获得候选内参基因的编码序列, 用Primer Premier 5.0设计出上、下游引物(表1)。
1.2.3 引物特异性检测 以双锯鱼组织样品逆转录得到的cDNA混合液为模板, 对这4个候选内参基因进行普通PCR反应, 检测引物的特异性。反应体系(20 μL)为: ddH2O 10 μL, 2×TSINGKE®Master Mix 7.4 μL, 上游引物0.8 μL, 下游引物0.8 μL, cDNA 1 μL。
PCR反应程序设置为: 94 °C预变性5 min; 94 °C变性30 s, 60 °C退火30 s, 72 °C延伸30 s, 35个循环; 72 °C延伸10 min。普通PCR扩增得到的产物用1%的琼脂糖凝胶电泳检测, 观察得到的条带是否单一。

表1 4个候选内参基因的相关信息及引物
1.2.4 qPCR试验以及数据分析 使用TOROGreen®qPCR Master Mix试剂盒进行qPCR, 反应用StepOnePlusTMReal-Time PCR System仪器完成, 每份样品重复三次。反应体系(20 μL)为: 2×TSINGKE®Master Mix 10 μL, ddH2O 6.4 μL, 上游引物0.8 μL, 下游引物0.8 μL, cDNA 2 μL。
qPCR反应程序设置为: 95 °C预变性1 min; 95 °C变性10 s, 60 °C退火30 s, 40个循环。
将qPCR得到的数据进行标准化处理, 然后运用geNorm和Norm Finder这两种软件对以上4个候选内参基因进行统计学分析, 从而筛选出在双锯鱼胚胎发育和不同组织中表达相对稳定的内参基因。
1.2.5 内参基因的应用 本研究选用作为内参基因, 对TYR基因的表达进行分析。TYR基因的NCBI序列号为XP_023132182.1, 利用Primer Premier 5.0设计得到正、反向引物, 与内参基因的引物一并交由上海生工生物工程有限公司合成。
正向引物: TGGTTCCCTTCTTCCCTCTC
反向引物: GGTTACGCTTCCACTTCCTTC
2 结果与分析
2.1 RNA的质量评估及普通PCR产物检测
利用分光光度计对提取的双锯鱼胚胎和成鱼组织样品的总RNA进行测定, 其中, OD260/280值为1.8~2.0, 浓度为340~590 ng/μL。数据表明样品的总RNA质量较好, 可以用于后续实验。
通过1%的琼脂糖凝胶电泳对普通PCR的产物进行检测, 这4个候选内参基因的引物与组织cDNA结合之后均得到一个单一的条带, 没有引物二聚体(图6)。
利用qPCR反应得到的这4个候选内参基因的熔解曲线, 均为单一峰且重复性好(图7), 进一步说明引物的特异性好。
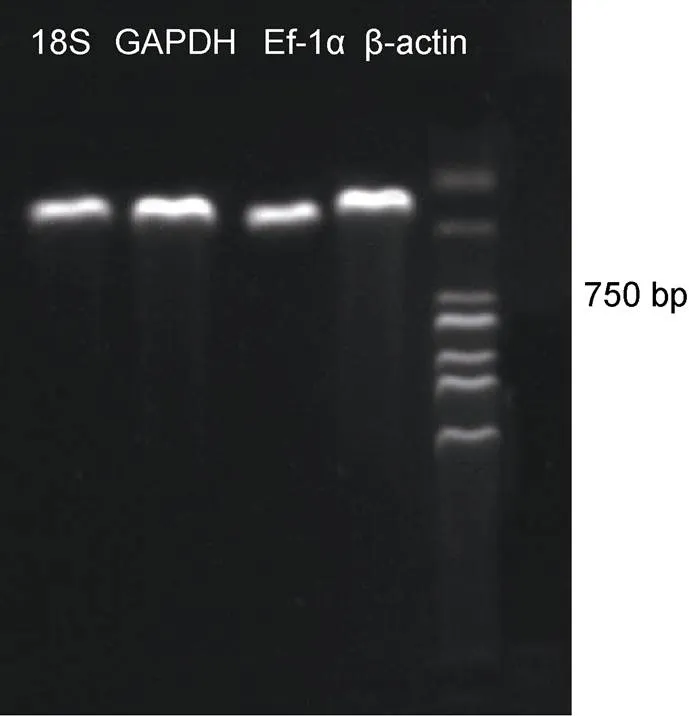
图6 候选内参基因PCR产物
2.2 4个候选内参基因稳定性分析
2.2.1 4个候选内参基因Ct值分析 利用qPCR反应对这4个候选内参基因进行扩增, 模板分别取自双锯鱼的胚胎和成鱼组织, 数据见表2, Ct值分布范围为13.67~36.71。其中, 最小的Ct值出现在基因的表达中, 表明其在胚胎和组织中的表达水平相对较高; 最大的Ct值出现在的表达中, 表明其表达水平较低, 分布范围为28.00~ 36.00 (图8)。
2.2.2 Norm Finder以及geNorm稳定性分析 向内参基因筛选软件中输入标准化后的定量数据, geNorm会得出相应的表达稳定值(值);值越小, 基因表达越稳定(吴建阳等, 2017); 还有配对变异分析V/V+1结果, 若V/V+1>0.15, 则表明适合内参基因的数量有+1个(胡金川, 2008)。Norm Finder会给出候选内参基因表达稳定值且得到一个最佳选择(滕彦娇等, 2021)。

图7 候选内参基因熔解曲线分析
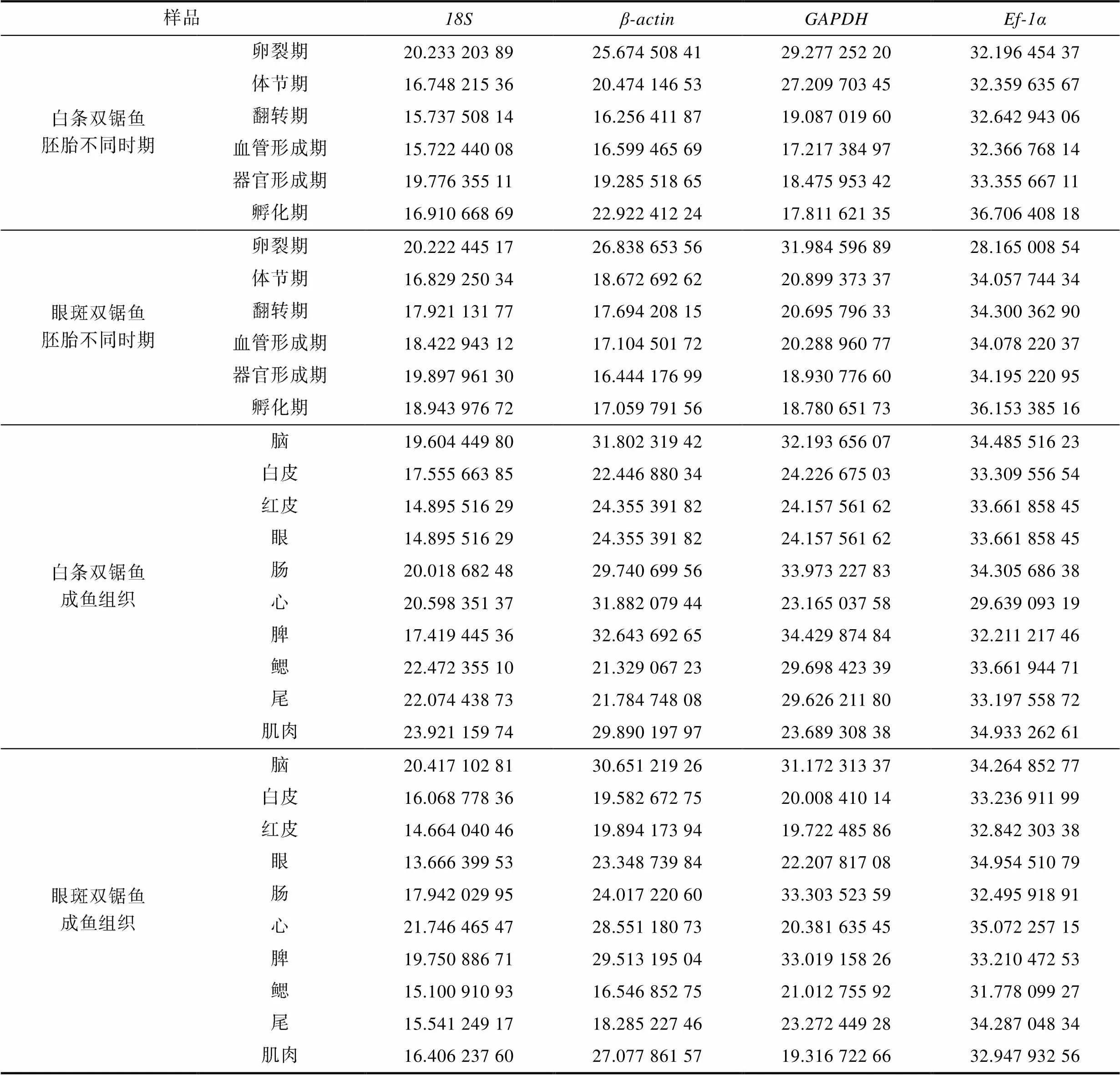
表2 双锯鱼胚胎不同发育时期以及成鱼组织中4个候选内参基因的Ct值

图8 双锯鱼胚胎不同发育时期以及成鱼组织中4个候选内参基因的Ct值分布
geNorm分析结果表明, 在眼斑双锯鱼和白条双锯鱼的胚胎中,和的值最小; 在眼斑双锯鱼和白条双锯鱼的成鱼组织中,、和的值最小(图9)。又因为配对变异分析结果2/3=0.904>0.15 (图10), 因此在眼斑双锯鱼和白条双锯鱼的成鱼组织、胚胎中, 适合的内参基因有3个, 即、和。
利用Norm Finder软件对标准化后的数据进行分析, 在白条双锯鱼和眼斑双锯鱼的胚胎、成鱼组织样品中, 候选内参基因的稳定性排序为>>>(稳定性值见表3), 这与geNorm分析结果相符, 表明和在这4个候选基因中较为稳定。
因此, 综合geNorm和NormFinder对候选内参基因稳定性的分析结果,和的表达相对稳定, 且的值最小, 更适合作为双锯鱼qPCR分析实验中的内参基因。
2.3 TYR基因表达分析
利用qPCR技术, 以作为内参基因检测TYR基因在白条双锯鱼和眼斑双锯鱼的胚胎及成鱼组织中的表达情况, 数据见表4。结果显示TYR基因在双锯鱼胚胎时期就已经开始表达, 表达水平呈先上升后下降的趋势, 在体节期达到最高。且在胚胎观察过程中发现, 黑色素细胞亦出现在白条双锯鱼和眼斑双锯鱼的体节期(参考图3, 图4); 在白条双锯鱼和眼斑双锯鱼成鱼的眼、红皮以及尾中表达量相对较高(图11)。
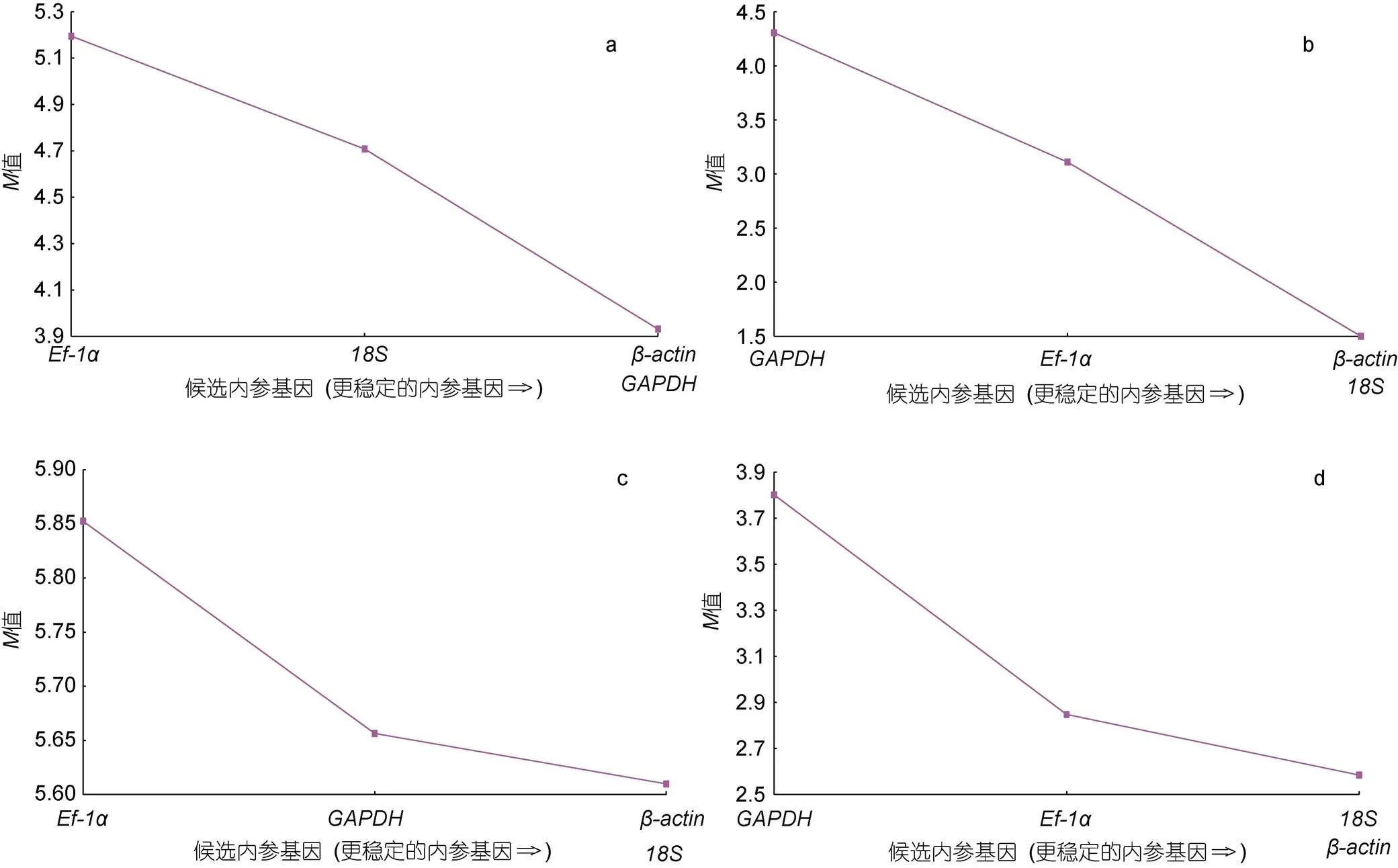
图9 4个候选参考基因的平均表达稳定值
注: a. 眼斑双锯鱼成鱼组织; b. 眼斑双锯鱼胚胎不同发育时期; c. 白条双锯鱼成鱼组织; d. 白条双锯鱼胚胎不同发育时期
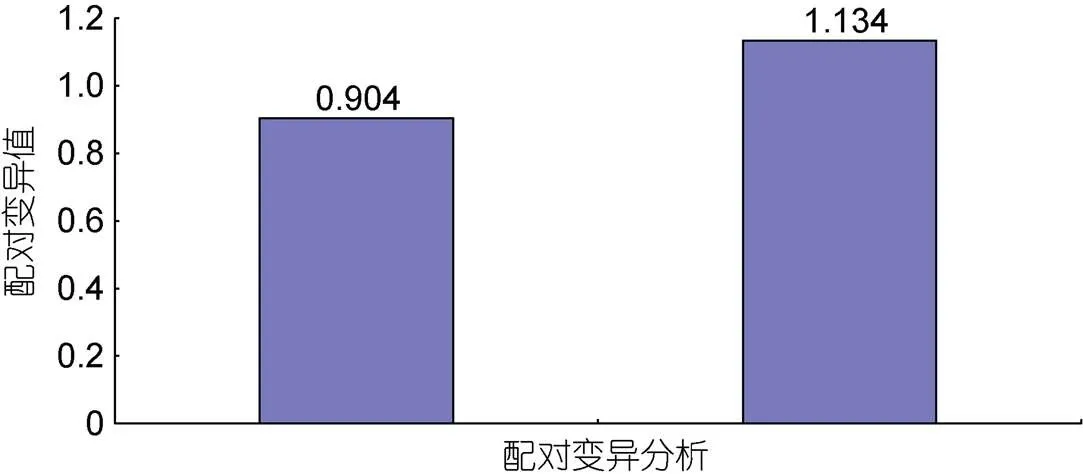
图10 标准化控制基因数量的确定
3 讨论
实时定量PCR (qPCR)是目标基因准确表达的首选工具, 内参基因则是qPCR数据分析的参考标准, 但不是所有内参基因在实验中都能够稳定表达(Vandesompele, 2002)。因此, 在进行qPCR之前需要根据样品和实验条件选择合适的内参基因。geNorm和Norm Finder软件是专门用来筛选内参基因的, 但分析结果略有不同。其中, Norm Finder是根据内参基因的稳定值大小对其进行排序, 并得到每个实验条件下最稳定的内参基因; geNorm则是可以得出适合实验的最佳内参基因组合(吴建阳等, 2017)。
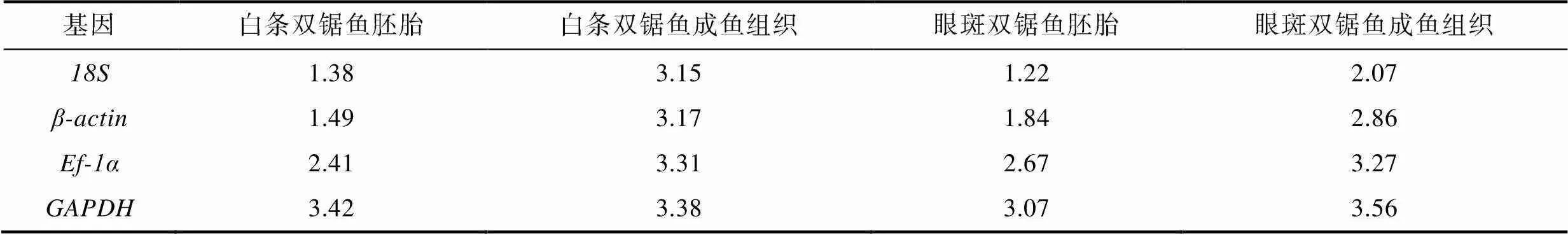
表3 利用Norm Finder程序获得的M值
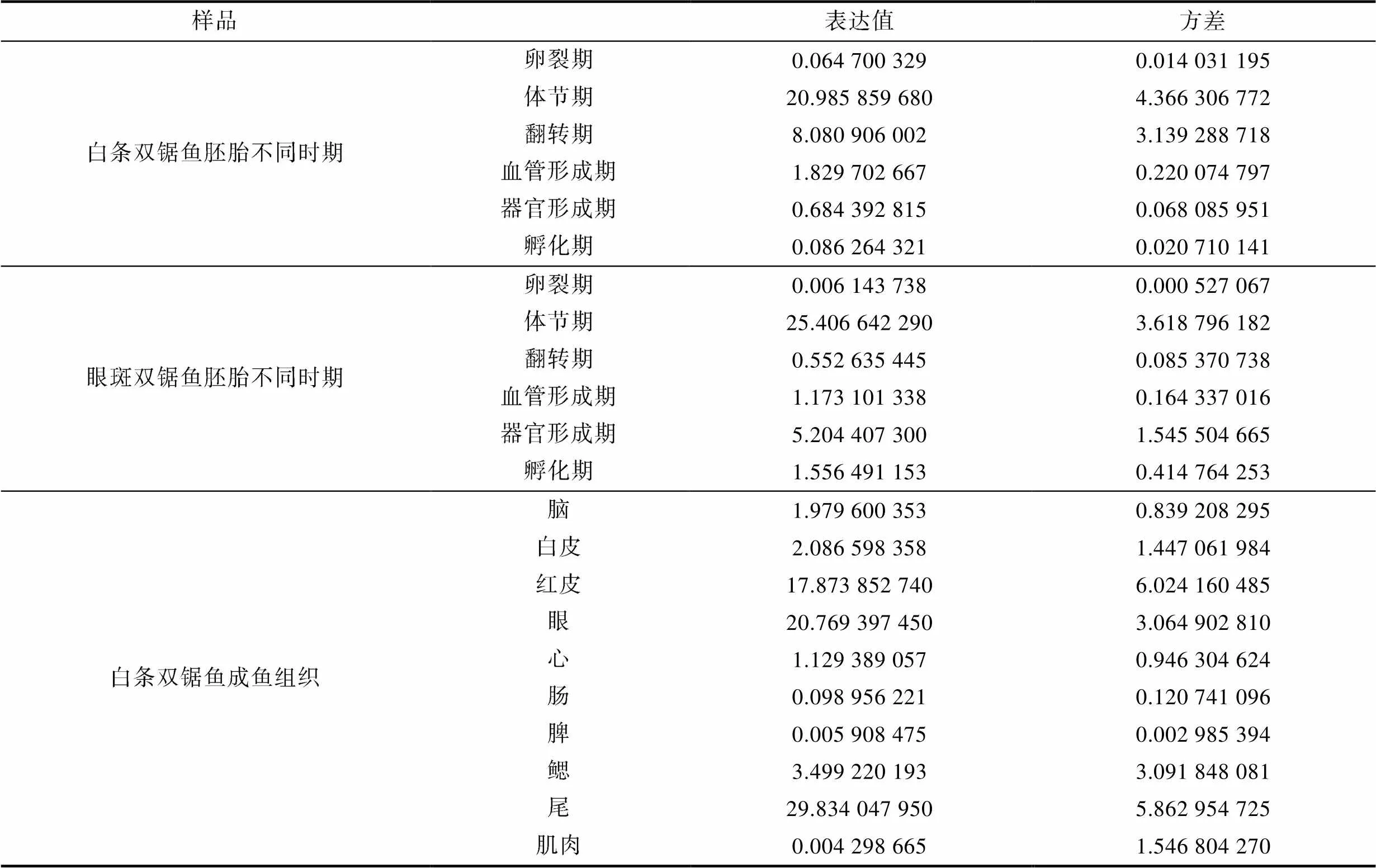
表4 TYR基因在白条双锯鱼和眼斑双锯鱼的胚胎及成鱼组织中的表达
续表
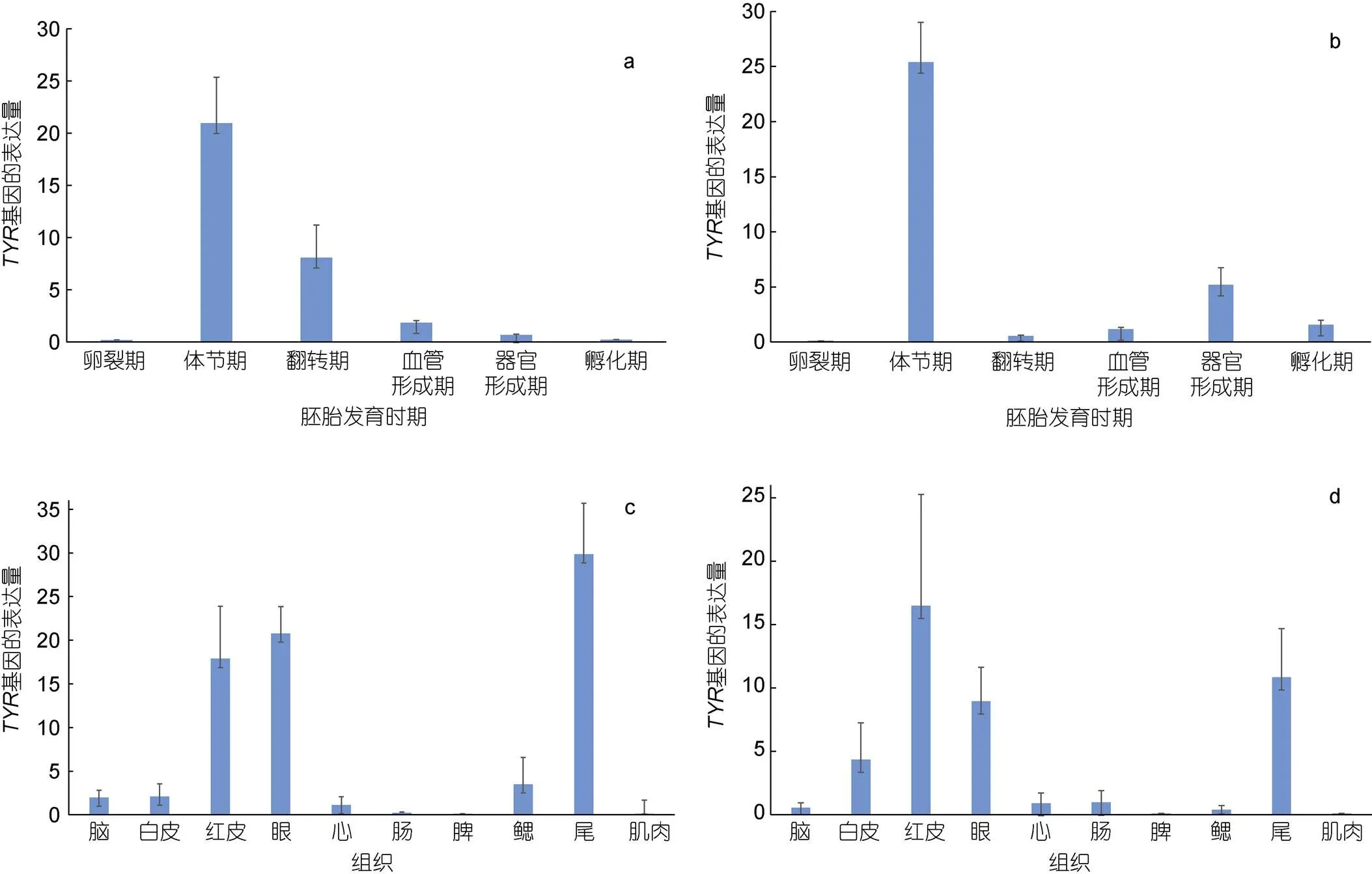
图11 TYR基因在白条双锯鱼和眼斑双锯鱼的胚胎及成鱼组织中的表达
注: a. 白条双锯鱼胚胎不同发育时期; b. 眼斑双锯鱼胚胎不同发育时期; c. 白条双锯鱼成鱼组织; d. 眼斑双锯鱼成鱼组织
用于鱼类胚胎不同发育阶段以及不同组织研究的内参基因种类很多, 常见的有基因, 在真核生物中参与蛋白质的翻译, 是总蛋白含量的1%~2% (唐永凯等, 2008);是一类编码核糖体小亚基的rRNA (周晓馥等, 2016);基因参与糖降解反应(Pei, 2007);基因是肌肉及细胞骨架的主要成分, 广泛分布于各组织中(唐永凯等, 2013)。更多的研究为了真实地反映目标基因的表达水平, 会筛选出两个或两个以上的内参基因作为数据分析过程中的参考, 如张宁等(2018)通过实验选择了和作为多鳞鱚研究中的内参基因; 在对不同处理条件下的异育银鲫()组织和尾鳍细胞的研究中, 实验结果表明可以作为肾脏组织和细胞研究的适合内参基因, 而适合在病毒刺激下作为数据分析的内参基因(费越越等, 2020); 茅华华等(2016)对斑鳢()的胚胎不同时期和成鱼组织进行分析, 结果得出和适合作为组织相关基因表达分析的内参基因, 而和可以作为胚胎相关研究的内参基因。
目前, 关于双锯鱼的研究多倾向于胚胎发育和饲养、繁殖, 而对内参基因筛选的研究少之又少。本研究通过geNorm和Norm Finder软件对、、和的稳定性进行分析, 最终选择作为双锯鱼基因表达研究的合适内参基因。这与陈张帆等(2018)在牙鲆胚胎中的筛选结果相似。TYR是黑色素合成的关键酶, TYR基因的表达决定了生物体色的变化程度(张植元等, 2017)。结果表明, 在双锯鱼胚胎发育过程中就已经出现了黑色素细胞(图2), 即TYR基因开始表达, 在体节期表达量最高; 在成鱼的眼、尾和红皮中表达量最高。只有筛选出合适的内参基因, qPCR技术在目标基因的研究中才能发挥重要作用, 否则就会出现一定的误差(吕梁等, 2019)。旨在为后期研究双锯鱼相关基因的表达机制提供应用基础, 使数据分析结果更有效、可靠。
4 结论
为了筛选出合适的内参基因, 本实验以眼斑双锯鱼和白条双锯鱼的胚胎、组织为研究对象, 对、、和的表达稳定性进行分析, 虽然geNorm和Norm Finder显示的结果略有不同, 但相对于其他内参基因稳定值更高, 并选其作为TYR基因相对定量数据分析的参考标准, 以期为研究双锯鱼胚胎、个体发育过程中基因的表达水平提供有效的数据和应用基础。
王玉成, 张国栋, 姜静, 2006. 一种适用范围广的总RNA提取方法[J]. 植物研究, 26(1): 84-87.
邓红平, 何继亮, 2006. 几种管家基因突变试验及其研究进展[J].中华劳动卫生职业病杂志, 24(11): 702-704.
叶乐, 王雨, 杨其彬, 等, 2008. 小丑鱼规模化繁育技术研究[J]. 中国水产(12): 59-60.
白海锋, 李晓光, 张霖, 等, 2011. 八种小丑鱼与五种海葵相容性的初步研究[J]. 水产养殖, 32(11): 11-13.
吕梁, 张子平, 万海付, 等, 2019. 拟穴青蟹不同发育时期胚胎基因表达的内参基因的筛选[J]. 中国水产科学, 26(3): 457-464.
刘颖, 王双耀, 高乔, 等, 2013. 栉孔扇贝内参基因稳定性研究[J]. 生态毒理学报, 8(4): 616-622.
杨爱馥, 周遵春, 董颖, 等, 2010. 仿刺参和基因表达稳定性比较[J]. 中国农业科技导报, 12(1): 79-84.
吴建阳, 何冰, 杜玉洁, 等, 2017. 利用geNorm、NormFinder和BestKeeper软件进行内参基因稳定性分析的方法[J]. 现代农业科技(5): 278-281.
吴萍, 张方亮, 杨程涌, 等, 2017. 翘嘴鳜1 mRNA表达量分析中采用的内参基因稳定性比较[J]. 激光生物学报, 26(4): 379-384.
何丽斌, 陈芳, 朱志煌, 等, 2018. 基于线粒体16S、1和基因探讨11种小丑鱼的系统发育关系[J]. 福建农业学报, 33(3): 230-235.
张宁, 杜文文, 王中铎, 等, 2018. 多鳞鱚不同组织荧光定量PCR内参基因筛选[J]. 广东海洋大学学报, 38(5): 8-14.
张植元, 魏东, 乔秀亭, 等, 2017. 饲料浮萍水平对大正三色锦鲤TYR及MC1R基因表达的影响[J]. 水产科学, 36(2): 172-177.
张薇, 孙志宾, 马爱军, 等, 2018. 双锯鱼属()四种鱼种比较胚胎学研究和进化探讨[J]. 海洋与湖沼, 49(3): 671-681.
陈张帆, 宋莉妮, 王鹏飞, 等, 2018. 牙鲆胚胎低温处理下内参基因筛选及和基因表达分析[J]. 农业生物技术学报, 26(8): 1382-1391.
茅华华, 陈昆慈, 赵建, 等, 2016. 斑鳢实时定量PCR内参基因的分离鉴定[C]. // 2016年中国水产学会学术年会论文摘要集. 成都: 中国水产学会.
周晓馥, 王晶, 史宏伟, 等, 2016. 18S rRNA作为植物实时荧光定量PCR内参基因的探究[J]. 吉林师范大学学报(自然科学版), 37(2): 115-119.
胡金川, 2008. 如何利用geNorm软件筛选基因表达测定的内参基因? [J]. 中华检验医学杂志, 31(8): 918.
费越越, 南星羽, 余路, 等, 2020. 异育银鲫内参基因的筛选[J]. 水产科学, 39(3): 306-315.
唐永凯, 李建林, 李红霞, 等, 2008. 奥利亚罗非鱼-1基因的克隆与结构分析[J]. 动物学杂志, 43(5): 7-12.
唐永凯, 俞菊华, 徐跑, 等, 2013. 建鲤内参基因的实时荧光定量PCR方法的建立[J]. 浙江农业学报, 25(1): 31-36.
章霞, 李伟业, 傅荣兵, 等, 2015. 观赏小丑鱼人工繁育技术的研究[J]. 科学养鱼(8): 78.
蒋素华, 马杰, 梁芳, 等, 2018. 一个白及内参基因EF1α及其应用: CN109022448A [P]. [2018-12-18].
蒋燕玲, 2016. 橘色双冠丽鱼体色发育变化及体色相关基因TYR的克隆与表达研究[D]. 上海: 上海海洋大学.
滕力平, 杨担光, 李晓光, 等, 2005. 二线小丑鱼的人工繁殖[J].水产科学, 24(2): 26-28.
滕彦娇, 王宏鹏, 王菁, 等, 2021. 大花红景天内参基因筛选与POD基因表达分析[J]. 中药材, 44(6): 1341-1347.
AMONRAT K, RAWIWAN W, VORATHEP M,, 2013. Effects of dietary protein, lipid and astaxanthin levels on growth and carotenoid accumulation in anemone fish,[J]. Journal of Science, Technology, and Humanities, 11(2): 95-103.
DHEDA K, HUGGETT J F, CHANG J S,, 2005. The implications of using an inappropriate reference gene for real-time reverse transcription PCR data normalization [J]. Analytical Biochemistry, 344(1): 141-143.
FRANZELLITTI S, KIWAN A, VALBONESI P,, 2015. Selection of best-performing reference gene products for investigating transcriptional regulation across silvering in the European eel () [J]. Scientific Reports, 5(1): 16966.
IWATA E, NAGAI Y, HYOUDOU M,, 2008. Social environment and sex differentiation in the false clown anemonefish,[J]. Zoological Science, 25(2): 123-128.
MITTER K, KOTOULAS G, MAGOULAs A,, 2009. Evaluation of housekeeping genes for quantitative expression studies in the European seabass[C]. // Proceedings of the 9th Symposium on Oceanography & Fisheries, 2nd: 1178-1182.
MUGHAL B B, LEEMANS M, SPIRHANZLOVA P,, 2018. Reference gene identification and validation for quantitative real-time PCR studies in developing[J]. Scientific Reports, 8(1): 496.
PEI D S, SUN Y H, CHEN S P,, 2007. Zebrafish GAPDH can be used as a reference gene for expression analysis in cross-subfamily cloned embryos [J]. Analytical Biochemistry, 363(2): 291-293.
PFAFFL M W, TICHOPAD A, PRGOMET C,, 2004. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper- excel-based tool using pair-wise correlations [J]. Biotechnology Letters, 26(6): 509-515.
SZCZYGIEŁ J, KAMIŃSKA-GIBAS T, PETIT J,, 2021. Re-evaluation of common carp (L.) housekeeping genes for gene expression studies - considering duplicated genes [J]. Fish & Shellfish Immunology, 115: 58-69.
TANG X, ZHANG N, SI H J,, 2017. Selection and validation of reference genes for RT-qPCR analysis in potato under abiotic stress [J]. Plant Methods, 13: 85.
VANDESOMPELE J, DE PRETER K, PATTYN F,, 2002. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes [J]. Genome Biology, 3(7): RESEARCH0034.
SCREENING AND APPLICATION OF REFERENCE GENE IN ANEMONE FISH () EMBRYOS IN DIFFERENT DEVELOPMENT STAGES AND ADULT TISSUES
LI Ying-Di1, 2, 3, 4, SUN Zhi-Bin2, 3, 4, MA Ai-Jun2, 3, 4, YANG Jing-Kun2, 3, 4, LIU Zhi-Feng2, 3, 4, YU Hong2, 3, 4, ZHAO Ting-Ting2, 3, 4, CHANG Hao-Wen2, 3, 4, ZHU Li-Guang2, 3, 4, LIU Shi-Ying2, 3, 4, QU Jiang-Bo5
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Qingdao 266071, China; 3. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 4. China-ASEAN Belt and Road Joint Laboratory on Marine Aquaculture Technology, Guangzhou 510275, China; 5. Yantai Tianyuan Aquatic Co. Ltd., Yantai 264003, China)
Anemone fish (), or known as clownfish, is a class of economically valuable seawater ornamental fish. Outstanding results have been achieved in the embryo development, artificial breeding, and morphological observation of anemone fish, but few studies are made on its gene expression at molecular biological level. To screen out the reference genes that are suitable for different development stages of anemone fish embryos and the adult fish tissues and to analyze the expression of tyrosinase (TYR) genes, we conducted this experiment using Fales-Clown anemone fish () and tomato clownfish () as the materials, for which quantitative real-time polymerase chain reaction (qPCR) was applied to determine the expression levels of four candidate reference genes:gene,,and. Meanwhile, the stability of these four candidate reference genes is evaluated with software geNorm and Norm Finder. Finally, an appropriate reference gene was used to study the expression level of TYR mRNA. Results show that the expression ofandn was relatively stable in anemone fish embryos at different development stages. In different tissues of anemone fish,was the most stable. Whenwas used as the reference gene, the expression of TYR gene was first increased and then decreased during the development of anemone fish embryos and the highest expression level was found at the body segmentation stage. The TYR gene was expressed in all tissues and the expression level peaked in eye, tail, and red skin. A reference gene suitable for the anemone fish was selected and applied to analyze the expression of TYR gene in different stages of embryo and adult tissues.
anemone fish; reference gene; TYR gene; qPCR; geNorm; Norm Finder
Q954; S965
10.11693/hyhz20210800196
*“一带一路”沿线热带国家水产养殖科技创新合作项目, 2018~2020; 中国东盟海上合作基金项目, 2016~2020; 中国水产科学研究院基本科研业务费项目, 2020TD25号; 青岛海洋科学与技术试点国家实验室“鳌山人才”培养计划项目, 2017ASTCP-OS04号。李迎娣, 硕士研究生, E-mail: 1721775977@qq.com; 同等贡献第一作者: 孙志宾, E-mail: sunzb@ysfri.ac.cn
马爱军, 博士, 研究员, 博士生导师, E-mail: maaj@ysfri.ac.cn
2021-08-31,
2021-10-06

