miR-203a-3p对胰腺癌细胞系Panc-1生长增殖、迁移侵袭的促进作用
马瑞雪 卢鸿健 杨晨 丛薇 王源 章广玲 张荣花
1华北理工大学临床医学院(河北省医工融合精准医疗重点实验室) 河北唐山 063000;2华北理工大学基础医学院(河北省慢性疾病基础医学重点实验室)
胰腺癌(Pancreatic cancer,PC)是目前最常见的人类致命性、恶性肿瘤之一,属于常见的消化道肿瘤[1]。尽管近年来包括化疗、放疗和分子治疗在内的治疗方法越来越多,但胰腺癌患者的总体5年生存率仍低于7%。大多数胰腺癌患者确诊时已为晚期阶段,处于外科手术切除标准之外[2],患者治愈的机会较小,预后不良。在过去的几十年中,已明确了几个与胰腺癌肿瘤发生相关的危险因素,但在胰腺癌进展的分子机制方面进展甚微,缺乏高敏感性、高特异性的生物标记物,亟需开发新的特异性标记物为临床诊断和治疗提供参考。
miRNAs参与人体细胞生命进程的许多重要环节,是真核生物中一种基因长度大约为20bp的非编码小RNA,与癌症的发生和进展均有关。成熟的miRNAs可通过碱基互补配对靶向相关mRNA的3'-未翻译区域(UTR)抑制靶基因的转录从而有效地负性调控其靶基因表达[3]。miRNAs涉及多个肿瘤进程,例如恶性肿瘤细胞的凋亡、增殖、转移、分化等,在过去十年中,miRNA在致癌过程中的失调已被广泛研究,其参与各种类型癌症的进展,例如急性淋巴细胞白血病[4]、口腔鳞状细胞癌[5]、胰腺癌[6]。有研究在BRL-3A肝癌细胞中,miR-203a-3p激活PI3K/Akt信号传导通路,从而提高肝癌细胞的增殖能力[7]。Chen L等研究发现miR-203a-3p可促进结直肠癌的增殖、集落形成、迁移和侵袭[8]。但是miR-203a-3p在胰腺癌中的作用及其机制尚未见报道。本文将讨论miR-203a-3p对Panc-1生长增殖、克隆形成和迁移侵袭的影响,为胰腺癌的临床治疗提供参考。
1 材料与方法
1.1材料
1.1.1细胞系 实验所用的胰腺癌细胞系Aspc-1、Panc-1和人胰腺导管上皮细胞(HPNE)购自上海富衡生物技术公司。
1.1.2主要试剂 CCK-8试剂产品购自北京庄盟生物基因公司;SYBR Premix EX Taq试剂盒购自北京聚合美生物技术公司;miR-203a-3p inhibitor、miR-203a-3p mimics、NC inhibitor、NC mimics、miRNA逆转录试剂盒均购于上海吉玛生物技术有限公司。
1.2研究方法
1.2.1qRT-PCR检测miR-203a-3p的表达水平 胰腺癌细胞Aspc-1、Panc-1和HPNE分别培养于含有10% FBS和1%青链霉素双抗的RPM-1640培养基中。qRT-PCR测定Aspc-1、Panc-1和HPNE中miR-203a-3p的表达水平,将对数生长期的细胞以5×104/孔的方式接种于6孔板。根据试剂盒说明,按照标准TRIzol法提取细胞的总RNA。然后以提取出的总RNA作为模板,利用miRNA第一链cDNA合成试剂盒(上海吉玛公司),将总RNA反转录为cDNA。以内参基因U6作为阳性对照基因校正PCR模板的拷贝数,U6上下游引物和miR-203a-3p上下游引物序列分别如下:U6 snRNA-FO:5’-CGCTTCGGCAGCACATATAC -3’,U6 snRNA-RE:5’-TTCACGAATTTGCGTGTCATC -3’;miR-203a-3p-FO:5’-CCGCTCGTGAAA TGTTTAGG -3’,miR-203a-3p-RE:5’-CAGAGCAGGGTCCGAGGTA -3’。各实验至少重复3次,实验组与对照组的基因相对表达量以2-△△Ct计算。
1.2.2CCK-8检测细胞的增殖能力 将Panc-1细胞接种到96孔培养板,3×103/孔。为阐明miRNA-203a-3p在胰腺癌发展中的生物学功能,将模拟物miR-203a-3p mimics、抑制剂miR-203a-3p inhibitor及其对照NC mimics、NC inhibitor分别对Panc-1细胞进行转染。实验分为NC mimics组、miR-203a-3p mimics组、NC inhibitor组、miR-203a-3p inhibitor组,转染后0、24、48、72h时向各孔中缓慢滴加10μL CCK-8试剂以测定细胞增殖,37℃细胞培养箱中孵育2~4h后测量吸光度值(即OD值),OD值于酶标仪在450nm波长下测量所得。每组实验至少重复3次,计算各组细胞吸光度值的平均值和标准差,绘制折线图。
1.2.3集落形成实验检测细胞的集落形成能力 胰腺癌Panc-1细胞中转染模拟物miR-203a-3p mimics或抑制剂miR-203a-3p inhibitor及其对照,将过表达或miR-203a-3p表达受到抑制的Panc-1细胞培养48h后接种至6孔板中,1×103个细胞/孔。按时更换新鲜培养液, 2~3次/d,并生长2周;然后,用磷酸盐缓冲盐水(PBS)洗涤细胞两次,并用结晶紫进行染色。在显微镜下计数10个随机视野中的菌落数,并计算每个视野平均菌落数(选取细胞数≥50个的集落作为计数对象),实验重复3次。计算分析集落数量平均值和标准差并绘制柱状图。
1.2.4Transwell小室检测迁移细胞数和侵袭细胞数 通过无基质凝胶或有基质凝胶的Transwell小室检测细胞的迁移和侵袭。迁移实验Transwell小室基底膜不铺Matrigel 基质胶,将miR-203a-3p mimics和inhibitor转染到胰腺癌细胞系Panc-1中48h后,细胞孵育于100μl体积的血清游离培养基中,置于Transwell上室,下室培养基为20%胎牛血清,2×104/孔,进行迁移试验。Transwell小室基底膜上层加50μL Matrigel 基质胶,Panc-1接种数量为3×104/孔,下室培养基为20%胎牛血清,进行侵袭试验。细胞培养24h,在侵袭或迁移之后,Transwell小室表面的细胞用棉签擦拭去除,甲醛固定细胞并用结晶紫染色。显微镜下观察并拍照,Image J软件计数迁移侵袭细胞个数,计算穿膜细胞数量的平均值和标准差,每组重复进行3次。
2 结果
2.1检测miR-203a-3p在Aspc-1、Panc-1和HPNE中的表达水平 利用qRT-PCR方法检测miR-203a-3p在HPNE、Aspc-1和Panc-1中的表达水平。与HPNE相比,Aspc-1中miR-203a-3p的表达水平上升了7.71倍,Panc-1中miR-203a-3p的表达水平上升了6.15倍(P<0.05),miR-203a-3p在胰腺癌细胞中的表达水平显著升高,见图1。
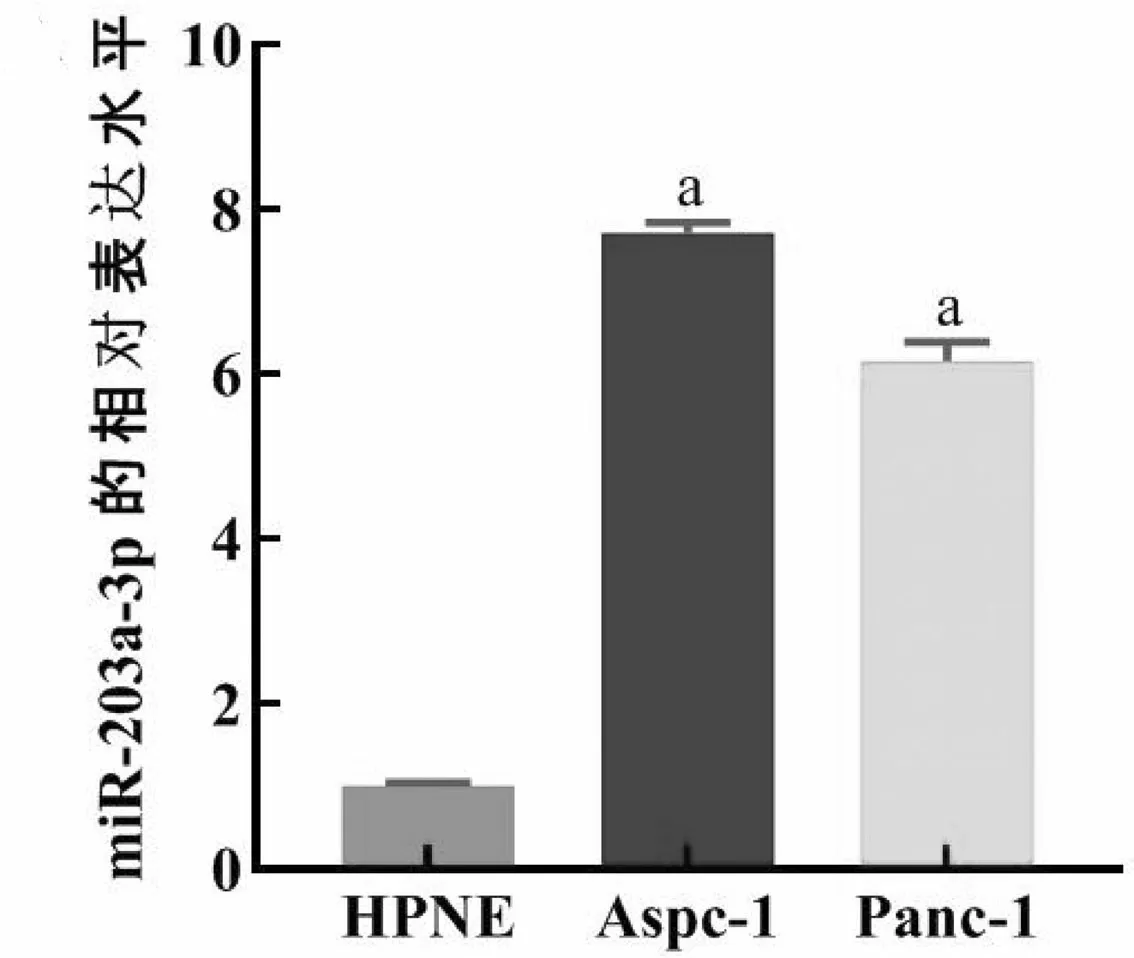
图1 miR-203a-3p在HPNE、Aspc-1、Panc-1细胞系中的表达水平
2.2qRT-PCR检测转染的有效性 在Panc-1中通过脂质体Lipofectamine 2000转染miR-203a-3p mimics过表达miR-203a-3p或转染miR-203a-3p inhibitor抑制miR-203a-3p的表达,实验分为miR-203a-3p mimics组、NC mimics组、miR-203a-3p inhibitor组、NC inhibitor组。转染后48h提取各组细胞总RNA,利用qRT-PCR检测各组细胞中miR-203a-3p的表达水平,分别与其对照组相比。在Panc-1中转染miR-203a-3p mimics后miR-203a-3p的表达水平升高了27.94倍,而转染miR-203a-3p inhibitor后miR-203a-3p表达水平降低了0.47倍(P<0.05),见图2。结果提示在Panc-1中,转染miR-203a-3p mimics能够使miR-203a-3p的表达升高,而转染miR-203a-3p inhibitor能够使miR-203a-3p的表达降低。
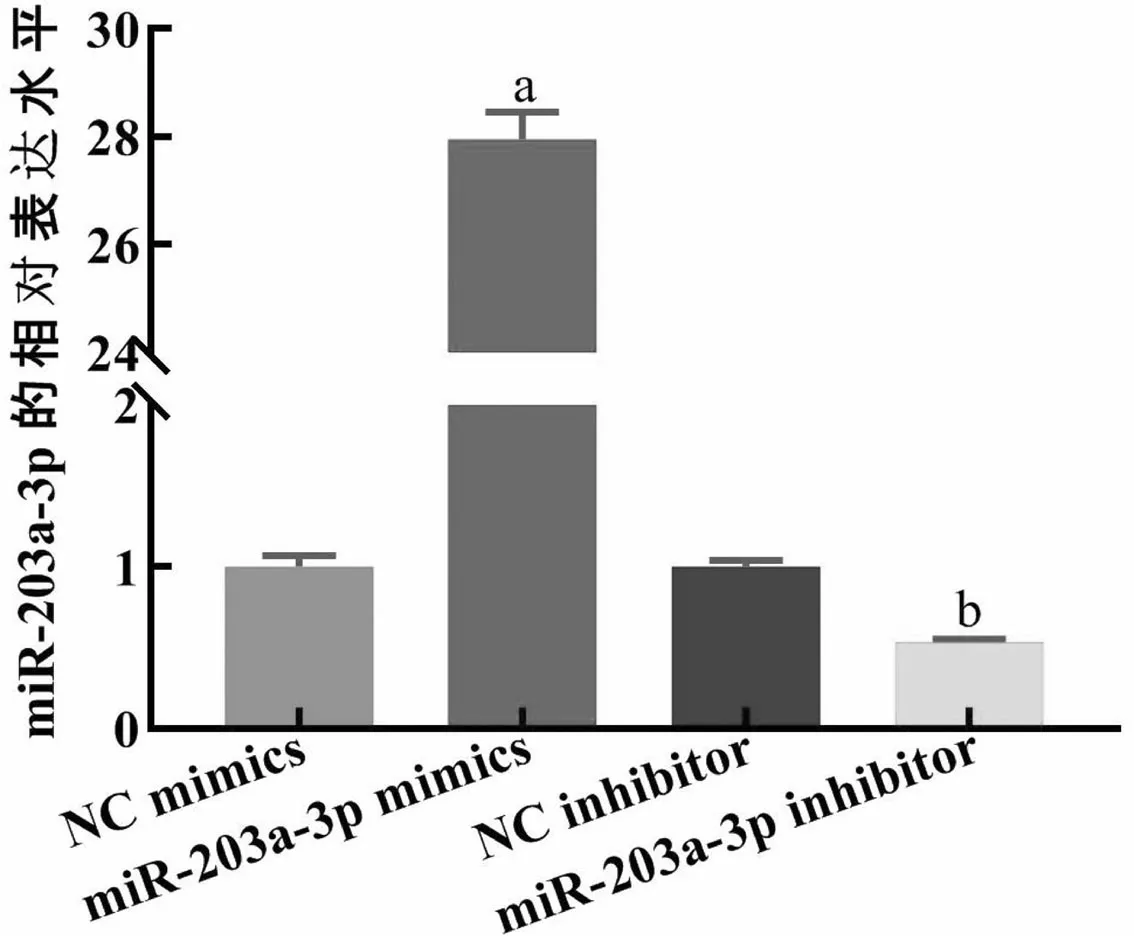
图2 qRT-PCR检测胰腺癌细胞系Panc-1转染效率
2.3miR-203a-3p对Panc-1增殖和克隆形成能力的影响 本次实验分为miR-203a-3p mimic组、NC mimic组和miR-203a-3p inhibitor组、NC inhibitor组,利用脂质体Lipofectamine 2000分别将miR-203a-3p mimics、NC mimics、NC inhibitor和miR-203a-3p inhibitor转染到Panc-1细胞中。在转染0、24、48、72h后,采用CCK-8实验和集落形成实验检测miR-203a-3p对Panc-1增殖能力的影响。CCK-8实验结果显示,在48、72h时,miR-203a-3p mimic组Panc-1的增殖能力显著增强,miR-203a-3p inhibitor组Panc-1的增殖能力显著减弱(P<0.05),见图3A、3B。转染miR-203a-3p mimic和miR-203a-3p inhibitor后48h检测Panc-1的集落形成能力,分别与其对照组相比,miR-203a-3p mimic组中Panc-1的集落数增加了6个,而miR-203a-3p inhibitor组中Panc-1的集落数减少了19个(P<0.05),见图3C、3D。以上结果表明,miR-203a-3p mimics有效地促进了Panc-1的增殖和克隆形成能力,而miR-203a-3p inhibitor有效地抑制了Panc-1的增殖和克隆形成。

图3 miR-203a-3p对Panc-1细胞增殖和克隆形成能力的影响
2.4miR-203a-3p对Panc-1迁移和侵袭能力的影响 实验分为四组:NC mimics组、miR-203a-3p mimics组、NC inhibitor组、miR-203a-3p inhibitor组,每组细胞分别转染NC mimics、miR-203a-3p mimics、NC inhibitor、miR-203a-3p inhibitor。Transwell实验结果显示,与NC mimics组比较,miR-203a-3p mimics组中转染miR-203a-3p mimics 48h后,miR-203a-3p表达水平增加,迁移细胞数增加了214个,侵袭细胞数增加了208个(P<0.05)见图4;与NC inhibitor组比较,miR-203a-3p inhibitor组中转染miR-203a-3p inhibitor 48h后,miR-203a-3p表达被抑制,迁移细胞数减少了208个,侵袭细胞数减少了273个(P<0.05),见图5。结果表明miR-203a-3p过表达可以促进Panc-1迁移和侵袭的能力,而降低miR-203a-3p表达水平可抑制Panc-1迁移和侵袭的能力。
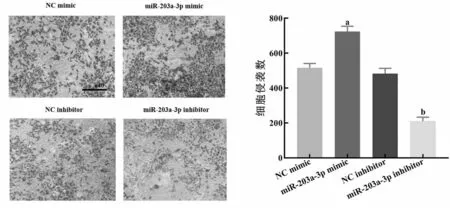
图4 miR-203a-3p促进细胞系Panc-1的迁移
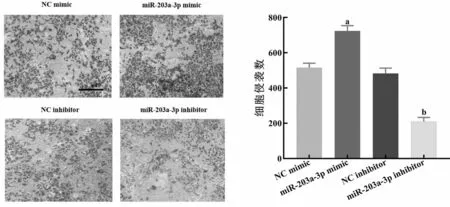
图5 miR-203a-3p促进细胞系Panc-1的侵袭
3 讨论
胰腺癌发病隐匿、转移性强、复发率高,尚无特效治疗方法。目前临床上胰腺癌早期诊断率较低,大多数患者确诊时已处于晚期阶段[9],治疗和预后的进展仍然有限。
miRNAs可通过调控促癌基因或者抑癌基因的表达,从而在肿瘤细胞迁移、侵袭、克隆形成中起着关键作用[10]。miRNAs在肿瘤中高表达可通过负向调控肿瘤抑制基因的表达来促进恶性肿瘤细胞的生长及增殖,具有促肿瘤的作用;miRNAs在肿瘤中低表达则负向调控促癌基因的表达而起到抑癌基因的效果,具有抑制肿瘤的作用。无论促癌功能还是抑癌功能的最终实现依赖于miRNAs对靶基因的调控。有研究利用高通量基因芯片技术和大数据进行分析,揭示了一些在胰腺癌患者中高表达的miRNAs,如:miR-186、miR-203、miR-1266、miR-1293和miR-224[11],以及低表达的 miRNAs,如:miR-326,miR-424,miR-4722和miR-125b[12]。
近几十年来,越来越多的研究强调miRNA失调在卵巢癌、肺癌、胃癌和结直肠癌等多种肿瘤中的分子机制和意义。亦有新证据表明,胰腺癌中的miRNA可能是肿瘤发生的主要因素之一,并可以作为胰腺癌诊断和治疗的预测性生物标志物和靶标。Chen等研究miR-203a-3p与肺癌的关系时发现,在肺癌组织和细胞中其表达水平降低[13],并且LINC 00342通过靶向miR-203a-3p促进了肺癌细胞的增殖、迁移、侵袭和集落形成。此外,过表达miR-203a-3p可通过抑制糖原合成酶激酶-3β表达促进肾细胞癌细胞增殖而抑制其凋亡[14]。本研究首先采用qRT-PCR检测Aspc-1、Panc-1和HPNE中miR-203a-3p的表达水平,结果提示miR-203a-3p的表达水平在Aspc-1、Panc-1中分别升高7.71倍和6.15倍。采用脂质体Lipofectamine 2000将miR-203a-3p mimics模拟物或miR-203a-3p inhibitor抑制剂及其对照NC mimics或NC inhibitor分别转染到Panc-1中,通过CCK8实验、集落形成实验、Transwell实验分别检测了miR-203a-3p对于Panc-1的生长增殖和迁移侵袭的影响,结果显示miR-203a-3p能够有效地促进Panc-1的生长增殖、迁移和侵袭。
本文只进行了miR-203a-3p对胰腺癌细胞影响的研究,在后续研究中,我们会通过生物信息学网站预测miR-203a-3p发挥作用的候选靶基因,并通过双荧光素酶实验确定其对候选靶基因发挥调控作用的机制,构建靶基因的过表达载体以及抑制靶基因表达的siRNA,研究靶基因对胰腺癌细胞的作用是否与miR-203a-3p相反,以期为胰腺癌的早期诊断提供有效的分子标记物,为胰腺癌的临床治疗提供实验依据和创新策略。

