水稻雌雄不育突变体Osfma2的细胞学观察及基因图位克隆
张涛荟 王海宇 万华 张莉萍 谢振威 陈可毅 何晓栋 赵志刚, * 万建民, 2
水稻雌雄不育突变体的细胞学观察及基因图位克隆
张涛荟1, #王海宇1, #万华1张莉萍1谢振威1陈可毅1何晓栋1赵志刚1, *万建民1, 2
(1南京农业大学 作物遗传与种质创新国家重点实验室, 南京 210095;2中国农业科学院 作物科学研究所, 北京 100081;#共同第一作者;*通信联系人, E-mail: zhaozg@njau.edu.cn)
【】通过构建分离群体定位并克隆水稻雌雄不育基因,并对其在水稻育性调控中的功能进行探究。通过EMS诱变水稻宁粳4号得到稳定的不育突变体,对突变体进行表型及细胞学观察,利用精细定位和Mut-map相结合的方法克隆了水稻雌雄不育基因,通过实时荧光定量PCR检测其在各组织表达水平差异,利用水稻原生质体表达系统进行OsFMA2蛋白的亚细胞定位。细胞学观察发现突变体为雌雄不育。利用极端个体将其精细定位于水稻第6染色体长臂448 kb的区间内。结合全基因组重测序结果,最终确定为目标基因。该基因编码一个复制蛋白,在单子叶植物中高度保守。具有组织特异性,在幼穗中高表达。亚细胞定位结果显示OsFMA2蛋白定位于细胞核中。在幼穗中高表达,可能参与了水稻雄配子第一次减数分裂前期同源重组过程,同时,的表达对雌配子发育也产生了不利影响。
水稻;雌雄不育;基因克隆;组织表达;亚细胞定位
减数分裂是有性生殖生物中存在的一种特殊的分裂方式,性母细胞经过一次间期DNA复制和两次连续的细胞分裂,最终来自亲代的遗传信息减半,形成单倍体的配子[6-7]。减数分裂过程中发生的同源重组事件增加了配子的遗传多样化。目前减数分裂的同源重组被认为是由DNA双链断裂(double-strand break,DSB)引发,功能高度保守的拓扑异构类内切酶SPO11蛋白以及其他一些蛋白共同催化完成DNA双链断裂过程[8-10]。DSB产生之后,MRE11、RAD50等蛋白沿5′向3′不断剪切形成3′DNA的单链末端(ssDNA),ssDNA随后与DNA复制蛋白A(RPA)等蛋白因子结合[11],然后与同源染色体或姐妹染色单体结合,并以它们作为模板进行修复(该过程也被称为单链入侵),单链入侵进程需要借助RAD51以及DMC1等重组酶。RAD51或DMC1重组酶取代RPA蛋白与DSB位点产生的单链DNA(ssDNA)结合,沿着DNA延伸形成螺旋状核蛋白纤维,这些核蛋白纤维捕获完整的双链DNA(dsDNA),进而形成含有ssDNA和dsDNA的三元复合物,同源染色体配对以及同源重组过程都是在三元复合物中完成的[12-15]。在这个阶段,其中一部分DSB被修复成交叉(cross-over,CO),其他的则形成非交叉(non-crossover,NCO),两者由不同的通路形成[16-18]。
RPA蛋白首先是从Hela细胞提取物中发现的,参与了SV40病毒体外复制。在人体中RPA是由RPA1(70 kDa)、RPA2(32 kDa)和RPA3(14 kDa)三个亚基组成的异源三聚体[19]。前期研究表明RPA蛋白是一种高度保守的单链DNA结合蛋白(SSBs),它参与了真核生物几乎所有的DNA代谢过程,包括DNA复制、DNA损伤修复和同源重组[20]。在拟南芥中,共有5个的同源基因,和各有2个同源基因。和(能够替代)在减数分裂期间启动同源重组事件中发挥重要作用,它是形成Ⅰ型交叉的必需组成[21-23]。水稻中和各有三个同源基因,但仅有1个拷贝。表现为雌性不育且雄性孢母细胞在第一次减数分裂后期出现异常,OsRPA1a在DNA损伤修复过程中起到基础性的作用。OsRPA2c在减数分裂过程的同源重组后期参与CO的形成,并与OsRPA1c共同维持CO的正常水平[24-25]。但是,OsRPA2c在减数分裂过程中是否同时影响雌雄配子的发育还未见报道。
本研究通过EMS诱变粳稻品种宁粳4号获得了一个稳定遗传的不育突变体,对其进行表型及细胞学观察,通过分离群体精细定位和Mut-map测序相结合的方法图位克隆了基因,检测了在野生型不同组织中的表达水平,并对其功能进行了初步探究。本研究结果将为进一步研究水稻生殖发育奠定理论基础,为水稻高产育种提供有利的基因。
1 材料与方法
1.1 供试材料
本研究供试材料()突变体是通过化学诱变剂甲基磺酸乙酯(EMS)对水稻粳稻品种宁粳4号进行诱变获得的。2016年在南京农业大学土桥水稻育种基地以杂合型植株作为母本,以籼稻品种N22作为父本进行杂交组合配制获得F1杂交种;同年,将F1种植于南京农业大学海南陵水南繁试验基地并收取自交种。2017年夏季,将F2种植于南京农业大学土桥水稻育种基地获得分离F2群体,并选取F2群体中极端个体进行定位。
1.2 I2-KI染色观察花粉育性
分别选取野生型和突变体植株正在开花的主穗,各取即将开花的成熟小穗3~5个,置于卡诺固定液(无水乙醇∶乙酸=3∶1)中,放入4℃冰箱内保存。镜检时,先滴一小滴1% I2-KI染液于载玻片,用干净的镊子夹取花药已经伸长达颖壳2/3的颖花3朵,剥开内外颖壳,从每朵小花中取3枚花药放到染液中,然后用镊子轻轻夹碎花药使花粉粒充分释放,去掉残余的药壁,盖上盖玻片,置于普通光学显微镜下对花粉染色情况进行观察。随机选取3个不同的视野拍照记录,并进行数据统计。观察时,可育花粉粒为圆形,染色为黑褐色;不育花粉粒染色浅或无法着色,畸形或圆形。
1.3 曙红染色法观察胚囊的发育过程
分别取野生型和突变体植株孕穗期至抽穗期间各个不同时期的小穗,置于卡诺固定液中,抽真空后存放于4℃下保存。在体视镜下剥取野生型和突变体的雌蕊,根据颖花长度及子房大小,取不同分时期样品置于卡诺固定液中。样品依次经过70%、50%和30%的酒精溶液、蒸馏水和2%的硫酸铝钾溶液处理,每次处理30 min,用10 mg/L的曙红溶液避光浸染12 h。之后用2%的硫酸铝钾溶液处理30 min,蒸馏水漂洗3次,依次用30%、50%、70%、80%和90%的酒精溶液处理,每次处理30 min,而后用无水乙醇处理4次。将样品置于无水乙醇和水杨酸甲酯(体积比为1∶1)溶液中处理2 h,最后经过纯水杨酸甲酯透明处理12 h以上。吸取处理好的样品于凹面载玻片上,盖上盖玻片,倒放于Leica激光共聚焦显微镜载物台上进行观察并拍照。
1.4 醋酸洋红染色观察花粉发育过程
分别取野生型和突变体植株各生育时期的小穗置于卡诺固定液中,4℃冰箱内保存。镜检时,先滴一小滴1%的醋酸洋红溶液,用干净的镊子夹取一枚完整的花药置于染液中,用镊子轻夹花药,充分释放花粉粒,除去花药壁结构后盖上盖玻片,置于普通光学显微镜下观察。根据花粉细胞染色体形态、细胞核数目等判定具体发育时期,拍照记录。
“左达的故事至少可以给我们两个启示,第一,在咱们中国,从贫民到千万富翁甚至亿万富翁,是完全可能的,要不了多长时间。”张仲平说到这儿有意地停顿了一下,借此看看曾真的反应,见曾真认真地记录着,便喝了一口水,继续说,“第二,在咱们中国,从千万富翁甚至亿万富翁到一贫如洗,更要不了多长时间,也许一夜之间就够了。”
1.5 花药半薄切片观察雄配子发育过程
分别取野生型与突变体不同发育时期的小花置于卡诺固定液中,抽真空后存放于4℃冰箱保存。用0.1 mol/L的磷酸钠缓冲液(PBS,pH=7.2)充分漂洗3次,每次20 min,而后经15%、30%、50%、70%、80%、90%、95%、100%的酒精溶液脱水,进而用丙酮置换乙醇,再用现配的树脂溶液进行渗透,之后将样品放入模具中,最后置于烘箱中包埋聚合,完成聚合的样品用磨砂纸修块,并在Leica UC7超薄切片机上切片,切片厚度为1 μm。切好的样品转移至加有蒸馏水的载玻片上,在烤片机上60℃过夜烤干,随后用0.5%甲苯胺蓝染色液染色,蒸馏水浸洗后烘干,树胶封片后在显微镜下观察并拍照。
1.6 DAPI染色观察雄配子孢原细胞染色体的扩散
滴加一滴1%醋酸洋红溶液于载玻片,用镊子取固定好的减数分裂期的小花,每个小花取2~3枚花药,用镊子夹碎花药使孢母细胞充分释放,盖上盖玻片。置于液氮中0.5 h,取出后去掉盖玻片,经70%、90%、100%的酒精系列梯度脱水,每个梯度5 min。处理结束后,在风干的载玻片上滴加溶解在抗荧光衰减封片剂的DAPI(4′, 6-二脒基-2-苯基吲哚)染液,盖上盖玻片后用荧光显微镜观察并拍照。
1.7 水稻不育基因的定位与克隆
以()杂合型植株为母本,籼稻品种N22作父本进行杂交获得F1杂交种,海南繁种得到自交种F2,分家系播种后得到性状分离的次级F2群体,选取极端隐性个体进行基因定位。利用实验室公共平台的SSR标记和InDel标记共计筛选出123对在亲本“宁粳4号”和“N22”中表现出多态性的分子标记,对10个极端表型的个体进行连锁分析,然后扩大群体加密标记进行精细定位。设计定位引物时,宁粳4号参照日本晴序列,N22参照9311序列,遵循引物设计原则在Rice Var Map2网站(http://ricevarmap.ncpgr.cn/v2/)上进行设计,设计引物见表1。从分离的F2群体中分别选取不育和可育植株各30株,取鲜嫩叶片等量混合研磨构建混池,送公司进行重测序,利用Mut-map方法对测序结果进一步分析。
1.8 荧光定量检测基因表达量
取野生型的根、茎秆、叶、幼穗、叶鞘组织迅速置于液氮中,放于−80℃冰箱冻存。使用植物总RNA提取试剂盒(天根)提取总RNA,对提取的RNA进行反转录及后续定量实验。定量引物见表1。

表1 本研究用于精细定位和定量的引物序列
1.9 水稻原生质体分离及亚细胞定位
构建OsFMA2-GFP融合载体,挑取测序结果正确的阳性单克隆于200 mL LB中过夜培养12~16 h,利用天根的无内毒素质粒大提试剂盒进行质粒提取。将提取的质粒转入水稻原生质体中,置于激光共聚焦显微镜下观察GFP在原生质体中的荧光。
水稻原生质体的分离:用单面刀片将生长10 d左右的9311幼苗叶鞘以下切成1~2 mm左右的碎块,立即浸入酶解液中;抽真空1 h,在28℃黑暗条件下40 r/min摇4 h进行酶解;用35 μm(200目)尼龙膜过滤酶解液,转移至50 mL离心管,加入10 mL的W5溶液,80 r/min室温摇1 h,再次过滤后转移至50 mL离心管,加W5溶液至45 mL;200、28℃条件下离心7 min,尽量去除上清,加入2 mL重悬液;加8 mL蔗糖溶液,悬浮原生质体,150下离心7 min;用移液枪将其吸至另一个50 mL离心管,加W5溶液至45 mL,200下离心7 min;去除上清,加入2 mL重悬液,避光分装进2 mL EP管中,镜检;在2 mL EP管中加入10 μg质粒,加入200 μL原生质体,小心混匀;加入220 μL 40%的PEG,立即轻柔混合,28℃下孵育20 min;缓慢加入880 μL W5溶液,小心混匀,150下离心3 min,除去PEG; 用200 μL W5溶液重悬沉淀,28℃下黑暗过夜培养。
1.10 进化树分析及同源序列比对
利用NCBI(http://www.ncbi.nlm.nih.gov)中BLASTp网站搜索与OsFMA2蛋白全长氨基酸序列同源的其他物种中的同源蛋白,选择同源性较高的蛋白下载序列,利用BioXM 2.6进行同源序列比对,通过MEGA 7.0.26软件采用极大似然估计方法构建不同物种间FMA2蛋白的系统进化树。
2 结果与分析
2.1 Osfma2突变体表型鉴定
与野生型相比,突变体在株型、抽穗期等农艺性状上无较大差异,而小穗育性表现出明显差异(图1-A~B),并且突变体花药发白皱缩(图1-C~D),推测突变体小穗不育表型可能是由花粉败育引起。经I2-KI染色观察发现野生型花粉粒育性正常(图1-E),而突变体的花药不能形成成熟的花粉粒,花粉粒呈现典败(图1-F)。
2.2 野生型和突变体Osfma2的花粉发育过程
为了确认花粉败育的具体时期,我们采用醋酸洋红染色法观察野生型和突变体的花粉发育。参照冯九焕等[26]的方法,将水稻花粉发育过程划分为8个时期。在小孢子母细胞形成期,突变体与野生型的花粉形态没有明显差异(图2-A、I)。此后,野生型花药继续发育,经减数分裂形成二分体(图2-B)和四分体(图2-C)。随着包围四分体的胼胝质壁解体,小孢子被释放出来,呈现出圆球形或椭圆球形,且具有极薄的初生细胞壁(图2-D)。到了小孢子晚期,中央大液泡形成,小孢子恢复成圆球形(图2-E)。到了二核花粉早期,小孢子经一次有丝分裂形成较大的营养细胞和透镜状的生殖细胞,营养核逐渐向萌发孔一端移动,并伴随花粉体积增大(图2-F)。随着淀粉粒等物质开始在萌发孔附近积累,花粉进入小孢子晚期,这一时期生殖核逐渐迁移至营养核附近(图2-G)。到了成熟期,可见淀粉等贮藏物完全填充整个花粉粒(图2-H)。相较于野生型,突变体在小孢子早期之前未见明显差异(图2-J、K、L),而小孢子晚期花粉粒发育停滞(图2-M),细胞轮廓出现明显皱缩,花粉粒中无淀粉填充(图2-N、O),最终无法形成正常的成熟花粉粒(图2-P)。

A—野生型和突变体Osfma2的植株形态,比例尺为15 cm。B—野生型和突变体的小穗,比例尺为4 cm。C—野生型的花药,比例尺为600 μm。D—突变体的花药表型,比例尺为600 μm。E—野生型的花粉镜检,比例尺为50 μm。F—突变体的花粉镜检,比例尺为50 μm。
Fig. 1. Phenotypes and sterility of the wild type and the mutant.
2.3 野生型和突变体Osfma2的花药半薄切片
为了进一步探究突变体雄性不育的细胞学原因,对野生型和突变体花药进行半薄切片观察。张大兵等[27]将水稻花药发育过程划分为14个时期。前7个时期,突变体与野生型没有明显的差异,都由孢原细胞经一次平周分裂及两次有丝分裂形成小孢子母细胞,小孢子母细胞被四层花药壁细胞包围(图3-A、G)。从第8时期开始,野生型中小孢子母细胞经历正常的减数分裂形成正常形态的由胼胝质壁包围的四分体,此时绒毡层细胞发生空泡化并开始程序性死亡(图3-B);而突变体虽能产生四分体,但其绒毡层可能发生了提前降解(图3-H)。到了第9时期,随着胼胝质壁的降解,野生型中小孢子从四分体中释放出来游离在药室,绒毡层细胞浓缩(图3-C)。第10时期,野生型中小孢子高度空泡化,体积增大呈现圆形,此时绒毡层细胞被挤压呈山丘状,并开始降解(图3-D)。此后,野生型小孢子经一次不对称的有丝分裂,形成营养细胞和生殖细胞,呈现典型的镰刀状(图3-E)。在这一过程中,突变体小孢子中表型无明显异常,但其绒毡层细胞退化更为严重(图3-I、J)。第11时期时,突变体中花粉细胞明显异常(图3-K)。到了第14时期,野生型成熟花粉粒中充满了淀粉等贮藏物质(图3-F)。而突变体这一时期花粉粒内无淀粉积累,故无法染色(图3-L)。因此推测,突变体雄性不育可能与绒毡层提前降解有关。

A~H为野生型花粉发育过程;I~P为突变体花粉发育过程。A和I—孢原细胞期;B和J—二分体期;C和K—四分体期;D和L—小孢子早期;E和M—小孢子晚期;F和N—二核早期;G和O—二核晚期;H和P—成熟花粉期。比例尺为10 μm。
Fig. 2. Developmental process of pollen in the wild type and the mutant

A~F为野生型花药;G~L为突变体花药。A和G—花药发育减数分裂之前;B和H—花药发育的8b阶段;C和I—花药发育的第9阶段;D和J—花药发育的第10阶段; E和K—花药发育的第11阶段;F和L—花药发育的成熟阶段。箭头指向: E—上皮; En—内层; ML—中间层; T—绒毡层; MMC—小孢子母细胞; Tds—四分体; Msp—小孢子壁细胞; BP—二核花粉; Mp—成熟花粉粒。比例尺为10 μm。
2.4 雄性孢母细胞的染色体分离异常
为明确突变体的败育原因,利用4,6-二氨基-2-苯基吲哚(DAPI)对减数分裂各发育时期花粉母细胞的染色体进行染色观察。野生型在细线期形成细长、线状的染色体,偶线期染色体逐渐变粗,开始发生同源染色体的联会现象(图4-A),粗线期时同源染色体完全联会(图4-B)。之后染色体持续缩短变粗,在双线期联会复合体互相排斥,并可见交叉结(图4-C)。直至终变期,形成12个清晰可见的二价体(图4-D)。减数分裂第一次中期时同源染色体均匀排布于赤道板两侧,后期同源染色体分离,分别向细胞两极迁移(图4-E)。细胞经两次减数分裂之后,最终形成四分体(图4-F)。相较于野生型,突变体在减数分裂偶线期染色体行为没有明显差异(图4-G),粗线期突变体中染色体形态异常,出现了未联会配对的区域(图4-H),在双线期进一步浓缩(图4-I),终变期形成了数量异常的单价体(图4-J)。而后减数分裂第1次分裂后期,这些单价体随机分离导致雄配子染色体不均等分布(图4-K),最终形成大小不一的四分体(图4-L)。

A~F为野生型孢母细胞;G~L为突变体的孢母细胞。A和G—孢母细胞的偶线期;B和H—粗线期;C和I—双线期;D和J—终变期;E和K—二分体;F和L—四分体。白色箭头指向单价体。比例尺为5μm。
Fig. 4. Chromosome observation of archesporial cell of the wild type and the mutant

A~E为野生型胚囊发育过程;F~J为突变体的胚囊发育过程。A和F—孢原细胞期;B和G—二分体期;C和H—四分体时期;D和I—功能大孢子期;E和J—成熟胚囊期。A~D、F~I的比例尺为30 μm;E和J的比例尺为60μm。
Fig. 5. Observation of embryo sac development of the wild type and the mutant
2.5 突变体Osfma2胚囊发育受阻
为明确突变体的雌配子发育是否也存在异常,采用胚囊整体染色及透明技术对野生型和突变体的胚囊发育过程进行了观察。野生型珠心中的孢原细胞首先发育成大孢子母细胞(图5-A),大孢子母细胞经过第1次有丝分裂产生二分体大孢子(图5-B),再经过第2次减数分裂产生四分体大孢子(图5-C)。此后,靠近珠孔端的3个大孢子逐渐退化,靠近合点端的大孢子形成功能大孢子(图5-D)。功能大孢子发育为单核胚囊,单核胚囊经三次连续的有丝分裂最终形成七细胞八核的胚囊。在八核胚囊形成阶段,经过细胞核的迁移和细胞化,形成含有卵细胞、助细胞、极核及反足细胞的成熟胚囊(图5-E)。相较于野生型,突变体的孢原细胞和大孢子母细胞发育正常(图5-F),大孢子母细胞第二次减数分裂开始退化(图5-H),不能形成正常的功能大孢子(图5-I)。之后的有丝分裂也存在异常,无法形成正常七细胞八核结构的胚囊(图5-J)。
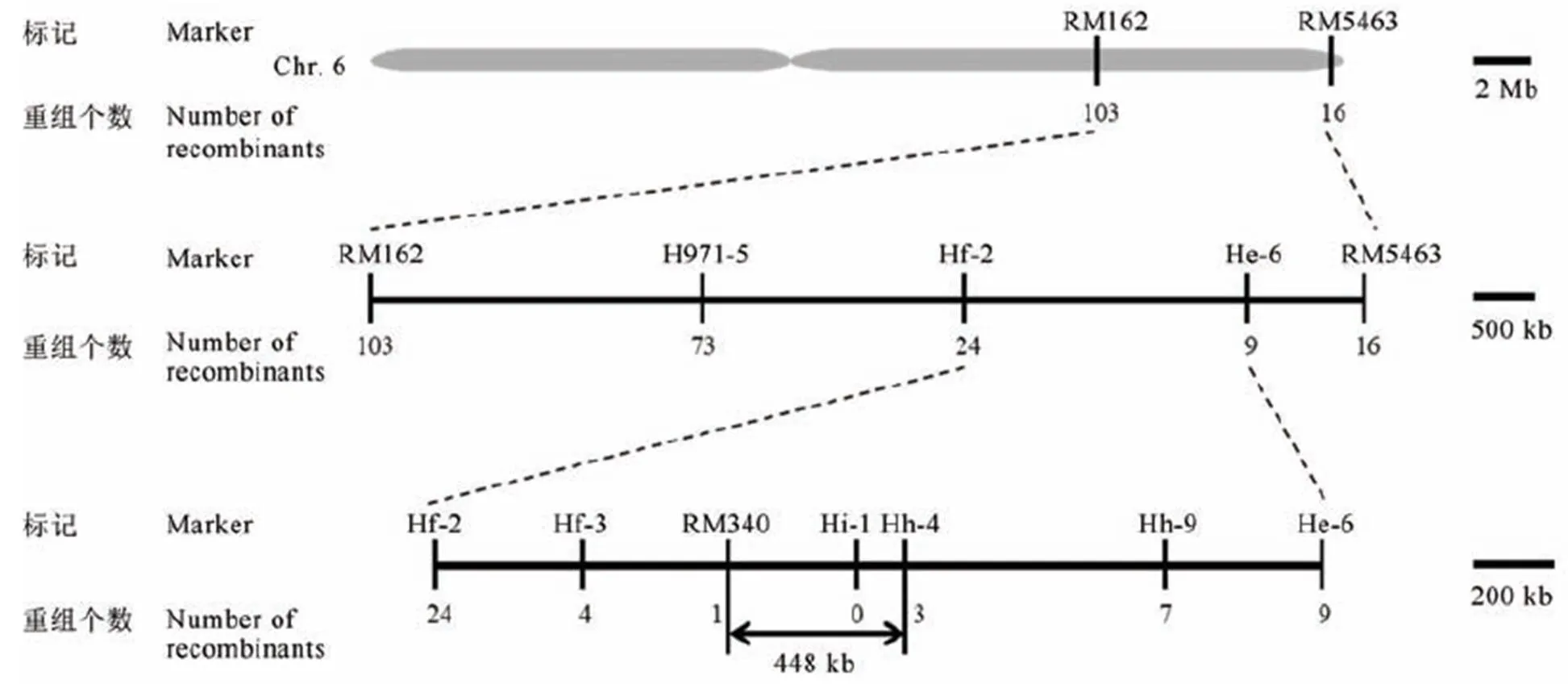
OsFMA2基因的初连锁和精细定位。OsFMA2基因最终定位在分子标记RM340和Hh-4之间448 kb的区间内。
Fig. 6.gene mapping on chromosome 6.
2.6 突变体Osfma2的遗传分析
以杂合子(/)为母本,籼稻N22为父本进行杂交,获得F1,将F1自交种分单株收种,获得F2群体种子,将F2群体分家系播种。在F2群体中挑选表型分离的家系进行统计,共获得可育单株165株,不育单株65株。经过卡方测验,分离比符合3∶1(χ2=1.21<χ20.05, 1=3.84),表明突变体的不育性状受一个单隐性核基因控制。
2.7 OsFMA2基因定位与克隆
利用上述F2分离群体进行定位。首先筛选出均匀分布在水稻12条染色体上并在粳稻品种宁粳4号和籼稻品种N22中表现出多态性的SSR标记和InDel分子标记,利用F2群体中10个极端不育个体和10个高育单株进行连锁分析,发现第6染色体上标记RM162和标记RM5463存在连锁迹象,物理距离约为7.83 Mb。随后通过加密标记,利用216个极端个体将不育基因定位在标记RM340与Hh-4之间约448 kb的区间范围内(图6)。
为了进一步确定候选基因,对F2群体中30株不育单株和30株高育单株的叶片分别构建不育和可育两个池进行全基因组测序。根据基因组序列差异程度表征值Delta(SNP-index),筛选出染色体上Delta(SNP-index)值呈现负峰状且连续分布的区间(图7),发现在水稻第6染色体上存在符合要求的目的区间,故将其作为候选区间。对重测序结果进行进一步分析,发现区间内基因()第9内含子与第10外显子交界处存在1处突变,另一个基因则是发生了同义突变。因此,将基因作为候选基因。该基因为已报道的新的等位基因。
2.8 突变位点的测序验证
对基因进行测序验证,发现突变体相较野生型在第9个内含子和第10个外显子交界处存在一处A-T的单碱基替换(图8-A),由腺嘌呤突变为胸腺嘧啶,电泳结果显示突变体与野生型的转录本相比较,突变体存在另一种形式(约1000 bp)的转录本,这表明该碱基的替换造成了野生型与突变体之间转录本的差异(图8-B)。此变异位于基因的RPA_C的蛋白结构域(图8-C)。
2.9 蛋白OsFMA2同源序列比对及进化树分析
为进一步了解基因的功能,对其编码蛋白OsFMA2进行生物信息学分析。网站蛋白结构域预测显示,OsFMA2蛋白包含两个结构域,分别为DBD_D结构域和RPA_C结构域(图9-A)。截至目前,RPA蛋白已经在多个物种中被报道,包括拟南芥、酿酒酵母、人类等[28-30]。于是对不同物种间的RPA蛋白序列进行同源序列比对,发现在这些蛋白中DBD_D结构域和RPA_C结构域较为保守(图9-B)。接着对OsFMA2及其各物种间同源蛋白构建系统进化树(图10)。水稻中OsFMA2与其他单子叶植物如二穗短柄草、玉米、高粱、黍等植物中RPA蛋白处于同一进化分枝,而拟南芥、油棕等双子叶植物及酿酒酵母等处于另一进化分枝。这些结果表明尽管来自不用物种的RPA蛋白含有同样较为保守的DBD_D结构域和RPA_C结构域,但在进化方向上仍存在着差异。

图7 全基因组重测序限定OsFMA2基因物理位置
Fig. 7. Whole genome re-sequencing defines the physical location ofgene.
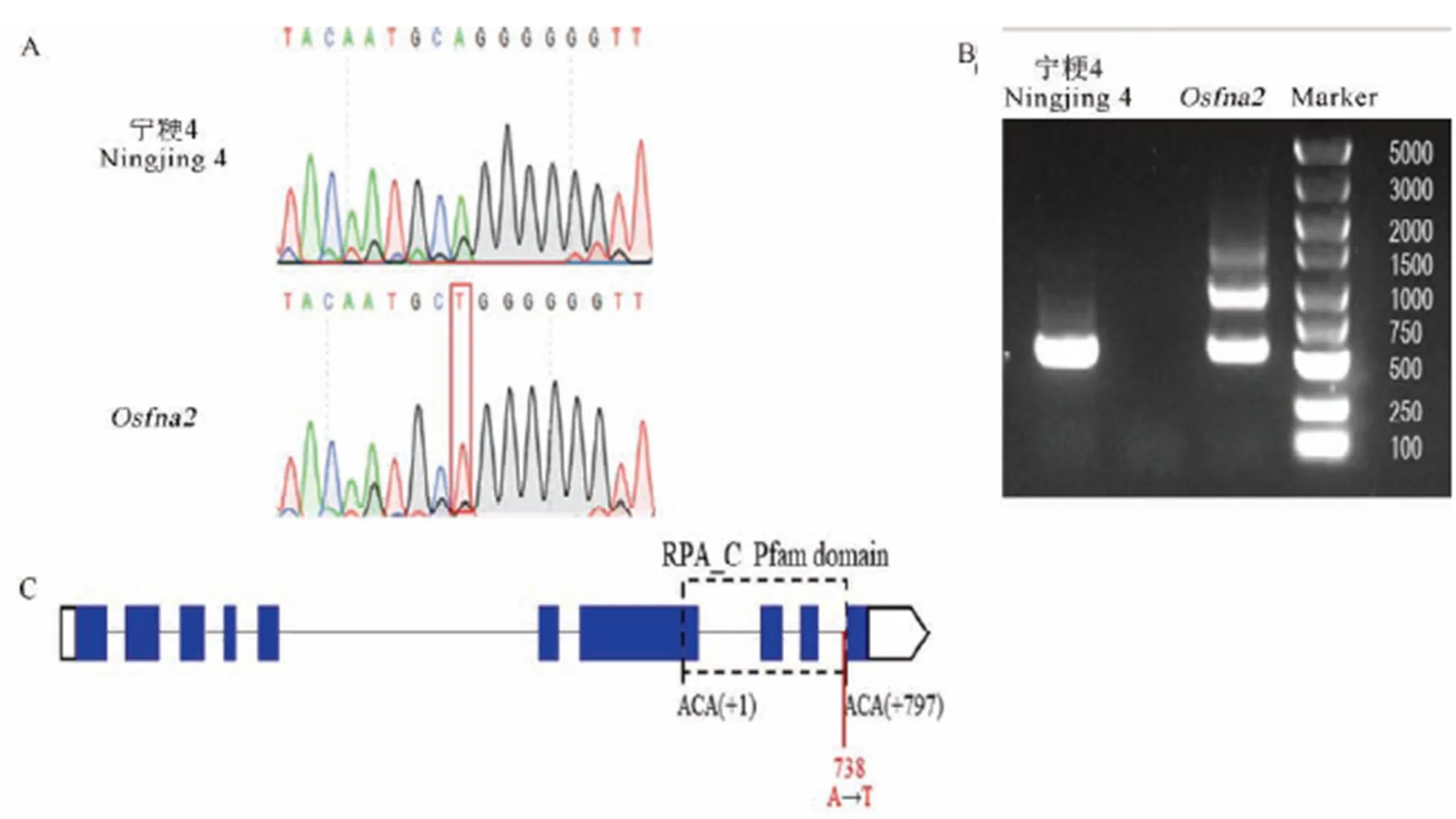
A—野生型与突变体的测序差异;B—野生型和突变体中OsFMA2基因的差异剪切;C—OsFMA2的基因结构,蓝色框代表外显子,线条代表内含子,虚线框代表的是RPA_C保守结构域,从首位氨基酸的第一个碱基开始计算到末位氨基酸的最后一个碱基为止。红色实线代表突变位置。白色框分别代表5′UTR和3′ UTR。
Fig. 8. Cloning and sequence analysis of the sterility gene
2.10 OsFMA2基因的组织表达模式
为了明确基因在水稻各个组织中的表达情况,提取野生型植株根、茎、叶、幼穗、鞘等组织的RNA,反转录得到cDNA后进行实时荧光定量PCR检测。如图11所示,基因在根、茎、叶、鞘、幼穗中均有表达,但各组织间表达量存在明显差异。其中该基因在水稻幼穗中表达量最高,而在营养组织中表达量较低,在叶鞘中几乎不表达。由此表明,虽然基因的表达是组成型,但其在3 mm幼穗中呈现高表达,这个发育阶段正是减数分裂时期。随后,我们对不同花药发育时期的表达水平进行定量分析,发现其在小孢子母细胞形成期以及减数分裂期高表达。
2.11 亚细胞定位
为研究OsFMA2蛋白的亚细胞定位,将OsFMA2-GFP融合蛋白和核标记蛋白共转入水稻原生质体中,在激光共聚焦显微镜下观察,发现OsFMA2-GFP蛋白与核标记蛋白重合(图12),表明OsFMA2蛋白定位于细胞核中,是一个核蛋白。

A—OsFMA2蛋白结构预测,数字代表氨基酸残基位置;B—OsFMA2蛋白与其他物种中RPA蛋白序列同源比对。
Fig. 9. Bio-information analysis of OsFMA2.

图10 OsFMA2与同源蛋白进化分析
Fig. 10. Molecular Phylogenetic analysis of OsFMA2 and other RPA protein by Maximum Likelihood method.
3 讨论
减数分裂作为有性生殖个体在生殖发育过程中特殊的分裂方式,其对于配子的遗传多样性及亲子代间染色体数目稳定意义重大。在多数真核生物中,减数第一次分裂前期发生的核心事件涉及同源染色体的配对、联会及同源重组[31]。目前已经报道了大量减数分裂相关基因,这些基因发生突变导致减数分裂发生异常,从而导致不同程度不同表型的败育类型[32]。本研究中所得到的突变体,在第9内含子和第10外显子的交界处发生了1处单碱基替换,造成突变体转录本出现差异,是一个新的水稻的等位材料。根据前人的报道,水稻中的在减数分裂过程中高表达,其编码了一个含430个氨基酸的蛋白质RPA2c[25]。对RPA2c的氨基酸序列进行保守结构域分析,发现其具有较为保守的一个DNA binding结构域(DBD_D)和一个RPA_C端结构域。
前人研究的水稻突变体是一个T-DNA插入突变体,插入位置在基因的第4内含子上。与已报道的突变方式和位点不同,本研究中的突变体在第9内含子与第10外显子交界处发生了一处单碱基突变,突变位点位于剪切识别处,造成突变体和野生型之间存在转录本的差异。对突变体进行败育原因的探究,通过4,6-二氨基-2-苯基吲哚(DAPI)染色,发现突变体在减数第一次分裂的终变期出现了数目异常的单价体(最多为24个),并伴随有小孢子染色体不均等分离,这与Li等的研究相符[25]。醋酸洋红染色结果及花药半薄切片观察也表明突变体无法形成正常的花粉粒。以上结果表明基因的突变直接影响雄配子的发育过程,但是对该基因在雌配子发育方面还未见报道。有趣的是,我们利用曙红染色法观察胚囊发育情况,发现突变体中功能大孢子形成异常最终导致突变体发生雌配子败育,从而证实是一个同时控制水稻雌雄配子发育的关键基因。
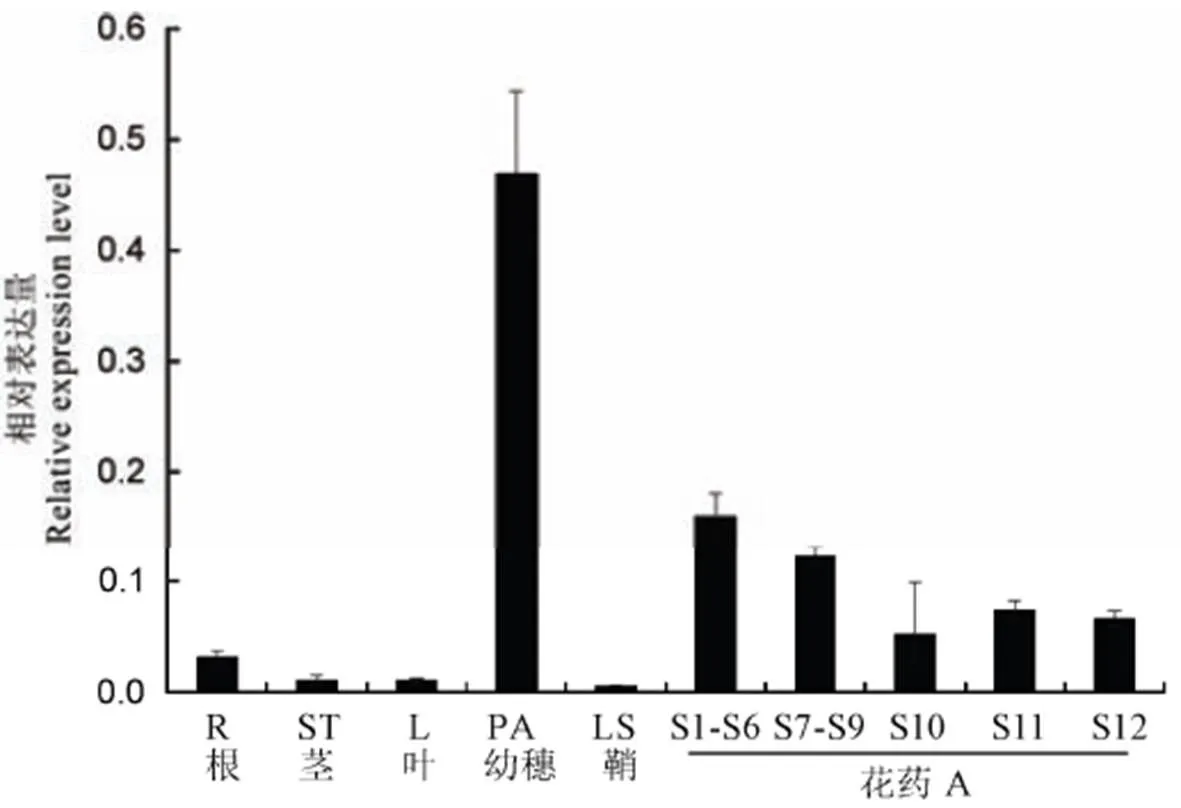
R—根;ST—茎秆;L—叶;PA—3mm幼穗;LS—叶鞘;A—花药;S1−S6表示小孢子母细胞形成期;S7−S9表示花药减数分裂期;S10—单核花粉期;S11—双核花粉期;S12—三核花粉期。内参为OsUbiquitin,误差线为n=3的标准差。
Fig. 11. Relative expression levels ofin different rice tissues.

A—OsFMA2-GFP融合蛋白在水稻原生质体中的亚细胞定位;B—核标签在水稻原生质体中的定位;C—明场视野中原生质体状态;D—GFP,核标签,明场的融合。比例尺为10 μm。
Fig. 12. Subcellular localization of OsFMA2 in rice protoplast.
本研究运用了精细定位和Mut-map重测序相结合的方式克隆了基因,这比传统上正向遗传学的基因定位更具优势。随着NGS(二代测序)技术的发展,基于BSA-seq(Bulked Segregant Analysis-seq)的Mut-map方法逐步受到育种家们的青睐。Mut-map这一新型技术最先于2012年由Abe等[33]提出,它要求将目的性状稳定的突变体与野生型亲本进行杂交得到F1代,F1代自交获得F2代后从分离群体中挑选20株表现为突变体性状的个体进行混池测序,与野生型亲本测序序列比较后将SNP指数为1的SNP位点作为候选位点。由于此方法仅仅适用于点突变和质量性状的研究,本研究中使用的Mut-map在这一基础上做了进一步的改进,挑选F2代中表现为极高育性和极低育性的单株分别进行混池测序,获得的序列再与野生型亲本序列进行比较,最后将两个池间SNP指数差值较大的位点定为候选位点。利用此方法能显著地减小定位群体、缩减定位周期的同时,有效避免了由于目的性状外其他背景差异带来的干扰,大大提高了定位的准确性。
DNA复制蛋白(RPA)是真核生物中广泛存在的单链结合蛋白,它几乎参与了所有的DNA代谢过程,包括DNA复制、修复、重组等。RPA蛋白是与其他蛋白互作共同来实现这些生化过程的。根据前人研究,RPA蛋白在拟南芥、水稻、人类等体内存在多个拷贝。在水稻中共鉴定出三种拷贝的RPA1(RPA1a,RPA1b,RPA1c),三种拷贝的RPA2(RPA2a,RPA2b,RPA2c)及单拷贝的RPA3。结合这些亚基互作情况,普遍认为水稻中共存在三种RPA复合体:OsRPA1a-OsRPA2b-OsRPA3(A型)、OsRPA1b-OsRPA2a-OsRPA3(B型),OsRPA1c-OsRPA2c-OsRPA3(C型)[34]。这种亚基多拷贝的现象在植物进化过程中非常常见,但这些亚基究竟如何对减数分裂复制重组等产生影响有待详细的功能探究。本研究发现定位于细胞核,检测在野生型不同组织中的表达水平差异发现其在减数分裂期的花药中高表达,以上结果或许暗示了与减数分裂期的一些核蛋白作用共同行使功能。这为进一步探究互作的功能蛋白提供思路。
[1] 谭何新, 文铁桥, 张大兵. 水稻花粉发育的分子机理[J]. 植物学通报, 2007, 24(3): 330-339.
Tan H X, Wen T Q, Zhang D B. Molecular mechanisms of pollen development in[J]., 2007, 24(3): 330-339. (in Chinese with English abstract)
[2] 马西青, 方才臣, 邓联武, 万向元. 水稻隐性核雄性不育基因研究进展及育种应用探讨[J]. 中国水稻科学, 2012, 26(5): 511-520.
Wan X Q, Fang C C, Deng L W, Wan X Y. Research progress and breeding application of recessive genic male sterility genes in rice[J]., 2012, 26(5): 511-520. (in Chinese with English abstract)
[3] 官文祥, 邓赟, 李小旭, 吴为人, 郑燕. 水稻雌性不育分子机理研究进展[J]. 分子植物育种, 2017, 15(2): 672-684.
Guan W X, Deng Y, Li X X, Wu W R, Zheng Y. Advances in research on molecular mechanism of female sterility in rice (L.)[J]., 2017, 15(2): 672-684. (in Chinese with English abstract)
[4] 刘春宏, 方珊茹, 刘玉芹, 沈伟锋. 水稻雄性核不育基因的研究进展[J]. 台湾农业探索, 2012, 19(1): 71-75.
Liu C H, Fang S R, Liu Y Q, Shen W F. Research progress on genic male sterile genes in rice (L)[J]., 2012, 19(1): 71-75. (in Chinese with English abstract)
[5] Wang C, Liu Q, Shen Y, Hua Y, Wang J J, Lin J R, Wu M G, Sun T T, Cheng Z K, Mercier R. Clonal seeds from hybrid rice by simultaneous genome engineering of meiosis and fertilization genes[J]., 2019, 37(3): 283-286.
[6] Nonomur K, Nakano M, Fukuda T, Eiguchi M, Miyao A, Hirochika H, Kurata N. The novel geneof rice encodes a putative coiled-coil protein required for homologous chromosome pairing in meiosis[J]., 2004, 16(4): 1008-1020.
[7] Chang L, Ma H, Xue H W. Functional conservation of the meiotic genes SDS and RCK in male meiosis in the monocot rice[J]., 2009, 19(6): 768-782.
[8] Yu H X, Wang M, Tang D, Wang K J, Chen F L, Gong Z Y, Gu M H, Cheng Z K. OsSPO11-1 is essential for both homologous chromosome pairing and crossover formation in rice[J]., 2010, 119(6): 625-636.
[9] Wang Y X, Copenhaver G. Meiotic recombination: mixing it up in plants[J]., 2018, 69(1): 577-609.
[10] Shingu Y, Tokai T, Agawa Y, Toyota K, Ahmed S, Kobayashi M, Komatsu A, Mikawa, T, Yamamoto M, Wakasa K, Shibata T, Kusano K. The double-stranded break-forming activity of plant SPO11s and a novel rice SPO11 revealed by a Drosophila bioassay[J]., 2012, 13: 1-16.
[11] Zhang B W, Wang M, Tang D, Li Y F, Xu M, Gu M H, Cheng Z K, Yu H X. XRCC3 is essential for proper double-strand break repair and homologous recombination in rice meiosis[J]., 2015, 66(19): 5713-5725.
[12] Deng Z Y, Wang T. OsDMC1 is required for homologous pairing in[J]., 2007, 65(1-2): 31-42.
[13] Sheridan S, Yu X, Roth R, Heuser J, Sehorn M, Sung P, Egelman E, Bishop D. A comparative analysis of Dmc1 and Rad51 nucleoprotein filaments[J]., 2008, 36(12): 4057-4066.
[14] Sakane I, Kamataki C, Takizawa Y, Nakashima M, Toki S, Ichikawa H, Ikawa S, Shibata T, Kurumizaka H. Filament formation and robust strand exchange activities of the rice DMC1A and DMC1B proteins[J]., 2008, 36(13): 4266-4276.
[15] Morozumi Y, Ino R, Ikawa S, Mimida N, Shimizu T, Toki S, Ichikawa H, Shibata T, Kurumizaka, H. Homologous pairing activities of two rice RAD51 proteins, RAD51A1 and RAD51A2[J]., 2013, 8(10): e75451.
[16] Vries S, Baart E, Dekker M, Siezen A, Rooij D, Boer P, Riele H. Mouse MutS-like protein Msh5 is required for proper chromosome synapsis in male and female meiosis[J]., 1999, 13(5): 523-531.
[17] Mimitou E, Symington L. DNA end resection: Many nucleases make light work[J]., 2009, 8(9): 983-995.
[18] Youds J, Boulton S. The choice in meiosis defining the factors that influence crossover or non-crossover formation[J]., 2011, 124(4): 501-513.
[19] Fairman M, Stillman B. Cellular factors required for multiple stages of SV40 DNA-replication in vitro[J]., 1988, 7(4): 1211-1218.
[20] Iftode C, Daniely Y, Borowiec J. Replication Protein A (RPA): The Eukaryotic SSB[J]., 1999, 34(3): 141-180.
[21] Osman K, Sanchez-Moran E, Mann S, Jones G, Franklin F. Replication protein A (AtRPA1a) is required for class I crossover formation but is dispensable for meiotic DNA break repair[J]., 2009, 28(4): 394-404.
[22] Takashi Y, Kobayashi Y, Tanaka K, Tamura K. Arabidopsis replication protein A 70a is required for DNA damage response and telomere length homeostasis[J]., 2009, 50(11): 1965-1976.
[23] Aklilu B, Soderquist R, Culligan K. Genetic analysis of the replication protein A large subunit family inreveals unique and overlapping roles in DNA repair, meiosis and DNA replication[J]., 2014, 42(5): 3104-3118.
[24] Chang Y X, Gong L, Yuan W Y, Li X W, Chen G X, Li X H, Zhang Q F, Wu C Y. Replication Protein A (RPA1a) is required for meiotic and somatic DNA repair but is dispensable for DNA replication and homologous recombination in rice[J]., 2009, 151(4): 2162-2173.
[25] Li X W, Chang Y X, Xin X D, Zhu C M, Li X H, Higgins J, Wu C Y. Replication protein A2c coupled with replication protein A1c regulates crossover formation during meiosis in rice[J]., 2013, 25(10): 3885-3899.
[26] 冯九焕, 卢永根, 刘向东, 徐雪宾. 水稻花粉发育过程及其分期[J]. 中国水稻科学, 2001, 15(1): 22-29.
Feng J H, Lu Y G, Liu X D, Xu X B. Pollen development and its stages in rice (L.)[J]., 2001, 15(1): 22-29. (in Chinese with English abstract)
[27] Zhang D B, Luo X, Zhu L. Cytological analysis and genetic control of rice anther development[J]., 2011, 38(9): 379-390.
[28] Xia R, Wang J G, Liu C Y, Wang Y Q, Zhai J X, Liu J, Hong X H, Cao X F, Zhu J K, Gong Z Z. ROR1/RPA2A, a putative replication protein A2, functions in epigenetic gene silencing and in regulation of meristem development in Arabidopsis[J]., 2006, 18(1): 85-103.
[29] Belanger K, Griffith A, Baker H, Hansen J, Kovacs L, Seconi J, Strine A. The karyopherin Kap95 and the C-termini of Rfa1, Rfa2, and Rfa3 are necessary for efficient nuclear import of functional RPA complex proteins in
[30] Keshav K F, Chen C, Dutta A. Rpa4, a homolog of the 34-kilodalton subunit of the replication protein A complex[J]., 1995, 15(6): 3119-3128.
[31] Zhang J, Han F P. Centromere pairing precedes meiotic chromosome pairing in plants[J]., 2017, 60(11): 1197-1202.
[32] Simonet J, Zick D. Genes involved in caryogamy and meiosis in[J]., 1978, 162(3): 237-242.
[33] Abe A, Kosugi S, Yoshida K, Natsume S, Takagi H, Matsumura H, Yoshida K, Mitsuoka C, Tamiru M. Genome sequencing reveals agronomically important loci in rice using MutMap[J]., 30(2): 174-178.
[34] Ishibashi T, Kimura S, Sakaguchi K. A higher plant has three different types of RPA heterotrimeric complex[J]., 2006, 139(1): 99-104.
Cytological Observation of a Female and Male SterileMutant in Rice and Its Map-based Cloning
ZHANG Taohui1, #, WANG Haiyu1, #, WAN Hua1, ZHANG Liping1, XIE Zhenwei1, CHEN Keyi1, HE Xiaodong1, ZHAO Zhigang1, *, WAN Jianmin1, 2
(1National Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing Agricultural University, Nanjing 210095, China;2Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China;#These authors contributed equally to this work;*Corresponding author, E-mail: zhaozg@njau.edu.cn)
【】The work aims to locate and clone the rice female and male sterile geneby constructing a segregated population and explore its function in the regulation of rice fertility. 【】Stable sterile mutants were obtained by EMS mutagenesis ofrice Ningjing 4, and the phenotypic and cytologicalobservation of the mutant wasconducted. Using map-based cloning and Mut-map methods, the female and male sterile genewas fine-mapped and cloned. The expression pattern ofin various tissues was analyzed by the real-time quantitative PCR technique. Subcellular localization of OsFMA2 protein was performed with the rice protoplast expression system. 【】The cytological observation revealed that themutant was male- and female-sterile, and the extreme individuals were used to locate the gene in a 448-kb interval on the long arm of chromosome 6. The geneis predicted to encode a replication protein that is highly conserved in monocots. The genewas tissue-specific and was highly expressed in young panicles. Subcellular localization analysis showed that the OsFMA2 protein was localized on the nucleus. 【】The geneis highly expressed in young panicles, and it may participate in the homologous recombination of the first meiotic division of male gamete. At the same time, the expression ofalso has an adverse effect on the development of female gametes.
rice; male and female sterility; gene cloning; tissue analysis; subcellular localization
10.16819/j.1001-7216.2022.210312
2021-03-23;
2021-04-22。
国家自然科学基金资助项目(31991224; 31971909; U2002202)。

