小型化PCR仪温度单元优化与实现
李建兴,杨睿宁,蔡 聪,沈 亮,罗 堪
(福建工程学院电子电气与物理学院,福建 福州 350117)
0 引言
1985年,聚合酶链式反应(polymerase chain reaction,PCR[1-2])技术由美国Cetus公司的Kary Mullis发明。此后,其迅速发展成为一种能够广泛应用于扩增特定核酸片段的分子生物学技术[3-5]。PCR仪是通过控制样品DNA在变性、退火与延伸三个步骤按预设的反应流程进行温度循环控制后,将DNA片段成倍扩增的仪器。目前,市场上较为常见的实时定量PCR仪价格昂贵,且大多为固定实验室科研使用。小型化PCR仪的研发对现场应急检测及推进基础医疗点建设有着深远的意义[6]。因此,研发易操作、低成本、高精度的小型化PCR仪是当下的迫切需求。
针对小型化PCR设计,美国宾夕法尼亚大学的Liao[7]等采用全新的基于环介导等温扩增技术 (loop-mediated isothermal amplification,LAMP[8])方案,通过化学发热的方法提供相对恒定的温度环境(60~65 ℃)进行DNA扩增反应。但LAMP方法对引物有较高的要求,且LAMP的灵敏度反而大大低于PCR。VKD Oliveira[9]等为了降低仪器价格并简化温度单元结构,将传统的印刷电路板(printed circuit board,PCB)作为加热元件,使用计算机风扇进行制冷,设备成本约为350元,最大升/降温速率可达到2.0 ℃/s,并可以完成对单个试管内DNA样品的检测。该方案虽然可以大幅降低PCR仪成本,但其温度单元设计方案仅可对单个样品进行反应且控制精度较低。PCR反应体积减小后,更容易受到外界波动的影响。因此,要保证高精确度快速控温,在温度单元优化以及控制算法设计等方面仍需进一步研究。
本文通过对PCR仪温度单元进行小型化设计,并提出有限元结合遗传算法对基座热包覆结构进行优化。采用基于H桥驱动器的分段比例积分微分(proportional integral differential,PID)温度控制方案实现小型化PCR温度循环控制,搭建了图形用户界面(graphic user interface,GUI)以及小型化16孔PCR仪样机。最终通过对样机温度单元性能指标(快速性,即升/降温速率;准确性,即稳态误差;均匀性即基座表面温度均匀性)设计相应试验,测试并验证本文所采取优化方案成效,对该样机性能通过致病疫霉菌DNA扩增试验进行了表征。
1 小型化PCR系统设计
本文设计了一款小型化16孔PCR样机系统。系统架构主要由温度单元、控制器及GUI组成。
系统预制定指标为升/降温速率分别达到2.5 ℃/s与2 ℃/s,稳态误差在±0.4 ℃内且基座试管孔间温度均匀性<0.4 ℃。所设计的小型化PCR温度单元包含了PCR基座、PT1000热电阻、半导体制冷片及散热装置。通过NI myRIO获得PT1000热电阻测得的基座温度,并利用所设计的分段PID控制算法对H桥驱动器脉冲宽度调剂(pulse width modulation,PWM)输入占空比进行整定,实现对半导体制冷片的工作功率及电流方向控制。同时,设计GUI实现对PCR循环参数及控制器参数的设定与实时数据的分析。
小型化PCR样机系统架构如图1所示。
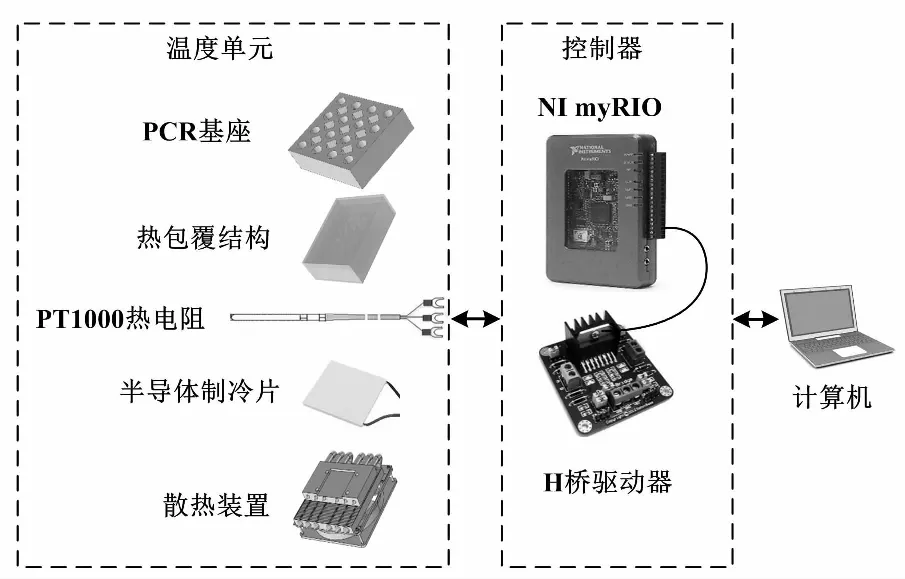
图1 小型化PCR样机系统架构图Fig.1 Miniaturized PCR prototype system architecture diagram
1.1 小型化PCR温度单元设计
小型化PCR仪温度单元设计如图2所示。
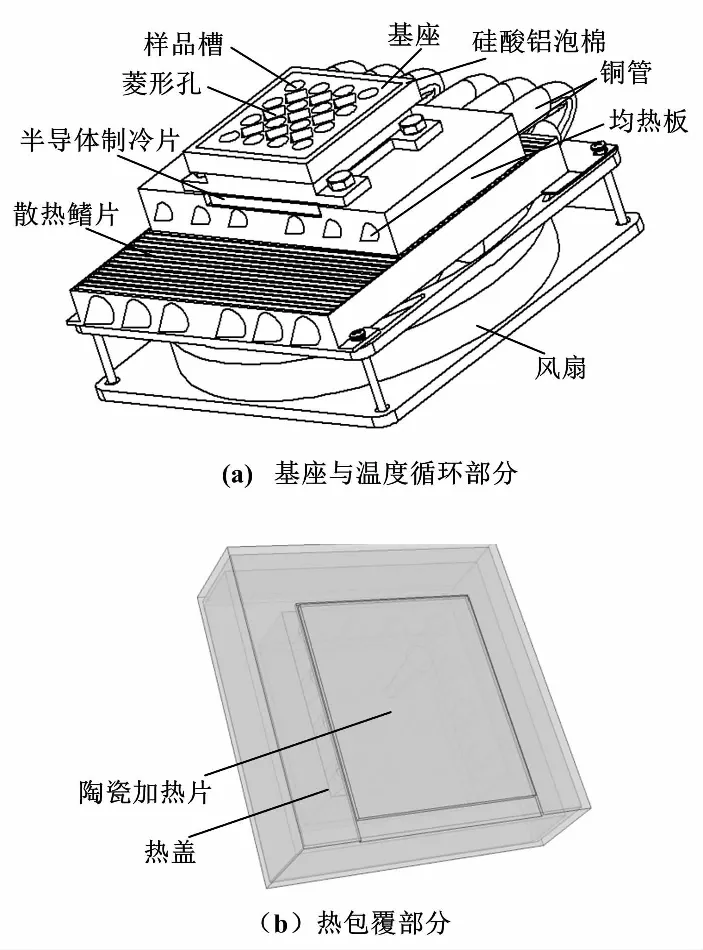
图2 小型化PCR仪温度单元设计Fig.2 Design of miniaturized PCR instrument temperature unit
图2(a)为基座与温度循环部分的3D结构图。该结构总体尺寸为120 mm×120 mm×90 mm,质量为0.5 kg,搭建成本约为600元,外接24 V电源进行工作。PCR仪基座选用传热性能良好、密度小、价格较低的铝合金进行制造,尺寸为40 mm×40 mm×14 mm;于基座侧壁中开相应孔位,安装PT1000热电阻;反应槽根据0.2 mL标准PCR反应试管尺寸进行设计,采用4×4阵列均匀分布于基座上表面,且反应槽之间对称分布着尽可能大的菱形孔,以减小其体积及质量、获得更小的热容,最终使温度单元的快速性得到提升。本系统选用由广东偲瑞电子科技有限公司所研发的THC1-19912半导体作为执行元件。其最大工作功率为130 W,额定最高温度为200 ℃,尺寸为40 mm×40 mm×3.5 mm(与基座尺寸一致),可避免因使用多片半导体制冷片所带来的匹配误差。半导体制冷片的制冷效率取决于其冷热端温度差,而高性能的散热装置[10]将对制冷速率的提升发挥关键作用。本文根据制冷片尺寸设计一鳍片式热管散热器,通过将制冷片热量经均热板由六根铝制热管快速传递至高密度铝制散热鳍片中,由下方转速约为1 600 r/min的风扇强制对流实现快速散热。温度单元之间各相应传热单元间均需涂抹导热硅脂,以确保传热效率。
本文所设计的基座热包覆部分结构如图2(b)所示。热盖是防止试管内试剂反应过程中蒸发后遇冷再液化,对其温度控制精度要求不高。因此,本文通过在铝制热盖表面开凹槽放置空烧表面温度稳定在约105 ℃陶瓷加热片可满足样机反应需求。为提升所设计的小型化PCR温度单元内部环境稳定性,使仪器可面向更多工作场景,应杜绝温度单元与外部对流换热[11]。本文通过在基座侧壁包覆硅酸铝棉作为保温材料,并令热盖覆盖于保温材料四周,构建稳定热场。但如基座热包覆结构厚度选取不适,反而会导致温度单元动态性能变差。因此,需要对其进行优化。
1.2 基座热包覆优化
为得到最优基座热包覆厚度,传热计算分析难以得到精确的结果,而采用试验逐一测量将产生过大的时间成本与资源浪费。为此,本文采用有限元仿真结合遗传算法,对基座热包覆厚度进行参数寻优,并使用有限元软件Comsol Multiphysics对本系统所设计的温度单元建立相应的有限元模型。PCR温度单元与包覆保温材料属性如表1所示。
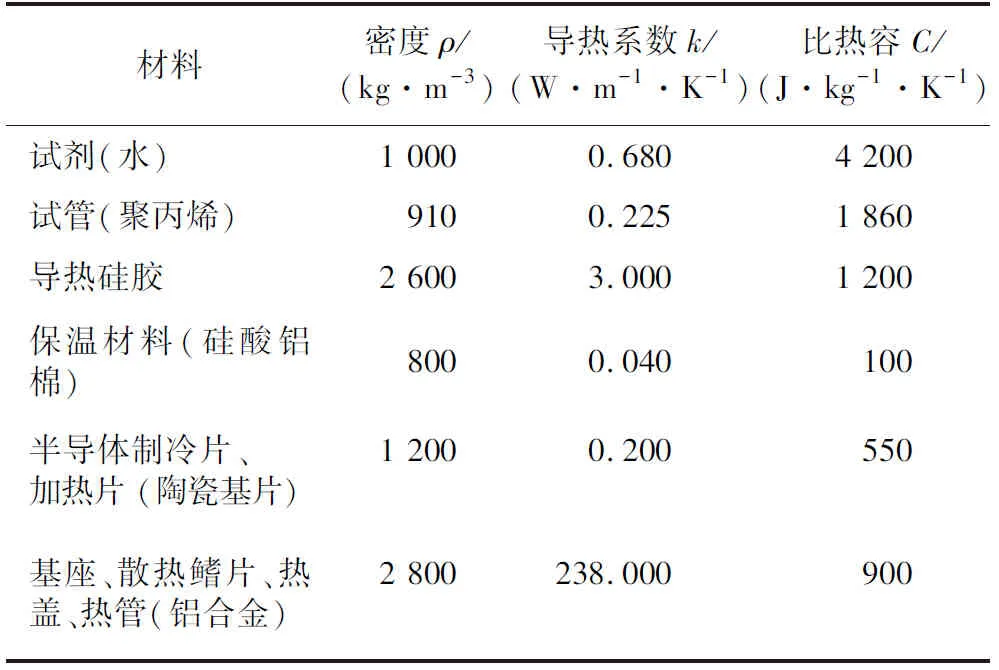
表1 PCR温度单元与包覆保温材料属性
通过小型化PCR温度单元性能指标 (快速性:升/降温速率vup、vdown;准确性,即稳态误差△Tw;均匀性,即基座上表面中心温度减去基座上表面边缘温度差△Tb)制定相应适应度函数ξ,如式(1)所示。各系数对应权重根据系统预制定指标比例进行修正。
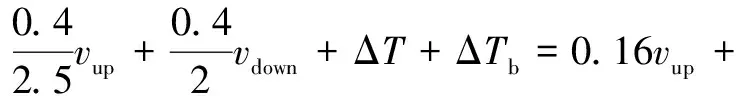
0.2vdown+ΔTw+ΔTb
(1)
通过使用有限元软件COMSOL Multiphysics中的MATLAB接口构建温度单元有限元模型,并使用内置遗传算法工具箱[12]完成对基座热包覆结构厚度的优化。遗传算法优化流程如图3所示。
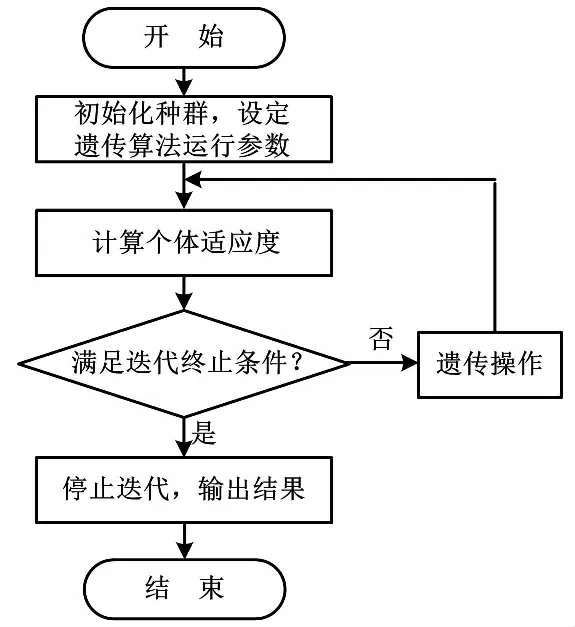
图3 遗传算法优化流程图Fig.3 Genetic algorithm optimization flowchart
设置种群大小为20、最大迭代次数为100,并将预制定指标vup≥2.5、vdown≤2、ΔTw≤0.4、ΔTb≤0.4作为约束条件,以1 mm步长在0~100 mm间进行仿真求解运算。最终得到的最优热包覆厚度为19 mm,其适应度函数值为1.207 97。
1.3 分段PID温度控制策略与实现
PCR反应的实质是根据预设循环过程使样品DNA在变性(94 ℃)、退火(55 ℃)、延伸(72 ℃)三温区进行循环控制。温度控制的精确性和稳定性不足会导致扩增效率降低、非特异性扩增等问题,从而影响试验结果。而升温和降温速率若过慢,会导致整个PCR过程的反应时间大大延长。这在现场快速检测等应用场合是不能被接受的。本文通过控制H桥驱动器PWM输入与占空比D,实现对PCR温度单元温度循环的控制,完成对半导体制冷片电流方向及工作功率控制的过程。因此,本文根据所设计的PCR温度单元特性,对工程实际中广泛应用的PID控制方法进行改进。本文设计的小型化PCR分段PID控制原理如图4所示。
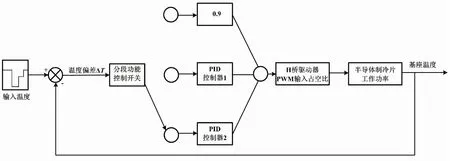
图4 小型化PCR分段PID控制原理图Fig.4 Schematic diagram of miniaturized PCR segmented PID control
本文基于半导体制冷片工作原理,设置分段控制功能开关。其工作原理是:当循环过程中输入温度与PT1000测得温度误差ΔT在2 ℃内时切换到升/降温PID控制器,其余时间令H桥驱动器PWM输入占空比D为0.9,即此时半导体制冷片以90%最大工作功率进行工作,从而获得更快的升/降温速率。由于半导体制冷片升/降温最大工作功率存在差别,因此需要对升/降温过程进行控制器切换。此时采用的PID控制规律如式(2)所示。
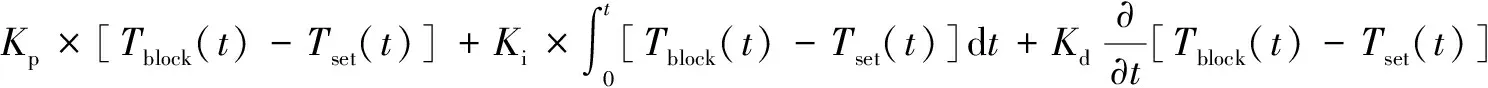
(2)
式中:Kp、Ki、Kd分别为比例、积分、微分参数;Tblock为PT1000测得基座实时温度;Tset为设定温度。
2 试验与样机性能测试
基于上述设计工作,完成小型化16孔PCR系统的样机搭建,并设计相应的GUI界面。样机通过USB连接到计算机,可外接24 V电源进行工作。用户可通过GUI完成对PCR循环及控制参数的设定,并可对运行过程中实时数据进行导出分析。通过设计结合有限元仿真温度场与红外热成像仪测试样机实时热场对比、试管内50 μL试剂实时温度测试、小鼠基因组鉴定等试验,分别对样机优化后温度单元性能指标、样机性能进行验证。
2.1 优化模型准确性验证
对基座热包覆优化前后的有限元模型进行仿真。基座变性(94 ℃)仿真稳态热场如图5所示。优化前,基座表面最高温为93.733 ℃、最低温为92.845 ℃。通过对基座热包覆进行优化设计,最高温为94.022 ℃、最低温为93.835 ℃。该结果表明,优化设计后样机温度单元均匀性及稳定性均得到大幅提升。

图5 基座变性(94 ℃)仿真稳态热场图Fig.5 Steady-state thermal field diagram of basedenaturation (94 ℃) simulation
使用Flir E6-xt红外热成像仪,对样机在相同参数下优化前后的情况进行采集。基座变性(94 ℃)样机稳态热场如图6所示。

图6 基座变性(94 ℃)样机稳态热场图Fig.6 Steady-state thermal field diagram of base denatured(94 ℃) prototype
基于所测得优化前后各孔温度与设定值94 ℃的方差进行计算,结果分别为1.379 3与 0.006 2,孔内温度与设定值偏离程度得到大幅降低,且基座稳态热场图与图5有限元仿真结果基本一致。该结果表明,本文所构建的温度单元有限元模型及优化方法是正确且能够有效提升温度单元性能指标的。
2.2 试剂温度性能指标验证
本文通过用移液枪加入50 μL水代替试剂,在0.2 mL标准试管盖处开孔插入PT1000热电阻测量试管内液体温度。循环过程中,94 ℃、55 ℃和72 ℃这3个温区的维持时间分别设置为30 s、30 s和60 s。循环试管内液体温度曲线如图7所示。
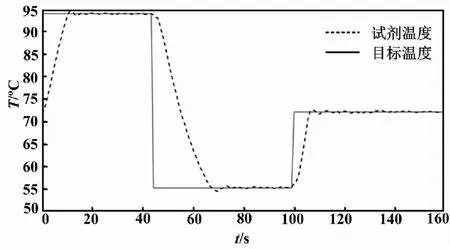
图7 循环试管内液体温度曲线Fig.7 Circulating liquid temperature curves in test tube
该结果表明,样机试管内液体稳态误差可保持在±0.2 ℃,与有限元分析及红外热场结果相对应。升/降温速率分别可达到2.7 ℃/s及2.2 ℃/s,仅需170 s即可完成一次循环,符合预制定指标且能大幅缩短PCR反应所需时间。
2.3 致病疫霉菌DNA扩增试验
为验证样机性能,本文在该样机分别放置15个装有20 μL小鼠DNA样本进行基因组鉴定,并在反应完成后进行凝胶电泳。样机凝胶电泳结果如图8所示。该结果表明,15份DNA样品在琼脂糖凝胶上均有显示亮带,证明所开发样机可成功实现对DNA样品的扩增与鉴定,为该样机的后续实时化以及商业化开发奠定坚实的基础。
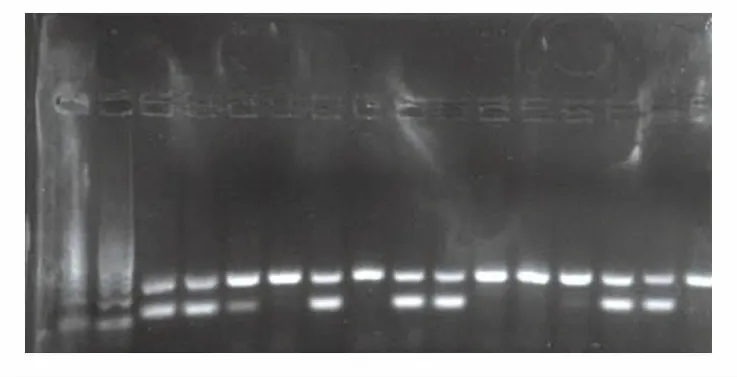
图8 样机凝胶电泳结果示意图Fig.8 Sample gel electrophoresis results
3 结论
本文针对所设计的小型化PCR仪温度单元进行热包覆结构优化,采用基于H桥驱动器的分段PID控制方法,搭建了GUI以及16孔PCR仪样机。样机温度单元成本约600元,可外接24 V电源进行工作。该样机在50 μL反应体系下升/降温速率可分别达到2.7 ℃/s及2.2 ℃/s,稳态误差小于±0.2 ℃,基座表面温度均匀性小于0.1 ℃,并可成功对小鼠基因组DNA样品完成鉴定。该结果表明,本文所研发的小型化PCR仪样机具有低成本、便携带、易操作、高性能的特点,能够为后续实时化和商业化的开发奠定基础,并对现场快速检测与推进基础医疗点建设提前部署作好应急准备。

