栀子中环烯醚萜类成分抗阿尔茨海默病的作用机制研究进展
付庆 单淇 周钰通 杨冰 岳钰茗 蒋沅岐 周福军

摘 要 阿尔茨海默病(AD)是一种常见的隐匿性神经退行性疾病,以认知障碍、学习和记忆功能损失、行为能力反常、痴呆等为主要特征,目前尚无特效药物能够有效阻止或逆转AD。栀子为茜草科栀子属植物栀子Gardenia jasminoides J. Ellis的干燥成熟果实,化学成分主要包括环烯醚萜类、三萜类、有机酸类和挥发油类,其中环烯醚萜类为栀子的主要活性成分。本文就近年来国内外对栀子环烯醚萜类成分抗AD的作用机制研究进行梳理归纳,以期为抗AD的新药开发提供参考。
关键词 阿尔茨海默病;栀子;环烯醚萜类;京尼平苷;作用机制
中图分类号 R965 文献标志码 A 文章编号 1001-0408(2022)01-0123-06
DOI 10.6039/j.issn.1001-0408.2022.01.21
ABSTRACT Alzheimers disease (AD) is a common latent neurodegenerative disease, which is characterized by cognitive impairment, loss of learning and memory function, abnormal behavior and dementia. At present, there is no specific drug to effectively prevent or reverse AD. Gardenia jasminoides is the dried and mature fruit of G. jasminoides J. Ellis, a gardenia plant in Rubiaceae. Its chemical components mainly include iridoids, triterpenoids, organic acids and volatile oils, among which iridoids are the main active components of G. jasminoides. This paper summarizes the researches on the mechanism of iridoids from G. jasminoides against AD at home and abroad in recent years, in order to provide reference for the development of new drugs against AD.
KEYWORDS Alzheimers disease; Gardenia jasminoides; iridoids; geniposide; mechanism
阿尔茨海默病(Alzheimers disease,AD)是一种常见的隐匿性中枢神经系统退行性疾病,临床上以认知障碍、学习和记忆功能损失、行为能力反常、痴呆等为主要特征,最终可使患者生活自理能力完全丧失,严重危害患者的身心健康和生活质量[1]。AD多发于65岁以上的老年人,随着社会老龄化人口的增多,AD患者的数量也呈上升趋势,且病程随年龄的增长呈缓慢进行性加重[2]。相关研究表明,AD的病理特征主要包括β淀粉样蛋白(beta-amyloid protein,Aβ)在海马区和大脑皮层大量沉积形成老年斑、Tau蛋白过度磷酸化聚集形成神经元内神经纤维缠结、特定脑区的神经元和突触丢失、小胶质细胞活化、线粒体功能障碍等[3]。由此,关于AD的发病机制主要存在着4种假说:基于淀粉样物质沉积形成斑块的Aβ假说,基于Tau蛋白异常磷酸化形成神经元纤维缠结的Tau假说,基于长期炎症反应造成脑损伤的炎症假说,基于突触功能失调及神经元死亡的神经保护假说[4]。目前临床上用于治疗AD的主要药物是抗胆碱酯酶药,例如卡巴拉汀、多奈哌齐和加兰他敏等,这些药物可通过增加突触间隙乙酰胆碱含量,来改善轻中度AD患者的认知功能、日常行为能力和精神状态[5]。但目前仍无特效药物能够有效阻止或逆转AD。
中药化学成分复杂,具有多靶点、多通路等特点。栀子为茜草科栀子属植物栀子Gardenia jasminoides J.Ellis的干燥成熟果实,最早记载于《神农本草经》,其性寒、味苦,归心、肺、三焦经,具有泻火除烦、清热利湿、凉血解毒、消肿止痛的功效,可用于治疗湿热黄疸、淋证涩痛、血热吐衄、目赤肿痛、火毒疮疡、扭挫伤痛等症[6]。栀子的化学成分主要包括环烯醚萜类、三萜类、有机酸类和挥发油类,其中环烯醚萜类为栀子的主要活性成分[7-8]。目前多项研究表明,栀子中环烯醚萜类成分对AD具有良好的治疗作用,但尚无文献对此进行概括。基于此,笔者查阅相关文献,对栀子中环烯醚萜类成分抗AD的作用机制进行归纳总结,以期为抗AD的新药开发提供参考。
1 栀子中环烯醚萜类成分
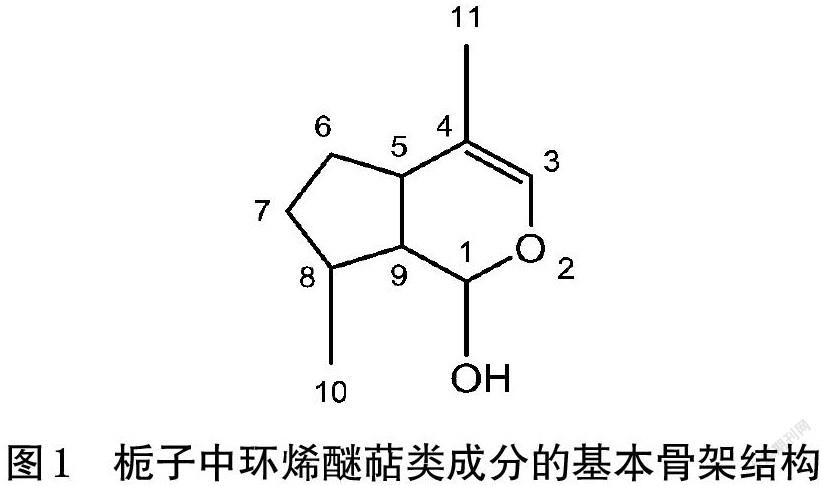
栀子中环烯醚萜类成分多具有半缩醛和环戊烷环的结构,其基本骨架见图1;部分此类成分信息见表1。
2 栀子中环烯醚萜类成分抗AD的作用机制
2.1 抑制Aβ的沉积
Aβ是由Aβ前体蛋白被γ-分泌酶和β-分泌酶1水解后所形成的,主要以Aβ1-42蛋白的形式存在;Aβ的沉积具有多种毒性作用,可诱导线粒体功能异常、膜结构损伤、大脑神经突触功能减弱、神经细胞凋亡[27-28]。向绍通等[29]采用侧脑室微量注射Aβ25-35诱导建立大鼠AD模型,然后以京尼平苷進行干预。结果显示,在Morris水迷宫实验中,与模型组相比,京尼平苷可显著缩短大鼠的逃避潜伏期,增加其穿越平台的次数及停留时间;进一步的研究发现,京尼平苷可通过改善大鼠神经元结构,抑制大鼠海马区Aβ的沉积;此外,其还可显著上调大鼠海马区组织磷酸化激活的细胞外调节蛋白激酶、核因子相关因子2和B细胞淋巴瘤因子2(B-cell lymphoma factor 2,Bcl-2)的表达,下调Bcl-2相关X蛋白的表达。研究发现,京尼平可保护大鼠海马原代神经元不受Aβ沉积、氧化应激等诱导的细胞毒性的影响[30]。董璐萌[31]研究了栀子乙醇提取物中的总环烯醚萜苷对AD模型小鼠的改善作用,结果发现,总环烯醚萜苷能显著缩短小鼠的逃避潜伏期,增加其在平台上的停留时间;进一步研究发现,总环烯醚萜苷能显著下调AD 模型小鼠Aβ1-42、Tau S396蛋白以及糖原合成酶激酶(glycogen synthase kinase-3,GSK-3β)的表达水平,上调抗凋亡蛋白Bcl-2的表达水平,进而发挥改善AD的作用。黄家情等[32]采用尾静脉注射链脲佐菌素建立小鼠AD模型,并以低、高剂量京尼平苷(25、50 mg/kg)进行干预。结果发现,低、高剂量京尼平苷均可显著下调小鼠海马组织中磷酸化GSK-3β蛋白的表达水平,从而抑制Aβ的沉积,进而发挥抗AD的作用。
2.2 抑制Tau蛋白的过度磷酸化
Tau蛋白是脑神经元中的一种微管相关蛋白,对维持神经系统的稳态具有重要意义,Tau蛋白受各种因素的影响可发生过度磷酸化,从而形成神经元纤维缠结,导致神经元连接缺失[33]。相关研究发现,Aβ和Tau蛋白可发生相互作用,Aβ的沉积会使Tau蛋白从正常态转向病变态,而病变态的Tau蛋白又反向促进 Aβ的沉积,进而促使神经元变性[34]。董璐萌[31]研究发现,京尼平苷可抑制Tau蛋白的过度磷酸化,从而减少神经元纤维缠结,进而抑制神经元的凋亡和炎症反应。刘东星等[28]采用MTT法、Western blot法研究京尼平苷对Aβ1-42诱导的神经母细胞瘤SH-SY5Y细胞(一种常用的AD细胞模型)的保护作用及机制。结果显示,当京尼平苷浓度为20 μmol/L时,SH-SY5Y细胞的存活率最高,且与模型组相比具有统计学差异;进一步的研究发现,京尼平苷能通过促进自噬相关蛋白(Atg7、Beclin1)及磷酸化蛋白激酶B、磷酸化哺乳动物雷帕霉素靶蛋白的表达,从而促进细胞自噬,减少Tau蛋白的过度磷酸化,进而发挥抗AD的作用。
2.3 抑制神经炎症的产生
2.3.1 抑制小胶质细胞的过度激活 小胶质细胞是中枢神经系统的免疫细胞,也是中枢神经系统中炎症反应的主要参与者,具有维持机体稳态和免疫防御的作用:当其被激活时,可极化为 M2 型,释放神经营养因子及抗炎因子,加快对坏死组织的清除速度,从而修复中枢神经系统中的受损组织;但当其过度激活时,则会极化为 M1型,使得促炎因子和细胞毒性物质的分泌增多,从而造成神经元非特异性损伤,进而导致AD[35]。相关研究发现,当小胶质细胞过度激活时,会激活星形胶质细胞的神经毒性,促进Tau蛋白的过度磷酸化,从而损伤神经元[36]。王筠等[37]研究发现,京尼平苷能通过促进转化生长因子β表达和抑制肿瘤坏死因子α(tumor necrosis factor α,TNF-α)表达,来抑制小胶质细胞的过度激活,进而保护神经元,延缓AD的进展。吴杰等[38]研究发现,京尼平苷可促进M1型小胶质细胞向M2型极化,从而促进神经营养因子的释放,增强吞噬功能,加快坏死组织的清除,进而修复中枢神经系统中的受损组织,发挥改善AD的作用。相关研究发现,京尼平苷能通过下调Toll样受体4(Toll-like receptor 4,TLR4)蛋白表达,抑制TLR4/核因子κB p65信号通路活性,从而抑制小胶质细胞的炎症反应,减少炎症因子的产生,进而减缓AD的进展[39-40]。Nam等[41]研究发现,京尼平能有效抑制小胶质细胞释放一氧化氮(nitric oxide,NO),减少细胞中白细胞介素1β(interleukin-1β,IL-1β)、TNF-α、前列腺素E2的产生,从而发挥抗AD的作用。
2.3.2 促进细胞自噬 自噬是基因调控真核细胞降解异常细胞器、蛋白质的自我清理过程,对维持细胞稳态具有重要意义[42]。AD本身可形成多种异常蛋白质(如Tau、Aβ),故促进细胞自噬对AD的改善具有重要作用[43]。相关研究发现,脑组织中的 Aβ可通过自噬溶酶体途径进行降解,且该途径对Tau 蛋白的清除也具有重要作用[44-45]。
p62是由SQSTM1基因编码的衔接子,对中枢自噬信号的转导具有重要作用[46]。张志华[47]采用京尼平苷对双转基因(APP/PS1)AD模型小鼠进行干预,结果显示,京尼平苷可通过上调自噬相关蛋白LC3-Ⅱ、Beclin1的表达水平,下调与自噬呈负相关的p62蛋白表达水平,进而促进自噬细胞对Tau蛋白、Aβ的降解和清除。Fu等[48]通过建立小胶质细胞缺氧-葡萄糖剥夺/复氧模型,并以京尼平苷进行干预,结果发现,京尼平苷能促进小胶质细胞的自噬作用,从而降解和清除异常蛋白,表明其具有抗AD的潜力。
2.3.3 抑制炎癥因子的产生 相关研究发现,神经炎症对AD具有重要影响[49]。Aβ沉积会激活神经胶质细胞释放促炎因子,如IL-6、TNF-α和NO等,进而损伤周围神经元,引起突触丢失和细胞凋亡,最终导致学习记忆功能受损,提示减轻炎症反应对AD的改善具有重要作用[50]。
Zhou等[51]通过氧化低密度脂蛋白诱导内皮细胞产生炎症反应,并以京尼平苷进行干预,结果显示,京尼平苷能下调促炎因子(如IL-1β、IL-6和TNF-α)的表达水平,上调抗炎因子(如IL-10)的表达水平,进而减轻氧化低密度脂蛋白诱导的炎症反应,表明京尼平苷抗AD的作用可能与减轻炎症反应有关。Li等[52]研究发现,京尼平苷可通过减轻氧化应激损伤和抑制炎症因子的释放,增加脑源性神经营养因子和胶质细胞源性神经营养因子的释放,进而保护神经元细胞,改善学习记忆能力,发挥改善AD的作用。Fan等[53]研究发现,京尼平可通过抑制促炎因子、炎症小体的产生,来发挥抗AD的作用。Yu等[54]研究发现,京尼平能通过抑制炎症小体的活性,来抑制IL-1β的产生,从而发挥抑制炎症反应的作用,表明其具有抗AD的潜力。
2.4 保护中枢神经系统
2.4.1 增强突触的可塑性 突触是神经元信息传递的关键部位,是中枢神经系统的基本结构,对神经元之间信号的产生、传递和整合具有重要作用;当其丢失,则意味着神经递质的储存、释放、再摄取的功能丧失,进而导致信息中断、转导受阻以及神经功能紊乱[55]。谭雪等[56]研究发现,突触丢失的程度与AD患者认知功能的下降具有显著相关性。李娇[57]研究发现,京尼平苷可通过显著增加AD模型小鼠海马CA1区锥体细胞顶部和基部树突棘密度,减少成熟型树突棘的丢失,改善模型小鼠树突棘丢失的病理改变,进而发挥抗AD的作用。Lv等[58]研究京尼平苷对AD模型小鼠神经炎症和记忆缺陷的保护作用,结果发现,京尼平苷可通过增强突触的可塑性,进而改善模型小鼠的记忆和认知能力。Chen等[59]研究发现,京尼平苷可通过上调微管相关蛋白 2和生长相关蛋白 43的表达,促进小鼠脑神经母细胞瘤细胞神经突起的增长,从而发挥保护神经细胞的作用,进而发挥抗AD的作用。
2.4.2 增强胆碱能的传递作用 中枢胆碱神经系统是人体神经系统最主体的部分,与思维活动、学习和记忆能力密切相关;乙酰胆碱是重要的兴奋性神经递质,具有促进智力发育的作用,广泛分布于外周和中枢神经系统,可被体内的乙胆碱酯、丁酰胆碱酯酶破坏,进而影响神经系统的兴奋性[60-61]。目前临床上主要用抗胆碱酯酶药来增加突触间隙乙酰胆碱的含量,从而改善轻中度AD患者的认知功能、日常行为能力和精神状态[5]。王旭等[62]研究发现,京尼平苷可显著增加AD模型小鼠体内乙酰胆碱的含量,从而改善模型小鼠的空间学习和记忆能力。Kwak等[63]研究发现,栀子甲醇提取物中的糖苷类化合物对记忆障碍模型小鼠具有显著的改善作用。进一步的研究发现,栀子甲醇提取物中有9种环烯醚萜类成分具有抗乙酰胆碱酯酶的活性,其中,京尼平龙胆二糖苷的活性最强,其余8种化合物按活性大小排序依次为京尼平苷酸>京尼平苷>鸡屎藤次苷甲酯>栀子酮苷>山栀子苷>去乙酰车叶草苷酸甲酯>6-甲氧基去乙酰车叶草苷酸甲酯。
2.5 促进胰高血糖素样肽1的生成
相关研究发现,2型糖尿病已被证实是诱发AD的一个重要因素,在AD模型小鼠中,胰高血糖素样肽1(lucagon like peptide 1,GLP-1)能够有效抑制淀粉样物质堆积,进而改善突触、神经元和认知功能[64]。张永兰[65]采用高通量筛选的方法,发现并证实了京尼平苷是一种GLP-1受体激动剂,能够通过激活GLP-1受体,调节胰岛素降解酶的表达,从而抑制Aβ的代谢和Tau蛋白的磷酸化,进而发挥改善AD的作用。Zhao等[66]研究发现,京尼平苷能通过促进GLP-1/蛋白激酶B信号通路相关蛋白的表达,抑制神经元细胞的凋亡,从而发挥对神经细胞的保护作用,进而发挥抗AD的作用。
2.6 其他
相关研究发现,栀子中环烯醚萜类成分6′-O-trans- p-coumaroylgeniposide、10-O-succinoylgeniposide、6′-O- acetylgeniposide 可不同程度地改善果蝇短期记忆能力,其中6′-O-trans-p-coumaroylgeniposide、6′-O-acetylgeniposide的改善作用较强,提示上述3种环烯醚萜类成分具有抗AD的潜力[14]。Zhang等[10]研究发现,6α-甲氧基京尼平具有显著的抗氧化活性,可减轻氧化应激损伤和脑损伤,提示该成分具有抗AD的潜力。
3 结语
AD病因复杂,目前仍不明确其发病机制,故明确AD的作用机制及寻找治疗AD的药物势在必行。近年来,国内外研究人员利用细胞和动物模型对栀子中环烯醚萜类成分治疗AD的作用机制进行了多方面探讨,并取得了一定进展,但关于栀子中环烯醚萜类成分系统的成药性研究仍较少,故应进一步加强对该类成分的深入研究,以期为抗AD的新药开发提供参考。
参考文献
[ 1 ] CAPPAI R. ‘From past to future-deciphering the mole- cular basis of Alzheimers disease through the pages of the Journal of Neurochemistry[J]. J Neurochem,2016,139:215-223.
[ 2 ] 何冠楠.中国的老龄化趋势下阿尔兹海默症发病情况与预防[J/OL].临床医药文献电子杂志,2016,3(40):8083- 8084.[2021-07-26]. http://kns.cnki.net/kns8/defaultresult/index.
[ 3 ] WANG X L,QI Y Y,ZHOU X,et al. Alteration of scaffold:possible role of MACF1 in Alzheimers disease pathogenesis[J]. Med Hypotheses,2019,130:109259.
[ 4 ] 畢丹蕾,文朗,熊伟,等.阿尔茨海默病的可能药物靶点和临床治疗研究进展[J].中国药理学与毒理学杂志,2015,29(4):507-536.
[ 5 ] 张兰.阿尔茨海默病治疗药物临床应用及新药研发进展[J].中国药理学与毒理学杂志,2019,33(6):407.
[ 6 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社出版,2020:121.
[ 7 ] 王立,潘海鸥,钱海峰,等.栀子中京尼平苷及藏红花素的神经保护作用研究进展[J].中草药,2017,48(12):2564- 2571.
[ 8 ] 蔡财军,张忠立,左月明,等.栀子环烯醚萜类化学成分研究[J].时珍国医国药,2013,24(2):342-343.
[ 9 ] SHU P H,YU M Z,ZHU H Q,et al. Two new iridoid glycosides from Gardeniae Fructus[J]. Carbohydr Res,2021,501:108259.
[10] ZHANG H,FENG N,XU Y T,et al. Chemical constituents from the flowers of wild Gardenia jasminoides J. Ellis[J]. Chem Biodivers,2017,14(5):e1600437.
[11] SONG J L,WANG R,SHI Y P,et al. Iridoids from the flowers of Gardenia jasminoides Ellis and their chemota- xonomic significance[J]. Biochem Syst Ecol,2014,56:267-270.
[12] AKIHISA T,WATANABE K,YAMAMOTO A,et al. Melanogenesis inhibitory activity of monoterpene glycosides from Gardeniae Fructus[J]. Chem Biodivers,2012,9(8):1490-1499.
[13] YU Y,FENG X L,GAO H,et al. Chemical constituents from the fruits of Gardenia jasminoides Ellis[J]. Fitoterapia,2012,83(3):563-567.
[14] YU Y,XIE Z L,GAO H,et al. Bioactive iridoid glucosides from the fruit of Gardenia jasminoides[J]. J Nat Prod,2009,72(8):1459-1464.
[15] CHEN Q C,ZHANG W Y,YOUN U,et al. Iridoid glycosides from Gardeniae Fructus for treatment of ankle sprain[J]. Phytochemistry,2009,70(6):779-784.
[16] CHANG W L,WANG H Y,SHI L S,et al. Immunosuppressive iridoids from the fruits of Gardenia jasminoides[J]. J Nat Prod,2005,68(11):1683-1685.
[17] LELONO R A A,TACHIBANA S,ITOH K. Isolation of antifungal compounds from Gardenia jasminoides[J]. Pak J Biol Sci,2009,12(13):949-956.
[18] 畢志明,周小琴,李萍,等.栀子果实的化学成分研究[J]. 林产化学与工业,2008,28(6):67-69.
[19] KIM H J,KIM E J,SEO S H,et al. Vanillic acid glycoside and quinic acid derivatives from Gardeniae Fructus[J]. J Nat Prod,2006,69(4):600-603.
[20] 马金凤.中药栀子主要化学成分研究[D].广州:暨南大学,2019.
[21] MACHIDA K,TAKEHARA E,KOBAYASHI H,et al. Studies on the constituents of Gardenia species. Ⅲ. New iridoid glycosides from the leaves of Gardenia jasminoides cv. fortuneana Hara[J]. Chem Pharm Bull (Tokyo),2003,51(12):1417-1419.
[22] CHEN Q C,YOUN U,MIN B S,et al. Pyronane monoterpenoids from the fruit of Gardenia jasminoides[J]. J Nat Prod,2008,71(6):995-999.
[23] 李海波,马金凤,庞倩倩,等.栀子的化学成分研究[J].中草药,2020,51(22):5687-5697.
[24] FU X M,CHOU G X,WANG Z T. Iridoid glycosides from Gardenia jasminoides Ellis[J]. Helvetica Chimica Acta,2008,91(4):646-653.
[25] INOUYE H,TAKEDA Y,NISHIMURA H. Two new iridoid glucosides from Gardenia jasminoides fruits[J]. Phytochemistry,1974,13(10):2219-2224.
[26] SHAN M Q,WANG T J,JIANG Y L,et al. Comparative analysis of sixteen active compounds and antioxidant and anti-influenza properties of Gardenia jasminoides fruits at different times and application to the determination of the appropriate harvest period with hierarchical cluster analysis[J]. J Ethnopharmacol,2019,233:169-178.
[27] ZHANG H,ZHENG Y. Β amyloid hypothesis in Alzhei- mers disease:pathogenesis,prevention,and management[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao,2019,41(5):702-708.
[28] 刘东星,胡为民,刘越泽,等.京尼平苷对Aβ1-42诱导的SH-SY5Y细胞的保护作用及相关机制研究[J].现代中西医结合杂志,2019,28(33):3654-3657,3680.
[29] 向绍通,徐书雯,肖豪,等.栀子苷通过ERK1/2-Nrf2通路发挥对Aβ25-35诱导的阿尔兹海默病大鼠模型的神经保护作用[J].华中科技大学学报(医学版),2018,47(1):27-32,37.
[30] YAMAZAKI M,CHIBA K,YOSHIKAWA C. Genipin suppresses A23187-induced cytotoxicity in neuro2a cells[J]. Biol Pharm Bull,2009,32(6):1043-1046.
[31] 董璐萌.中药栀子对APP/PS1/Tau三转基因阿尔茨海默症小鼠药理活性研究[D].遵义:遵义医学院,2018.
[32] 黄家情,闻妩,吕馨,等.栀子苷对尾静脉注射链脲佐菌素引起的痴呆样小鼠的保护作用[J].中国新药杂志,2021,30(12):1103-1109.
[33] C?RDENAS-AGUAYO M,G?MEZ-VIRGILIO L,DEROSA S,et al. The role of tau oligomers in the onset of Alzhei- mers disease neuropathology[J]. ACS Chem Neurosci,2014,5(12):1178-1191.
[34] BLOOM G S. Amyloid-β and tau:the trigger and bullet in Alzheimer disease pathogenesis[J]. JAMA Neurol,2014,71(4):505-508.
[35] 刘冉,王华林,李炬,等.小胶质细胞活化在运动延缓AD发病中的作用研究进展[J].生命科学,2021,33(9):1104-1110.
[36] HANSEN D V,HANSON J E,SHENG M. Microglia in Alzheimers disease[J]. J Cell Biol,2018,217(2):459- 472.
[37] 王筠,侯金才,向麗华,等.栀子苷与人参皂苷Rg1配伍对缺氧诱导损伤小鼠小胶质细胞炎症因子分泌的平衡调节作用[J].中国中西医结合杂志,2014,34(1):91-95.
[38] 吴杰.黄芩苷、栀子苷及其配伍调控缺血性脑卒中后小胶质细胞M1/M2分化发挥神经元保护作用[D].咸阳:陕西中医药大学,2020.
[39] 赖根祥,朱桂东,何慧明.栀子苷通过抑制TLR4/NF-κB信号通路减轻睡眠剥夺大鼠认知功能障碍[J].中国病理生理杂志,2020,36(10):1810-1817.
[40] 蔡智慧,吴琼,王晋,等.栀子苷下调Toll样受体4表达并拮抗脂多糖诱导的小胶质细胞炎性反应[J].解剖学杂志,2017,40(5):549-552.
[41] NAM K N,CHOI Y S,JUNG H J,et al. Genipin inhibits the inflammatory response of rat brain microglial cells[J]. Int Immunopharmacol,2010,10(4):493-499.
[42] SETTEMBRE C,FRALDI A,MEDINA D L,et al. Signals from the lysosome:a control centre for cellular clea- rance and energy metabolism[J]. Nat Rev Mol Cell Biol,2013,14(5):283-296.
[43] BERGER Z,RAVIKUMAR B,MENZIES F M,et al. Rapamycin alleviates toxicity of different aggregate-prone proteins[J]. Hum Mol Genet,2006,15(3):433-442.
[44] HWANG S K,KIM H H. The functions of mTOR in ische- mic diseases[J]. BMB Rep,2011,44(8):506-511.
[45] MORSELLI E,MAIURI M C,MARKAKI M,et al. Calo- ric restriction and resveratrol promote longevity through the Sirtuin-1-dependent induction of autophagy[J]. Cell Death Dis,2010,1(1):e10.
[46] MOSCAT J,KARIN M,DIAZ-MECO M T. p62 in cancer:signaling adaptor beyond autophagy[J]. Cell,2016,167(3):606-609.
[47] 张志华.京尼平苷对APP/PS1小鼠行为学损伤和病理变化的保护作用及分子机制:抑制mTOR信号通路增强自噬的研究[D].太原:山西医科大学,2019.
[48] FU C,ZHANG X Y,LU Y,et al. Geniposide inhibits NLRP3 inflammasome activation via autophagy in BV-2 microglial cells exposed to oxygen-glucose deprivation/reoxygenation[J]. Int Immunopharmacol,2020,84:106547.
[49] BRAIDY N,ESSA M M,POLJAK A,et al. Consumption of pomegranates improves synaptic function in a transge- nic mice model of Alzheimers disease[J]. Oncotarget,2016,7(40):64589-64604.
[50] 杜会枝.斯皮诺素通过减轻炎症改善阿尔茨海默病[J].中国药理学与毒理学杂志,2021,35(9):658.
[51] ZHOU S,SUN Y J,ZHAO K,et al. miR?21/PTEN pathway mediates the cardioprotection of geniposide against oxidized low?density lipoprotein?induced endothelial injury via suppressing oxidative stress and inflammatory re- sponse[J]. Int J Mol Med,2020,45(5):1305-1316.
[52] LI C X,WANG X Q,CHENG F F,et al. Geniposide protects against hypoxia/reperfusion-induced blood-brain barrier impairment by increasing tight junction protein expression and decreasing inflammation,oxidative stress,and apoptosis in an in vitro system[J]. Eur J Pharmacol,2019,854:224-231.
[53] FAN X F,LIN L,CUI B X,et al. Therapeutic potential of genipin in various acute liver injury,fulminant hepatitis,NAFLD and other non-cancer liver diseases:more friend than foe[J]. Pharmacol Res,2020,159:104945.
[54] YU S X,DU C T,CHEN W,et al. Genipin inhibits NLRP3 and NLRC4 inflammasome activation via autophagy suppression[J]. Sci Rep,2015,5:17935.
[55] 張均田.神经元-突触丢失与老年痴呆[J].神经药理学报,2011,1(1):1-15.
[56] 谭雪,高莉,任佳,等.突触可塑性对阿尔茨海默病影响的研究进展[J].中国医药导报,2019,16(9):52-55.
[57] 李娇.三七总皂苷、栀子苷及其配伍对APP/PS1小鼠树突棘损伤的保护作用及机制[D].北京:北京中医药大学,2014.
[58] LV C,WANG L,LIU X L,et al. Multi-faced neuroprotective effects of geniposide depending on the RAGE-media- ted signaling in an Alzheimer mouse model[J]. Neuropharmacology,2015,89:175-184.
[59] CHEN M K,PENG C C,MANER R S,et al. Geniposide ameliorated fluoxetine-suppressed neurite outgrowth in Neuro2a neuroblastoma cells[J]. Life Sci,2019,226:1-11.
[60] 高航,王淑霞,张华北.以α7烟碱型乙酰胆碱受体为靶点的阿尔兹海默症显像剂研究进展[J].核化学与放射化学,2020,42(3):138-149.
[61] HAMPEL H,MESULAM M M,CUELLO A C,et al. The cholinergic system in the pathophysiology and treatment of Alzheimers disease[J]. Brain,2018,141(7):1917- 1933.
[62] 王旭,李娇,王峰,等.三七、栀子有效组分给药的APP/PS1小鼠血清神经递质与行为学的相关性[J].现代生物医学进展,2017,17(1):11-15.
[63] KWAK J H,LEE D U. Structure-antiamnesic activity relationship of iridoid glycosides from Gardenia fruits[J]. Chem Lett,2015,44(6):837-839.
[64] H?LSCHER C. Drugs developed for treatment of diabetes show protective effects in Alzheimers and Parkinsons diseases[J]. Sheng Li Xue Bao,2014,66(5):497-510.
[65] 张永兰.京尼平苷调节β淀粉样蛋白神经毒性及其代谢的分子机制[D].重庆:重庆大学,2015.
[66] ZHAO Y H,LI H Y,FANG F,et al. Geniposide improves repeated restraint stress-induced depression-like behavior in mice by ameliorating neuronal apoptosis via regulating GLP-1R/AKT signaling pathway[J]. Neurosci Lett,2018,676:19-26.
(收稿日期:2021-08-02 修回日期:2021-11-19)
(编辑:唐晓莲)

