不同核酸提取试剂对不同样本中非洲猪瘟病毒DNA提取效果的比较
陈雪蓉,徐 林,汤 承,岳 华
(1.西南民族大学畜牧兽医学院,四川 成都 610041;2.四川省甘孜藏族自治州动物疫病预防控制中心,四川 康定 626000)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染猪引起的一种急性、热性、高度接触性传染病,世界动物卫生组织(OIE)将它列为必须及时申报的动物传染病[1],也是国内外动物防疫的重点疫病之一[2-3].对于非洲猪瘟的病原学检测,目前常用的方法是PCR检测.能否提取高质量的核酸直接关系PCR检测试验的成败.有研究发现,不同病毒核酸提取试剂盒直接影响病毒核酸的提取效率,从而影响检测效率[4].在动物疫病监测上,有研究针对甲型H1N1流感病毒[5]、猪圆环病毒2型[6]、H5N1禽流感病毒[7]、新城疫病毒[8]、布鲁氏菌[9]、猪丹毒杆菌[10]、猪伪狂病毒[11]等采用不同核酸提取试剂盒或不同核酸提取方法进行核酸提取的比较研究,结果表明,不同核酸提取试剂盒或不同核酸提取方法提取的核酸可直接影响PCR的检测效果.针对不同类型的样品选取核酸提取效率高、纯度好、稳定性好、耗时短、操作简便的核酸提取试剂非常重要.本研究针对市售的5种病毒核酸提取试剂开展不同样本中ASFV核酸提取效果比较研究,从提取浓度、纯度、效率、时间、操作简便性等方面进行评价,探索不同样品最高效的ASFV核酸提取方法.
1 材料与方法
1.1 临床样本
ASFV阳性样本(口腔棉拭子、全血、脾脏、淋巴结、肾脏)经实时荧光定量PCR方法检测为阳性,并测序证实,由西南民族大学动物医学实验室(四川省ASF定点检测实验室)提供,用于ASFV核酸提取效果的比较.
1.2 主要试剂
Premix Ex Taq(Probe qPCR)购于宝生物工程(大连)股份有限公司;DNA Marker购于TaKaRa公司;DNA经典提取(试剂C:酚-氯仿);DNA专提试剂(试剂B:Viral DNA Kit核酸提取试剂盒由QMEGA BIO-TEK公司生产提供);DNA/RNA同提试剂(试剂A:DNA∕RNA Extraction Kit由洛阳莱普生信息科技有限公司生产提供);试剂D:TIANamp Virus DNA∕RNA Kit由天根生化科技(北京)有限公司生产提供;试剂E:PetNAD核酸萃取试剂盒由金瑞鸿捷(厦门)生物科技有限公司生产提供.
1.3 主要仪器
各量程移液器购于德国Eppendorf公司;核酸蛋白分析仪购于日本岛津公司;高速冷冻离心机购于湘仪离心机仪器有限公司;凝胶成像系统购于上海天能科技有限公司;荧光定量PCR仪购于杭州博日公司;cubee小型高速离心机购于中国厦门金瑞鸿捷公司.
1.4 引物、探针的合成
本研究采用的PCR方法为中华人民共和国农业农村部公告第172号:猪用生物制品及相关猪源原辅材料中非洲猪瘟病毒核酸检测方法[12],扩增的目的片段长度为63 bp,引物序列:F:5‘-CCTCGGCGAGCGCTTTATCAC-3‘,R:5‘-GGAAACTCATTCACCAAATCCTT-3‘.探针序列:5‘-FAM-CGATGCAAGCTTTAT-MGB-3‘.引物和探针均由生工生物工程(上海)股份有限公司合成.
1.5 样本的处理
本研究采用的样本处理方法为中华人民共和国农业农村部公告第172号:猪用生物制品及相关猪源原辅材料中非洲猪瘟病毒核酸检测方法[12].
猪组织 每种组织分别取样和处理.取不少于2.0 g组织,研磨后用5倍体积灭菌PBS悬浮,70℃灭活30 min,4℃下以2000~3000 r/min离心10 min,取上清液进行核酸提取.
棉拭子 取棉拭子放于3.5 mL灭菌PBS振荡涡旋,取上清液进行核酸提取.
全血 直接取全血进行核酸提取.
1.6 核酸的提取
A、B、D和E四种方法均采用柱纯化提取核酸,C为酚-氯仿提取方法,按照试剂盒说明书手动提取核酸,初始样本量均为200 μL,对单个样本进行三次平行核酸提取,最后均获得50 μL总DNA,-20℃保存备用.
1.7 核酸提取完整性的琼脂糖凝胶电泳检测
5种核酸提取试剂分别对口腔棉拭子、全血、淋巴结、脾脏和肾脏5种ASFV阳性样本三个平行提取的总DNA进行1.5%琼脂糖凝胶电泳检测,比较其DNA的完整性.
1.8 核酸浓度及纯度的检测
使用核酸蛋白分析仪测定提取的核酸浓度以及纯度,比较5种不同试剂盒所提取的5种样本中总核酸的浓度和纯度.
1.9 ASFV DNA的实时荧光定量PCR检测
采用的PCR方法为中华人民共和国农业农村部公告第172号:猪用生物制品及相关猪源原辅材料中非洲猪瘟病毒核酸检测方法[12],按照以下程序进行实时荧光定量PCR检测:50℃2 min,95℃5 min,95℃15 s,58℃退火延伸1 min,45个循环(荧光信号收集在此阶段每次循环的退火延伸时进行),对5种核酸提取试剂盒提取的5种样本的ASFVDNA进行三次重复检测.
1.10 不同核酸提取试剂盒提取相同数量的样本所需时间及仪器的比较
用5种核酸提取试剂提取5个样本,每个样本平行提取3份核酸,比较其所需时间及仪器.
1.11 数据处理
使用核酸蛋白分析仪测定DNA提取液总浓度和纯度,纯度以A260/A280=1.8~1.9为较好纯度[13],采用农业农村部推荐的荧光定量PCR方法对所提样本核酸进行扩增,CT值越小,则样品病毒含量越高[14].所有试验数据均采用SPSS软件进行分析处理,试验数据以“平均值±标准差”表示,p<0.05表示差异显著,p<0.01表示差异极显著.
2 结果
2.1 DNA片段完整性的测定
5种核酸提取试剂分别对5种不同类型的样本3份平行提取的ASFV核酸电泳结果如图1所示.从5种试剂对同一样本的提取核酸完整性来看,B、C、D三种试剂对口腔棉拭子的核酸提取完整性较好,C试剂对全血的核酸提取完整性最好,B、C、D三种试剂对淋巴结的核酸提取完整性较好,D试剂对脾脏的核酸提取完整性最佳,A、B、C、D、E五种试剂对肾脏组织的核酸提取完整性均较好.
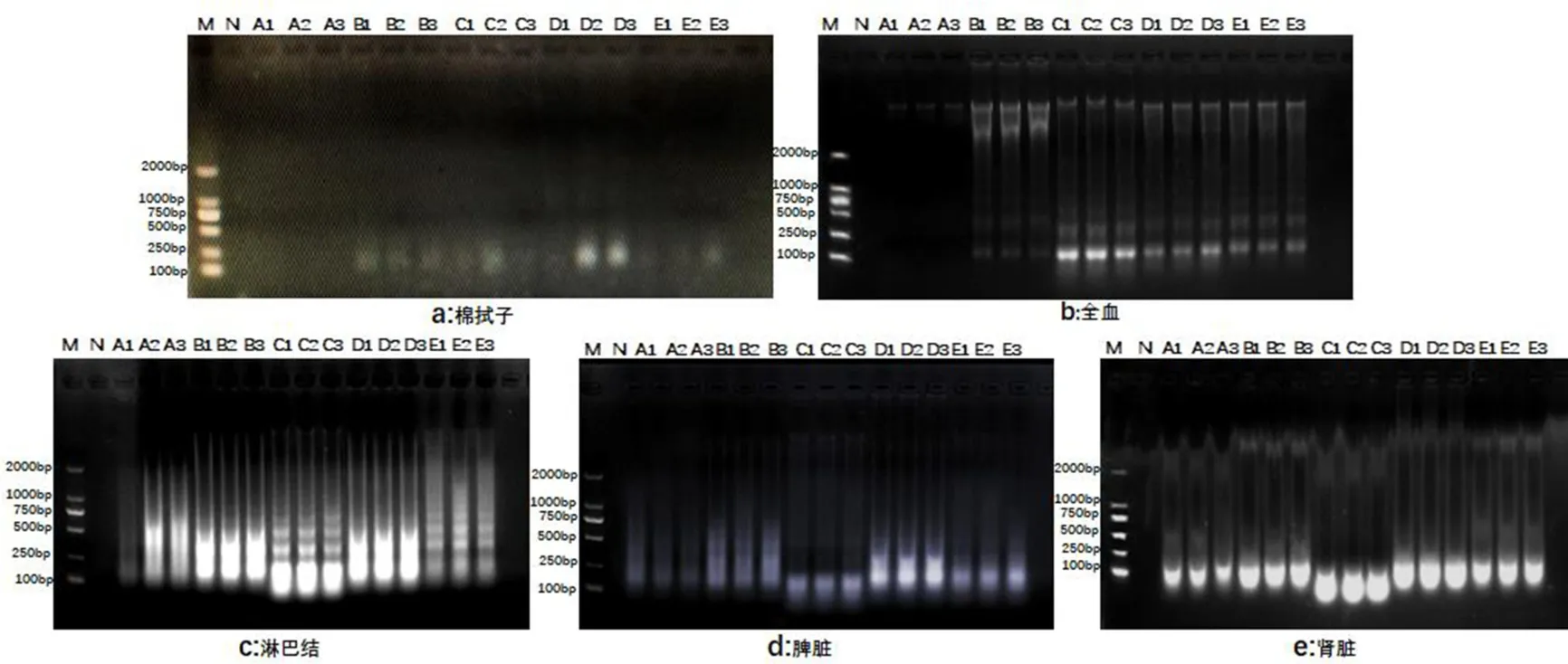
图1 提取的DNA琼脂糖凝胶电泳注:M:DNA Marker;N:阴性对照Fig.1 Agarose gel electrophoresis of DNA extracted Note:M:DNA Marker,N:Negative control
2.2 核酸提取的浓度及纯度的测定
结果如表1a~表1e所示:5种试剂对同一样本的核酸提取浓度分析提取效果可见试剂D对脾脏、肾脏、淋巴结、棉拭子4种样本的核酸提取浓度最高,试剂C对全血样本的核酸提取浓度最高.5种试剂对同一样本的DNA提取纯度分析提取效果可见,对口腔棉拭子样本,试剂B的提取纯度最好;对于全血样本,试剂B的提取纯度最好;对于淋巴结样本,试剂B的提取纯度好;对于脾脏样本,试剂B、C的提取纯度最好;对于肾脏样本,试剂B、C的提取纯度最好.
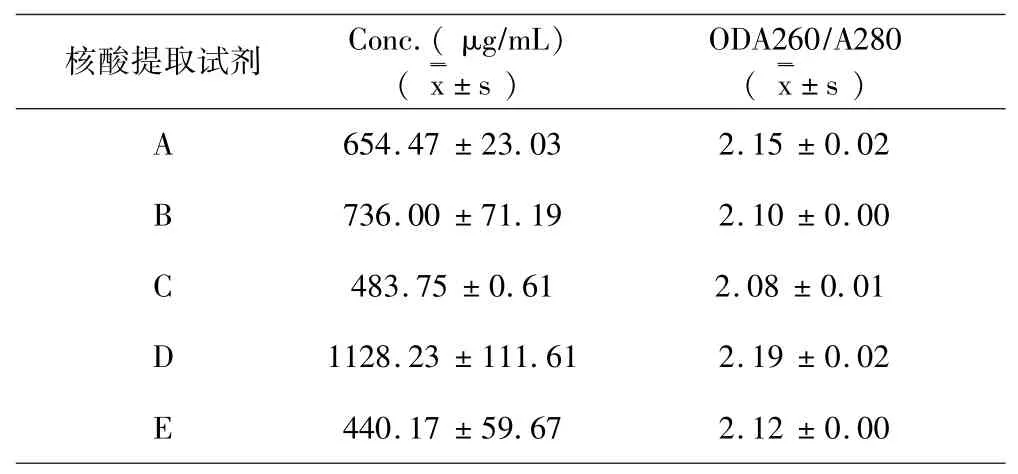
表1 e DNA提取液浓度纯度测定(肾脏)Table 1e Determination of concentration and purity of DNA extract(kidney)
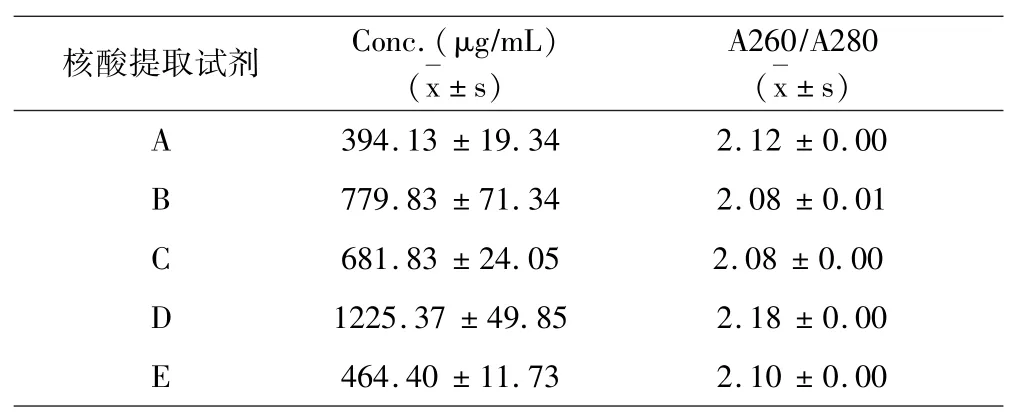
表1 d DNA提取液浓度纯度测定(脾脏)Table 1d Determination of concentration and purity of DNA extract(spleen)
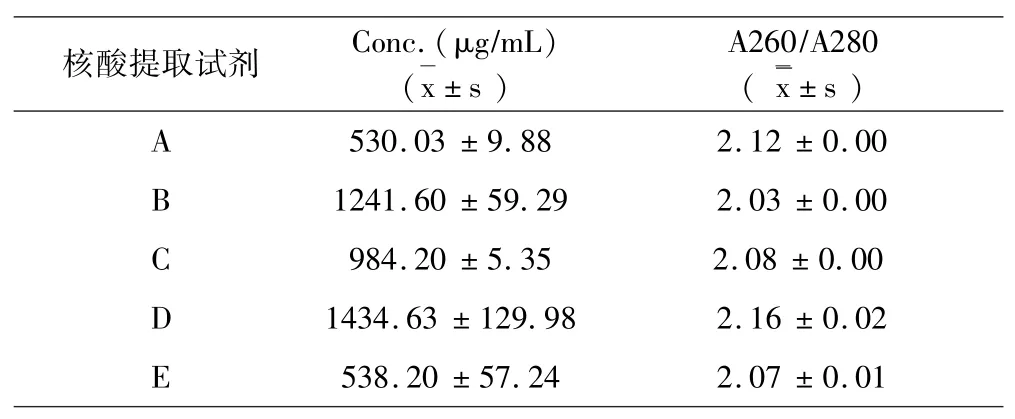
表1 c DNA提取液浓度纯度测定(淋巴结)Table 1c DNA extract concentration and purity determination(lymph nodes)
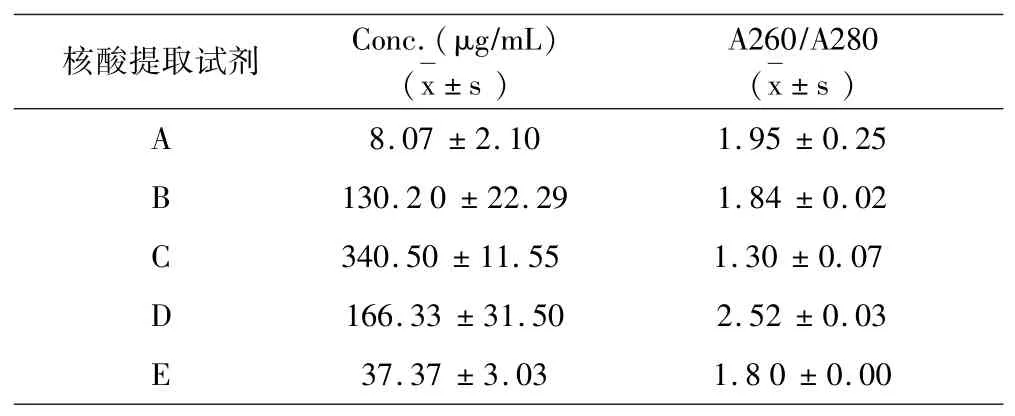
表1 b DNA提取液浓度纯度测定(全血)Table 1b Determination of concentration and purity of DNA extract(whole blood)
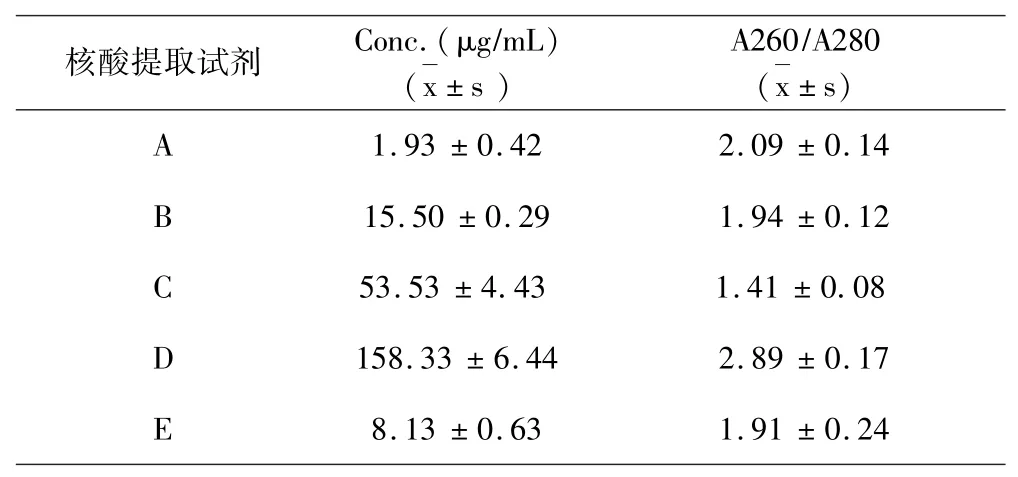
表1 a DNA提取液浓度纯度测定(口腔棉拭子)Table 1a Determination of the concentration and purity of DNA extracts(oral cotton swabs)
2.3 不同试剂提取样本核酸RT-qPCR CT值的测定
结果如表2所示:在口腔棉拭子组织中,试剂C与A极显著(p<0.01),与D显著(p<0.05),从CT值来看,试剂B提取ASFV DNA样本初始模板浓度最高.在全血组织中,C试剂与B、E试剂之间极显著(p<0.01),与A试剂显著(p<0.05),B试剂提取ASFV DNA样本初始模板浓度最高.在淋巴结组织中,C试剂与A、B、D、E试剂均极显著(p<0.01),C试剂提取ASFV DNA样本初始模板浓度最高.在脾脏组织中,C试剂与A、D试剂极显著(p<0.01),与E试剂显著(p<0.05),C试剂提取ASFV DNA样本初始模板浓度最高.在肾脏组织中,C试剂与A、D、E试剂间极显著(p<0.01),C试剂提取ASFV DNA样本初始模板浓度最高.
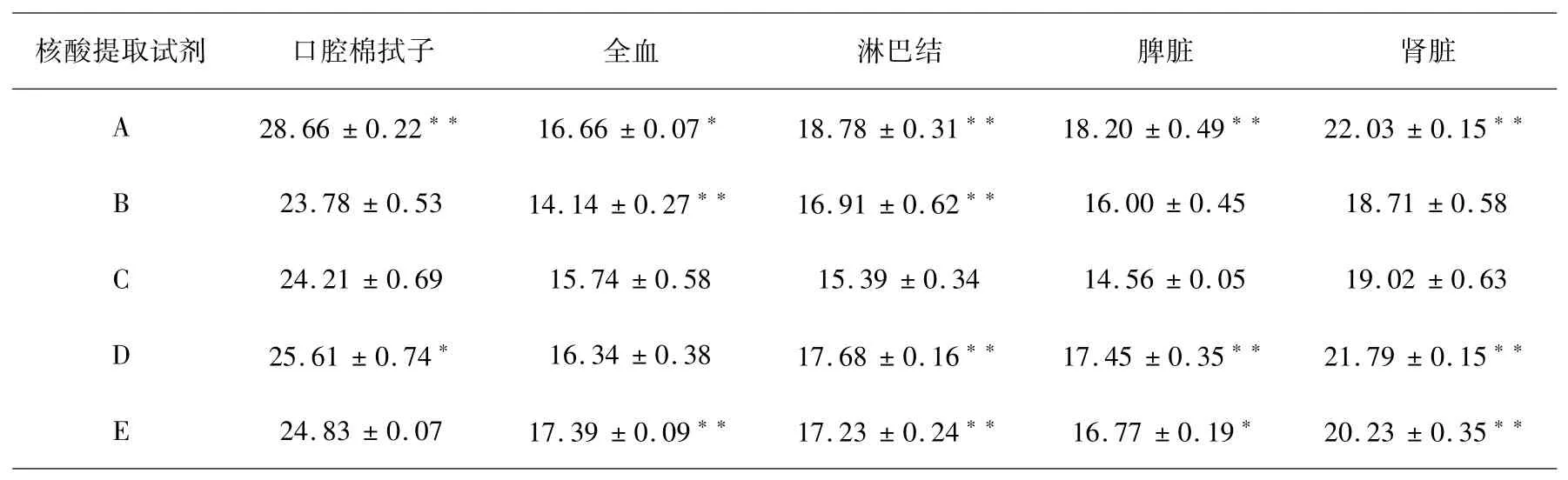
表2 样本CT值Table 2 CT values of samples
2.4 不同核酸提取试剂盒提取相同数量的样本所需时间及仪器的比较结果
如表3所示,在15个样本的核酸提取中,试剂C提取所需时间最长,所需仪器较多,E核酸提取试剂提取时间最短、所需仪器最少及最便携.

表3 5种核酸提取试剂提取相同数量的样本所需时间及仪器Table 3 Time and equipment required for five nucleic acid extraction reagents to extract the same number of samples
3 讨论
本研究比较经典酚氯仿法、两种DNA提取试剂以及三种DNA/RNA同提试剂对ASFV常用检测样本(口腔棉拭子、全血、淋巴结、脾脏、肾脏)的核酸提取效果,从核酸片段完整性、核酸浓度及纯度、实时荧光PCR定量检测CT值及耗时便携性五个方面进行分析.
3.1 不同试剂提取核酸质量的比较
对于病毒核酸检测,除了检测试剂盒的特异性、敏感性和重复性等因素对检测结果影响较大外,病毒核酸的质量对其影响也非常大.提取总DNA的方法众多,采用不同的提取试剂及方法获得的核酸片段完整性、DNA含量和纯度也不同[15-16].本研究中,DNA专提试剂B、C所提总核酸片段完整度较好,总浓度较高,DNA纯度较好,其中试剂B更优于试剂C,原因可能是因为C是传统的酚氯仿法,而B是采用柱纯化技术的DNA提取试剂盒,因此提取总浓度及DNA纯度更好.在DNA/RNA同提试剂A、C、D中,D试剂所提核酸片段完整性好,且总浓度最高,但DNA纯度最差.E试剂提取核酸片段较完整,浓度较A高,纯度是A、D、E三种DNA/RNA同提试剂中最好的.A试剂在口腔棉拭子和全血样本中提取核酸片段较差,总浓度最低,DNA纯度较差.因此,建议DNA病毒核酸提取用DNA专提试剂,提取核酸质量更好,本研究也为今后的ASFV核酸提取提供了参考.
3.2 同一试剂对不同样本中ASFV DNA的提取比较
2016年孙盛用五种不同的试剂分别提取肠道内容物和粪便DNA,得出不同试剂对同一样本提取效果有显著差异的结论[17].在本研究中不同试剂对ASFV同一样本的提取效果差异显著(p<0.05).试剂B提取ASFV口腔棉拭子和全血样本CT值较低,效果更好;试剂C提取ASFV淋巴结、脾脏、肾脏等生物组织样本CT值较低,效果更好,试剂C为经典酚氯仿法,试剂B为商品化DNA提取试剂,都为DNA专提,提取ASFV效果更好.在本研究中,同为DNA/RNA同提试剂盒的A、D、E中,试剂E对口腔棉拭子、淋巴结、脾脏、肾脏等样本中的ASFV DNA提取效果较好,但对全血样本的效果比试剂A和D差.因此,针对ASFV DNA的提取,可根据不同样本选择合适的提取试剂,会提高检测结果的准确性和科学性.
3.3 核酸提取的时间和便携性
在核酸提取时效性方面,以E试剂操作步骤最简便,所需仪器最便携,耗时最短.C试剂提取时间最长,所需仪器较多,所用时间最长.B试剂操作步骤简单,虽所需仪器较多,但耗时较短.因此,在今后工作中,各实验室可根据试验目的、样品数量、提取核酸类型及实验室自身条件等情况,合理选择核酸提取试剂,为动物疫病检测获得更合理、准确的数据.

