骨肽类制剂的降压物质检查
王瑶,吴殷囡,汪玉馨,孟长虹
(1.江苏省食品药品监督检验研究院药理毒理研究中心,南京 210029;2.徐州医科大学药物分析教研室,徐州 221004)
多组分生化药多采用生物提取工艺制备,制备过程中,组胺或类组胺等物质可能混入,导致血压下降、变态反应等不良反应,影响临床用药安全性[1-2]。骨肽是一种具有刺激成骨细胞增殖、促进新骨形成的多组分生化药,用于治疗骨质疏松症、骨折及类风湿关节炎等疾病。近年来,骨肽类制剂的不良反应报道逐渐增加,其中变态反应、血压下降等不良反应报道较为频繁[3-5],目前已被列入国家重点监控合理用药药品目录[6]。现行质量控制标准中,仅有骨瓜提取物注射液、注射用骨瓜提取物等部分制剂设定了降压物质检查项[7]。为了完善骨肽类制剂的质量标准,笔者依据《注射剂安全性检查法应用指导原则》和《降压物质检查法》[7],对骨肽类制剂及其原液进行降压物质研究,为确定骨肽类制剂的降压物质检查限值提供参考。
1 仪器与材料
1.1仪器 离体器官仪ALC-MPA2000(上海奥尔科特生物科技有限公司)。
1.2动物 猫,雄性,体质量约3.0 kg。实验动物使用许可证号:SYXK(苏)2017-0062。使用环境:温度20~26 ℃,相对湿度40%~70%,每小时换气8次,光照≥200 lx。
1.3试药 磷酸组胺(中国食品药品检定研究院,批号:150510-201313);戊巴比妥钠(上海Sigma-Aldrich 公司,批号:20140221);肝素钠注射液(南京新百药业公司,批号:1180204)。供试品中骨肽类注射液11批,注射用11批,骨肽原液5批,具体信息见表1。

表1 骨肽类制剂样品信息Tab.1 Information of osteopeptide preparation sampleS
2 方法与结果
2.1动物麻醉及手术 参照《降压物质检查法》,对实验猫腹腔注射5%戊巴比妥钠进行麻醉后固定于保温手术台上,分离气管及颈动脉,在一侧颈动脉插入连接离体器官仪的动脉插管,使插管内充满肝素钠0.9%氯化钠溶液(1000 U·mL-1),以记录血压;同时在一侧分离股静脉,插入静脉插管,供注射药液用。实验中注意保持动物体温。全部手术完毕后,将仪器调节到和动物血压相当的高度[一般为99.8~150.0 mmHg(1 mmHg=0.133 kPa)],开启动脉夹,待血压稳定后,进行药液注射。各次注射速度基本相同,每次注射后立即注入一定量的氯化钠注射液,每次注射应在前一次反应恢复稳定后进行,且相邻两次注射的间隔时间尽量保持一致。
2.2灵敏度实验 经静脉插管依次注入组胺对照品稀释液,剂量按照动物体质量调整,给予组胺0.05,0.10,0.15 μg·kg-1,给药前后分别给与组胺进行灵敏度验证,具体结果见表2。
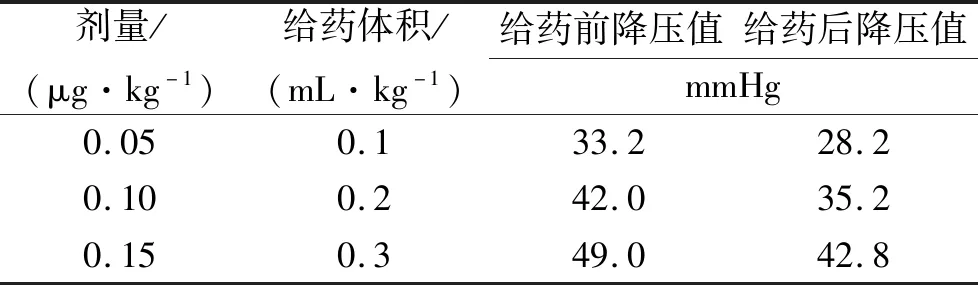
表2 灵敏度验证结果Tab.2 Sensitivity verification results
由表2可知,在0.10 μg·kg-1剂量下血压下降值均≥20.0 mmHg,且各剂量所致反应有所差别,因此降压实验用动物均符合《中华人民共和国药典》规定[7],灵敏度验证成立。
2.3降压物质检查预实验 取制剂各品种各1批,采用3个剂量(剂间比为1:3)进行预实验。由于骨肽制剂在静脉注射时有一定降压作用,将起始剂量定为临床剂量的1/5。具体给药剂量及结果详见表3。
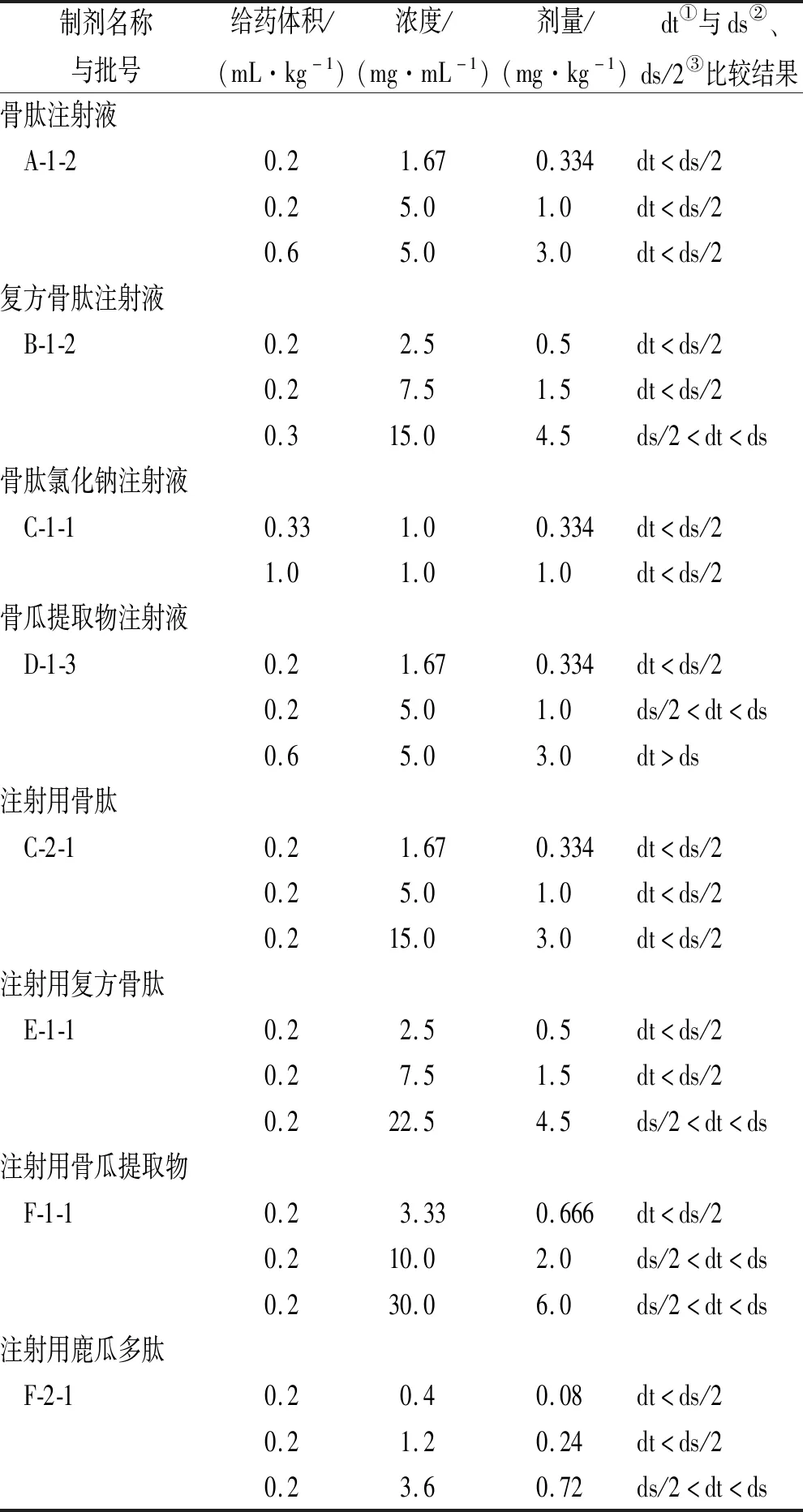
表3 骨肽类制剂预实验结果Tab.3 Pre-test result of osteopeptide preparations
参照《注射剂安全性检查法应用指导原则》[7],分析骨肽类制剂降压物质检查的预实验结果,为实施正式实验拟定骨肽类制剂各品种的降压物质检查限值。
注射液制剂中,骨肽注射液在大、中、小剂量下均无降压反应,在正式实验中拟采用剂量2.5 mg·kg-1。复方骨肽注射液样品在剂量4.5 mg·kg-1时,有明显降压作用,正式实验中拟采用剂量1.5 mg·kg-1即临床剂量的3/5。骨肽氯化钠注射液预实验中均未产生降压反应,则在正式实验中拟采用1 mg·kg-1。骨瓜提取物注射液在剂量3 mg·kg-1下有明显的降压作用,并不符合规定,故正式实验拟采用剂量1 mg·kg-1即临床剂量的3/5。
注射用制剂中,注射用骨肽在大、中、小剂量下均无降压反应,在正式实验中采用剂量2.5 mg·kg-1。注射用复方骨肽在大、中、小剂量下均符合规定,大剂量时有明显降压作用,正式实验拟采用与复方骨肽注射液的同等剂量1.5 mg·kg-1。注射用骨瓜提取物在中、大剂量时降压幅度相近,在正式实验中拟和骨瓜提取物注射液采用同等剂量1 mg·kg-1。注射用鹿瓜多肽大剂量有降压作用,在正式实验中拟采用剂量0.72 mg·kg-1。具体见表4。
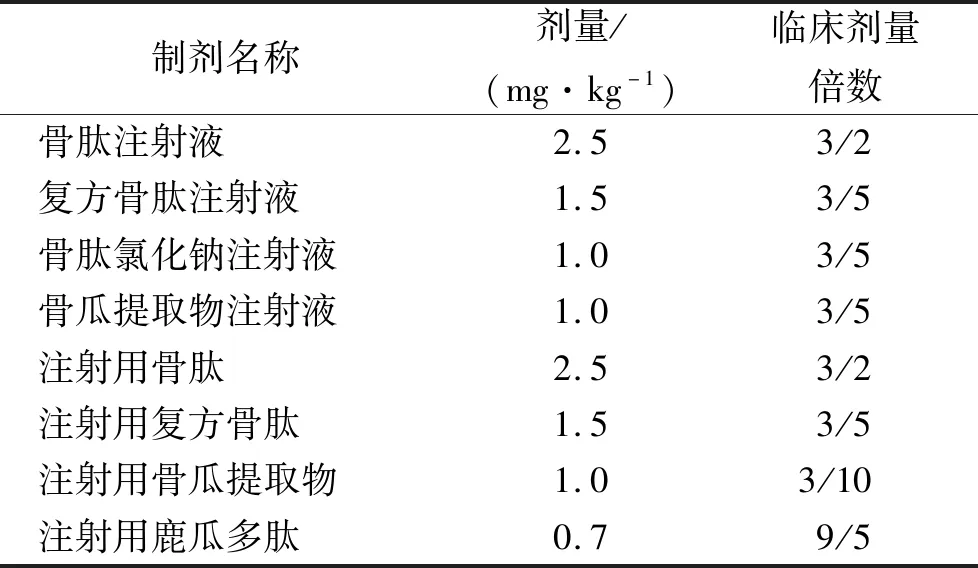
表4 降压物质检查正式实验给药剂量Tab.4 Dosage in formal depressor substance test
2.4降压物质检查正式实验 按各制剂初步拟定的限值,对22批骨肽类制剂进行降压物质检查,结果见表5。

表5 降压物质检查正式实验结果Tab.5 Result of depressor substance test in formal experiment
2.5原液降压物质研究 预实验结果表明,B企业的复方骨肽注射液与D企业的骨瓜提取物注射液均在其大剂量下产生一定程度的降压作用。考虑到骨肽类制剂的制备工艺,一种制剂的处方中采用一种或多种原液进行制备,为探究制剂产生的降压作用与其原液的相关性,因此选择了上述两家企业的骨肽类原液进行降压物质检查,以判断制剂的降压物质主要源于哪一种原液。
根据B企业和D企业提供的处方比例分别进行计算,选择制剂同等剂量(大剂量)下对应的原液组分含量进行降压物质检查,结果见表6。
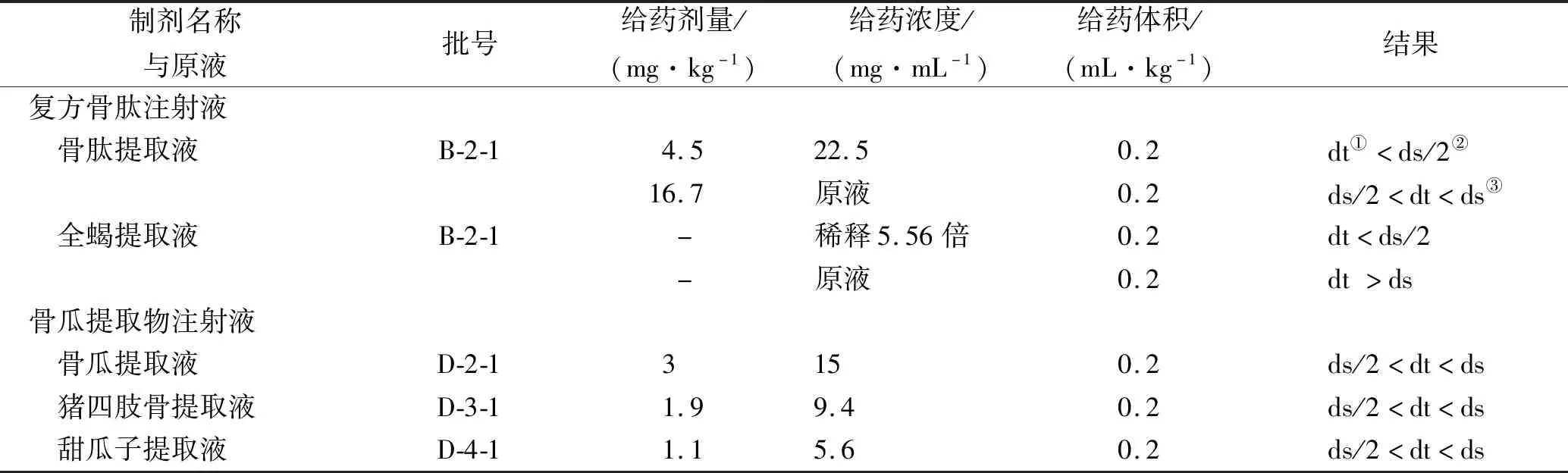
表6 骨肽类原液降压物质检查结果Tab.6 Result of depressor substance test in original solution of osteopeptide preparations
B企业的复方骨肽注射液,在预实验大剂量下有降压作用(ds/2 D企业的骨瓜提取液、猪四肢骨提取液、甜瓜子提取液在同等剂量下均有降压作用,与制剂一致,几种原液所致的降压作用可能影响制剂质量。 2.6骨肽类制剂降压物质检查限值拟定 课题组拟定的降压物质限度表见表7。由于骨肽类制剂在药效中无降压作用[8],因此本实验在临床剂量的1/5~5倍范围内拟取猫最大无降压反应剂量为限值[7],通过比较不同剂量的供试品与组胺对照品(0.10 μg·kg-1)所引起麻醉猫血压下降的程度,判定骨肽类制剂在拟定的限值下是否符合规定,结果表明在拟定限值下,22批骨肽类制剂均符合规定。 表7 骨肽类制剂降压物质限值Tab.7 Depressor substance limits of osteopeptide preparations 多组分生化药因来源复杂、组分不明确等问题备受关注[9]。骨肽类制剂是以动物骨为原料,经提取制成的传统生化药。研究表明[10],生化制药用原材料具有被污染的可能性。组胺、类组胺等小分子物质可能混入提取或制备工艺中,引起不良反应影响临床疗效。因此,对骨肽类制剂及原液的降压物质研究以提高其质量标准具有必要性。 由降压物质检查结果可见,骨肽类制剂在预实验中,复方骨肽注射液、注射用复方骨肽、注射用鹿瓜多肽在大剂量下均有降压作用;骨瓜提取物注射液则在中剂量时就出现了降压作用;中剂量与大剂量的注射用骨瓜提取物均有降压作用,根据上述预实验结果及降压物质检查的限值规定[8],课题组为正式实验预设了限值。根据拟定限值,正式实验结果表明22批骨肽类制剂均符合规定,方法可行。也发现个别批次的样品使用不同猫时降压反应不同,考虑可能是由于猫的质量控制存在问题所致,不同性别、年龄、生理条件、不同环境对实验的影响因素较大,造成不同的猫对降压的敏感性不同。 在研究同企业原液与制剂所引起降压作用的相关性时,发现B企业的产品批间差异较大,在与制剂引起降压作用的同等剂量下,骨肽类原液并未引起降压作用,用原液实验时则存在不同程度的降压作用;而D企业的骨肽类原液在其制剂引起降压作用的同等剂量下即产生降压作用,认为骨肽类制剂的降压作用可能与其原液自身所引起的降压作用相关,因此骨肽类原液的降压物质检查也应受到重视。 现行的质量标准中,大部分临床常用的骨肽类制剂如骨肽注射液等并未设置降压物质检查项。考虑到骨肽类制剂的不良反应报道中降压反应、变态反应等皆与组胺、类组胺等物质相关,提高骨肽类制剂与原液的质量标准,增加降压物质检查项,控制组胺及类组胺等物质在制剂与原液中的含量,对保障患者用药安全具有重大意义。
3 讨论

