HMGB1/Caspase-1/GSDMD 信号轴介导肝细胞焦亡在肝脏缺血-再灌注损伤中的作用
胡莎莎 刘钰 王朝阳 杨爽 张国梁 蔡金贞
缺血-再灌注损伤(ischemia-reperfusion injury,IRI)是肝脏外科手术、液体复苏失血性休克的主要并发症,对于上述疾病的转归及预后起到至关重要的作用[1-4]。如何更好地保护缺血的肝细胞,减少IRI发生,是目前肝脏疾病治疗领域研究的热点[5-6]。高迁移率族蛋白1(high mobility group box 1,HMGB1)广泛分布于机体的组织器官中,参与DNA的重组、修复、基因转录调控、细胞复制及分化等生命活动[7]。HMGB1被广泛认为可通过诱导细胞焦亡参与肝脏IRI[8-9]。细胞焦亡(pyroptosis)是一种不同于凋亡和坏死的程序性细胞死亡方式,是由Gasdermin D(GSDMD)介导的细胞炎性坏死[10],依赖于半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)并伴有大量促炎因子释放[11],细胞形态变化表现为DNA断裂、细胞核皱缩、细胞膜孔洞形成以及细胞膨胀直至细胞膜破裂,可导致炎症因子大量释放,从而引起强烈的炎症反应[12]。甘草酸(glycyrrhizic acid,GA)被发现可以直接与HMGB1结合,抑制其活性,减轻IRI诱导的肝损伤[13-14]。已有大量研究表明,Caspase-1、GSDMD蛋白在细胞焦亡过程中起到重要的调控作用[15-16]。Wu等[17]发现,Caspase-11非典型炎症小体在一系列自身免疫性疾病中起着至关重要的作用,Caspase-11炎症小体可激活GSDMD途径诱导细胞焦亡。然而,关于肝脏IRI过程中HMGB1介导Caspase-1、GSDMD表达的研究鲜有报道。本文旨在探讨3个关键蛋白HMGB1、Caspase-1和GSDMD在调控小鼠肝脏IRI过程中的具体机制,以及HMGB1/Caspase-1/GSDMD信号轴介导肝细胞焦亡在肝脏IRI中的作用。
1 材料与方法
1.1 实验材料和试剂
1.1.1 实验材料 选取8~10周的健康雄性无特定病原体(specific pathogen free,SPF)级纯系C57BL/6小鼠48只,体质量20~25 g,购于北京华阜康生物科技股份有限公司。小鼠正常肝细胞系AML12 细胞(非致瘤小鼠肝细胞)购于中国科学院上海细胞库。
1.1.2 试 剂 HMGB1抗体、GSDMD抗体购于武汉Abclonal公司,Caspase-1一抗和荧光标记二抗购于英国Abcam公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购于武汉Elabscience公司,羊抗兔辣根过氧化物酶标记的二抗购于美国CST公司,GA购于日本TCI公司。脱氧核糖核酸末端转移酶介导的 dUTP 缺口末端标记(terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling,TUNEL)染色试剂盒购自北京索莱宝科技有限公司,酶联免疫吸附试验(enzyme-linked immune absorbent assay,ELISA)试剂盒购自杭州联合生物有限公司。
1.2 小鼠分组、肝脏IRI模型建立及标本采集
1.2.1 小鼠肝脏IRI模型建立 所有小鼠于天津市器官移植重点实验室动物房内的SPF标准条件下饲养,室温25 ℃左右,相对湿度50%~60%,均按规定标准进行人道护理,自由取水、取食。本实验研究方案经过天津市第一中心医院动物伦理委员会审核通过。采用随机数字表法将小鼠分为6组,分别为假手术组(Sham 组)、IRI 2 h组、IRI 6 h组、IRI 12 h组、GA+Sham组和GA+IRI 12 h组,每组8只。IRI 2 h组、IRI 6 h组和IRI 12 h组参考文献[18-21]建立小鼠IRI模型,采用血管夹夹闭肝左、中叶门静脉及肝动脉分支,持续缺血1 h后松开血管夹并关腹,各组分别恢复血供2、6、12 h后取材。Sham组小鼠进行假手术处理,麻醉后行开腹、游离第一肝门、关腹处理,不予夹闭血管,13 h后取材。GA+Sham组和GA+IRI 12 h组小鼠进行GA预处理,将200 μmol/L的GA提前2 h经小鼠腹腔注射后,GA+Sham组进行假手术处理,13 h后取材,GA+IRI 12 h组再按照前述方法建立IRI模型,持续缺血1 h后恢复血供12 h后取材。
1.2.2 标本采集 处死小鼠获取肝组织,将每个标本的肝组织使用预冷的磷酸盐缓冲液冲洗3次后分为2份:一份立即置入10%甲醛溶液中固定24 h,随后再经梯度乙醇脱水、二甲苯透明、浸蜡、包埋制作成石蜡切片;另一份经过液氮速冻后置于-80℃冰箱保存,后续实验备用。
1.3 细胞分组与处理
将传代好的AML12细胞大致均匀地分为Sham组、IRI 12 h组、GA+Sham组和GA+IRI 12 h组。Sham组为正常培养的肝细胞,不予特殊处理。IRI 12 h组参考文献[22]建立细胞IRI模型,细胞缺氧1 h,再恢复氧气12 h后收集细胞。GA+Sham组和GA+IRI 12 h组提前24 h将含200 μmol/L GA的DMEM完全培养基加入AML12 细胞,GA+Sham组不进行缺氧和复氧处理,GA+IRI 12 h组细胞缺氧1h,再恢复氧气12 h后收集细胞。
1.4 实验方法
1.4.1 酶联免疫吸附试验检测小鼠血生化指标水平 用1 mL注射器经小鼠下腔静脉取血1 mL,常温下静置1 h后3 000 ×g离心15 min,取上层血清。采用ELISA检测血清丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、白细胞介素(interleukin,IL)-1β和IL-6水平。
1.4.2 苏木素-伊红染色观察小鼠肝组织形态学 小鼠肝组织经10%甲醛溶液固定24 h后,进行脱水、透明、浸蜡和包埋。待脱蜡和水化后,进行苏木素染色和伊红复染,采用专用树胶封片处理,光学显微镜下观察苏木素-伊红(hematoxylin-eosin,HE)染色效果。肝脏缺血病理学评分标准为:0分,无肝细胞损伤;1分,轻度损伤,特点为细胞质空泡化,病灶核固缩;2分,中度损伤,血窦膨胀,细胞溶质空泡化,细胞边界模糊;3分,中度到重度损伤,凝固性坏死,大量血窦膨胀,红细胞渗出到肝索,嗜伊红细胞增多,中性粒细胞着边(附着于血管壁);4分,严重坏死,失去肝脏结构,肝索崩解,出血,中性粒细胞渗入。
1.4.3 TUNEL染色检测肝细胞凋亡 用二甲苯将小鼠肝组织浸洗2次,随后用梯度乙醇浸洗,并用蛋白酶 K工作液处理,在37 ℃烤箱中孵育30 min,加入TUNEL反应体系,在暗湿盒中37 ℃孵育1 h。封片剂处理后,置于荧光显微镜下观察细胞并拍照。
1.4.4 免疫组织化学检测肝组织HMGB1蛋白表达 将小鼠肝脏石蜡标本切片后烤片1.5 h,进行脱蜡、水化。HMGB1一抗于4 ℃湿盒中孵育过夜,二抗于37 ℃避光孵育1 h,4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole,DAPI)染细胞核3 min,光学显微镜下观察HMGB1蛋白表达情况,阳性细胞呈现褐色,颜色越深表达量越高。
1.4.5 蛋白质印迹法检测肝组织和AML12细胞的HMGB1、Caspase-1、GSDMD蛋白表达 提取小鼠肝组织蛋白和AML12细胞蛋白。BCA法测蛋白浓度,进行电泳,转膜,5%脱脂牛奶室温封闭1 h,一抗(HMGB1、Caspase-1、GSDMD、GAPDH)4 ℃过夜孵育,加相应二抗室温下孵育90 min,后置于化学发光仪中曝光显影。
1.4.6 逆转录聚合酶链反应 采用逆转录聚合酶链反 应(reverse transcription polymerase chain reaction,RT-PCR)检测肝组织中IL-1β和IL-6 信使核糖核酸(messenger ribonucleic acid,mRNA)水平。提取小鼠肝组织mRNA,反转录互补DNA,运用SYBR 荧光染料法,以GAPDH作为内参,根据2-ΔΔCT法计算IL-1β和IL-6 mRNA的相对表达量。
1.5 统计学方法
采用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,多组间比采用单因素方差分析,组间两两比较采用 LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 IRI后各组小鼠血清ALT和AST水平变化
与Sham组比较,IRI 2 h组、IRI 6 h组、IRI 12 h组小鼠血清中的ALT和AST水平均升高,且IRI 6 h组高于IRI 2 h组,IRI 12 h组高于IRI 6 h组,差异均有统计学意义(均为P<0.05,图1)。表明ALT和AST水平随着再灌注时间的延长呈明显的时间依赖性。
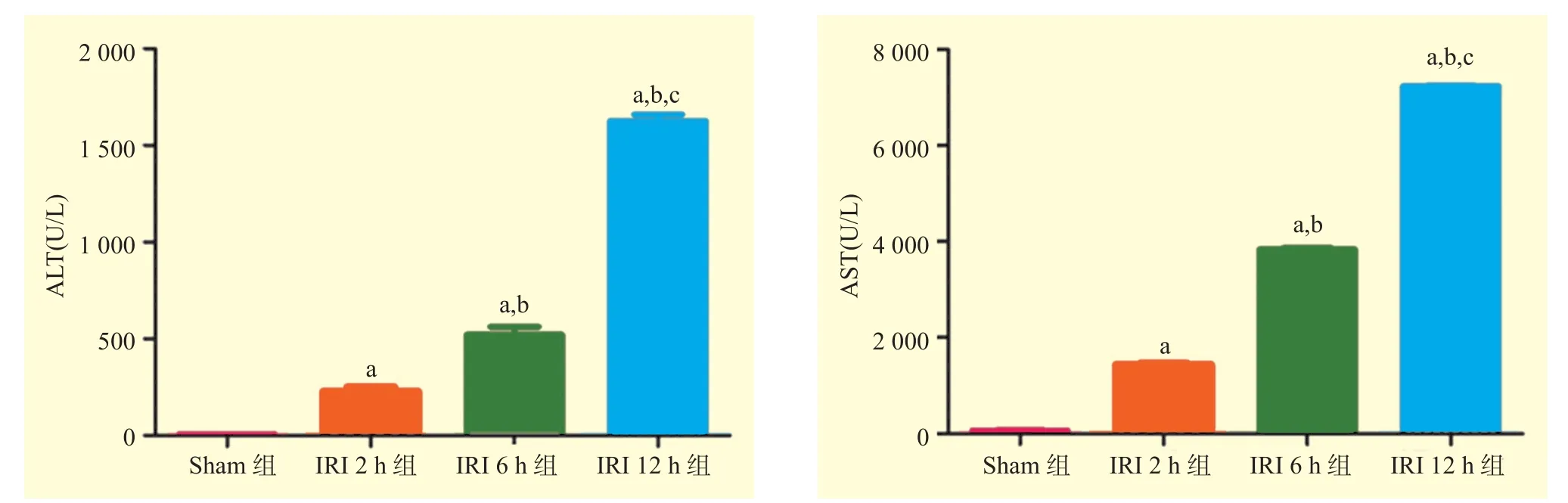
图1 各组小鼠血清ALT和AST水平比较Figure 1 Comparison of serum ALT and AST levels of mice among each group
2.2 IRI后各组小鼠肝组织和血清IL-1β、IL-6水平变化
与Sham组比较,IRI 2 h组、IRI 6 h组、IRI 12 h组小鼠肝组织中的IL-1β、IL-6 mRNA相对表达量均升高,血清中的IL-1β、IL-6水平均升高,且IRI 6 h组高于IRI 2 h组,IRI 12 h组高于IRI 6 h组,差异均有统计学意义(均为P<0.05,图2)。IL-1β和IL-6水平随着再灌注时间延长呈明显的时间依赖性,表明小鼠肝组织IRI导致明显的炎症反应激活。
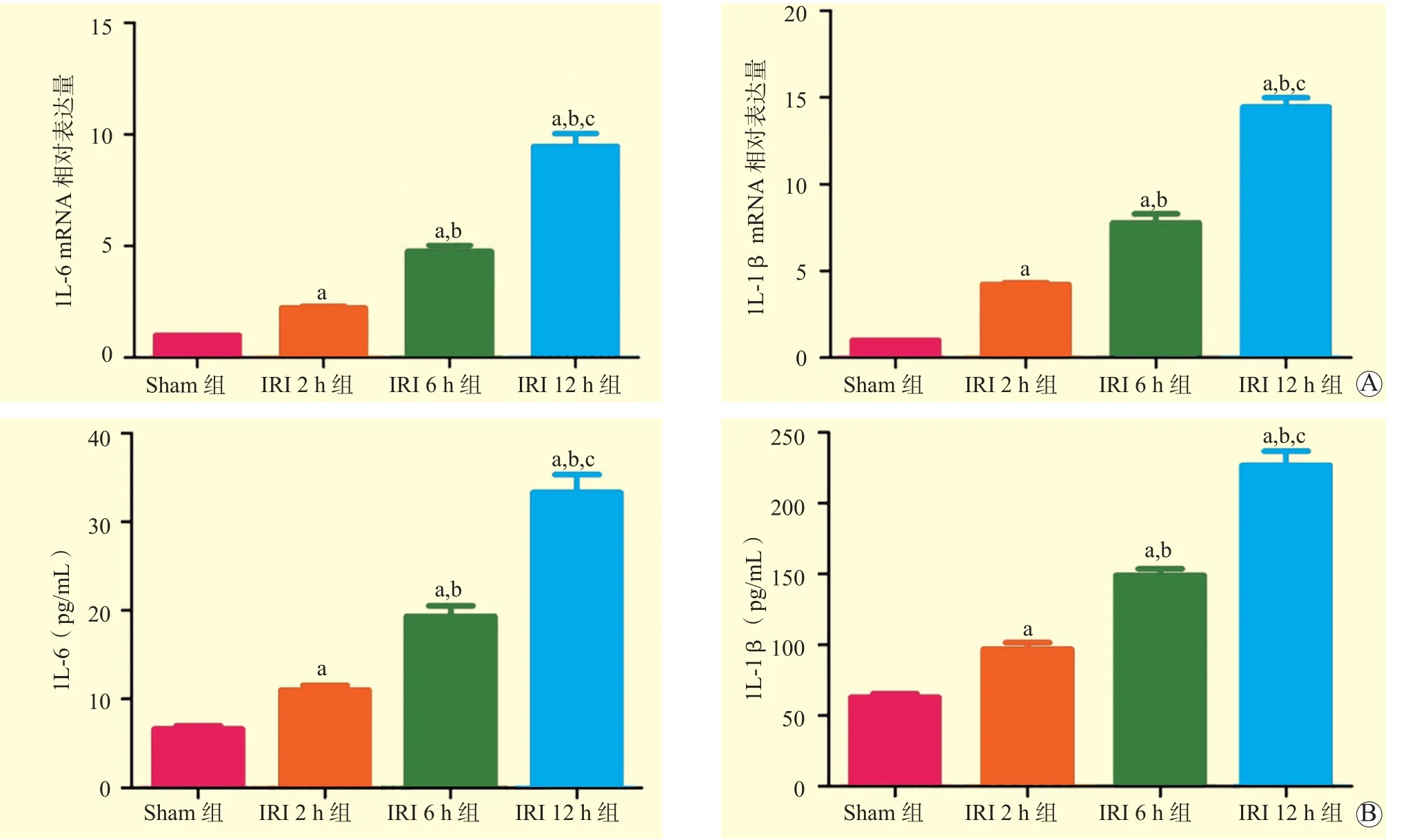
图2 各组小鼠肝组织和血清中IL-1β、IL-6水平比较Figure 2 Comparison of IL-1β and IL-6 levels in liver tissues and serum of mice among each group
2.3 IRI后各组小鼠肝脏缺血病理学评分和细胞凋亡情况
与Sham组相比,IRI后各组小鼠肝组织中可见区域性肝细胞水肿、肝窦区变窄、中央静脉充血、点灶状坏死,且随着再灌注时间延长而加重。与Sham组比较,IRI 2 h组、IRI 6 h组、IRI 12 h组肝脏缺血病理学评分均升高,且IRI 6 h组高于IRI 2 h组,IRI 12 h组高于IRI 6 h组,差异均有统计学意义(均为P<0.05,图3A)。TUNEL染色结果显示,与Sham组比较,IRI 2 h组、IRI 6 h组、IRI 12 h组小鼠肝细胞凋亡率均升高,且IRI 6 h组高于IRI 2 h组,IRI 12 h组高于IRI 6 h组,差异均有统计学意义(均为P<0.05,图3B)。提示IRI可能导致肝细胞焦亡通路被激活。
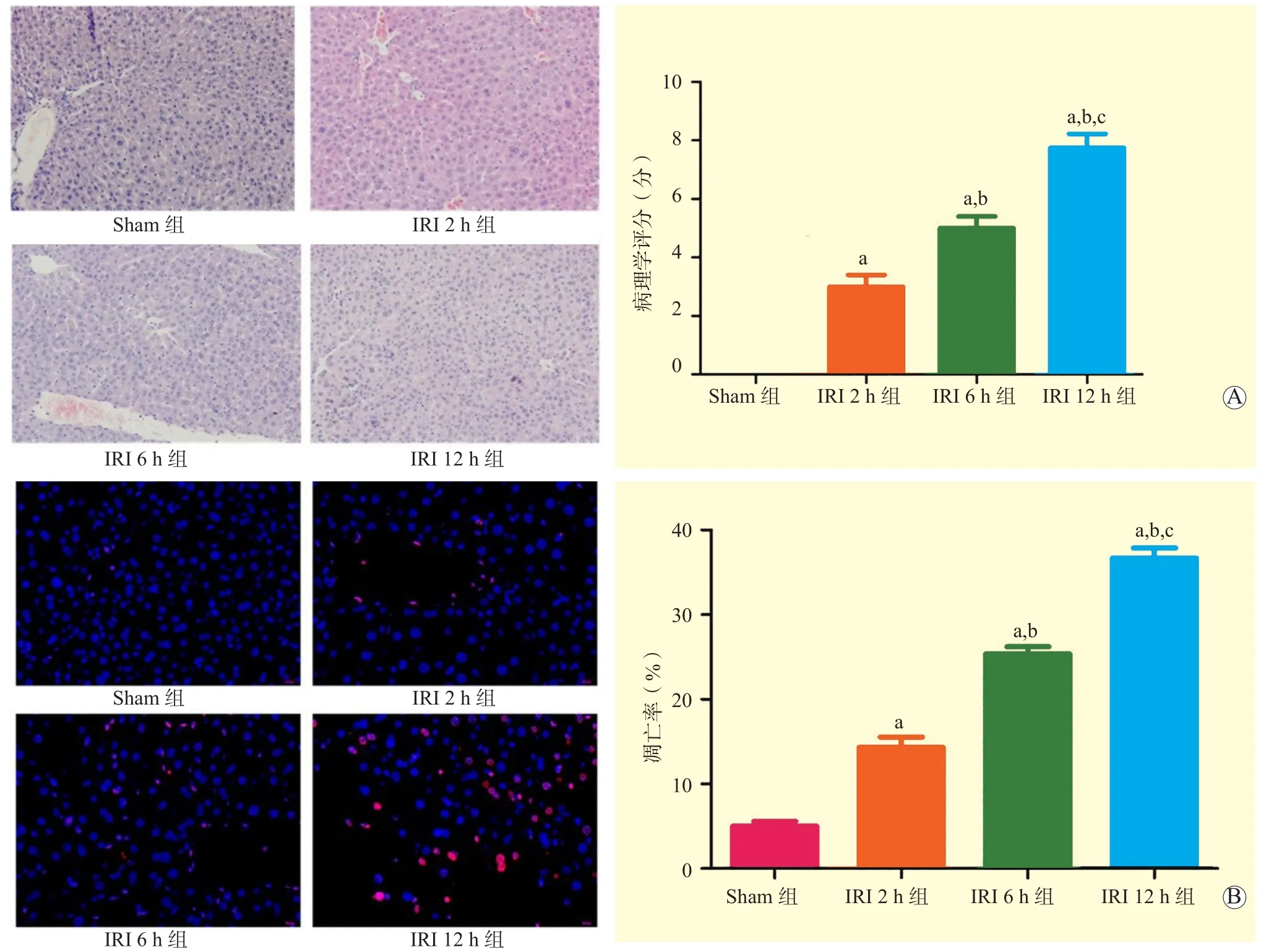
图3 各组小鼠肝组织病理学评分和细胞凋亡率比较Figure 3 Comparison of histopathology score and cell apoptosis rate in liver tissues of mice among each group
2.4 IRI后小鼠肝组织HMGB1表达情况
免疫组化结果显示(图4),与Sham组相比,小鼠肝脏IRI后,HMGB1在肝组织中的表达明显增多,并且其表达量在2~12 h内随着时间延长而增多,这预示着HMGB1蛋白可能参与肝脏IRI的发生和发展。

图4 各组小鼠肝组织HMGB1的表达情况比较Figure 4 Comparison of the expression of HMGB1 in liver tissues of mice among each group
2.5 GA预处理对HMGB1、Caspase-1和GSDMD蛋白表达的影响
蛋白质印迹法结果显示,IRI 12 h组小鼠肝组织的HMGB1、Caspase-1和GSDMD蛋白相对表达量高于Sham组,差异有统计学意义(P<0.05,图5)。与IRI 12 h组比较,GA+IRI 12 h组小鼠肝组织的HMGB1蛋白相对表达量升高,而Caspase-1和GSDMD蛋白相对表达量降低,差异均有统计学意义(均为P<0.05,图5)。
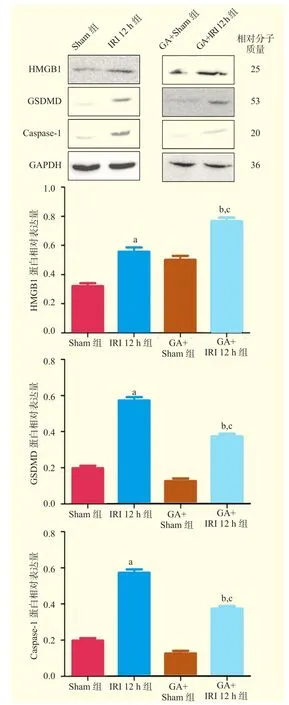
图5 各组小鼠肝组织HMGB1、Caspase-1和GSDMD蛋白表达情况Figure 5 Expression of HMGB1, Caspase-1 and GSDMD in liver tissues of mice among each group
利用AML12细胞系进行体外实验验证,结果发现,与Sham组比较,IRI 12 h组HMGB1、Caspase-1和GSDMD蛋白表达均上调,差异均有统计学意义(均为P<0.05,图6)。与IRI 12 h组比较,GA+IRI 12 h组HMGB1蛋白相对表达量升高,Caspase-1和GSDMD蛋白相对表达量降低,差异均有统计学意义(均为P<0.05,图6)。表明GA可抑制HMGB1由肝细胞向细胞外释放,进而下调Caspase-1与GSDMD的表达。

图6 各组AML12细胞HMGB1、Caspase-1和GSDMD蛋白表达情况Figure 6 Expression of HMGB1, Caspase-1 and GSDMD in AML12 cells among each group
3 讨 论
肝脏IRI对于肝脏外科手术与肝移植术后的疾病转归及受者生存预后具有重要的研究价值,是目前临床上因素较多、环节相扣、机制最为复杂的病理生理过程[23-25]。最新研究表明,HMGB1可通过介导线粒体自噬参与IRI的发生和发展[9]。HMGB1是真核细胞内的一种表达量较多的染色体结合蛋白,广泛分布于机体各组织器官中,参与DNA的重组、修复、基因转录调控、细胞复制及分化等生命活动[7,26-27]。本研究中,小鼠肝脏IRI过程可诱导肝细胞核内HMGB1释放,同时肝组织中成熟的Caspase-1与GSDMD蛋白表达水平显著上调,表明HMGB1/GSDMD 轴可能参与肝脏IRI的病理过程。
在正常生理情况下,HMGB1在细胞核内与DNA的结合是松散的,当细胞受到外界条件刺激或者损伤时,HMGB1则从受损的细胞核内以单纯扩散的方式释放到细胞核外或细胞外,诱发机体的炎症反应[28-30]。HMGB1通过结合内源性模式识别受体激活炎症小体,炎症小体随后激活Caspase家族中的Caspase-1/4/5/11,对于免疫反应的信号传递起到了关键的作用[31]。GSDMD是Caspase蛋白的底物[32],经激活后Caspase-1/11能够特异性地在Asp276、Gly277位点之间对GSDMD进行切割,从而产生N-端以及C-端蛋白,断裂后的GSDMD蛋白的N-端蛋白具有打孔活性,能插入细胞膜形成孔洞,从而引发细胞焦亡[33],相关研究表明,GSDMD基因敲除可以有效阻止细胞焦亡[34-35]。
HMGB1作为多种病理过程的报警因子[36-38],被认为可通过诱导细胞焦亡参与肝脏IRI,其机制多与炎症和机体免疫有关,如ASC/Caspase-1/ IL-1β信号轴可通过促进HMGB1向胞浆外释放而触发机体炎症反应,从而诱导肝脏IRI和细胞焦亡[39]。本研究发现IRI后肝组织Caspase-1和GSDMD蛋白表达水平增高,经GA预处理、缺血-再灌注12 h后,在体内和在体外,Caspase-1和GSDMD蛋白表达水平均显著下调,表明GA可以抑制Caspase-1/GSDMD通路介导的肝细胞焦亡。类似研究发现,齐墩果酸预处理通过减少HMGB1释放、抑制细胞凋亡和自噬减轻肝脏IRI[40]。另有研究报道GA通过抑制HMGB1依赖性GSDMD介导的枯否细胞焦亡减轻肝脏IRI[13]。前期有研究表明HMGB1可以激活Caspase-1/GSDMD信号轴诱导细胞焦亡[8],本研究进一步证实了GA可减少HMGB1向胞外释放,进而抑制HMGB1依赖的Caspase-1/GSDMD 信号轴,从而缓解肝细胞焦亡并减轻肝脏IRI。
综上所述,肝细胞可能通过释放HMGB1激活Caspase-1/GSDMD通路,从而触发肝细胞焦亡,导致肝脏IRI,而通过GA抑制HMGB1向胞外释放可减轻肝脏IRI。HMGB1蛋白在调控细胞焦亡和肝脏IRI中发挥重要作用,本研究为今后治疗肝脏IRI提供了新的临床基础和药物靶点。

