苹果矮化砧‘T337’组织培养及愈伤组织诱导体系研究
封明军 ,雷富臣 ,豆静,王新建 *
(1塔里木大学植物科学学院,新疆 阿拉尔 843300)
(2南疆特色果树高效优质栽培与深加工技术国家地方联合工程实验室,新疆 阿拉尔 843300)
苹果(Malus pumila)属蔷薇科苹果属植物,是世界上五大果树(柑橘、苹果、葡萄、香蕉、梨)之一,主要分布于北温带,横跨欧亚大陆和北美洲,纬向幅度宽达30°(20°~50°N),栽培历史悠久[1-3]。如今,世界苹果产业发展呈矮化栽培的趋势,选择适宜的矮栽品种是实现矮化栽培的关键。苹果组培技术的成熟逐渐为苹果矮化砧木快繁提供了技术保障[4],目前建立的苹果矮化砧木快繁体系主要包括‘M9’‘M26’‘八棱海棠’等[5-7]。近年来,矮化自根砧‘T337’作为世界各国应用最广泛、最成功的脱毒矮化砧木,具有主干性强、易成花、丰产性好以及适应性广等特点,被大量运用于矮化密植园中[8]。当前‘T337’组培快繁报道均以茎尖和茎段作为外植体[7,9],未见以休眠芽为外植体的诱导研究。同时愈伤组织在植株再生、分子机理和转基因等方面研究中被作为重要的试验材料[10-12],由于研究目的不同所需愈伤组织类型不同,通过不同培育条件能够获取目标所需愈伤组织。本试验研究不同外植体类型和消毒时间,探究不同激素组合对启动诱导、增殖培养和愈伤组织诱导的影响,以及叶片暗处理时间与愈伤形成的关系,以期建立‘T337’较优组培诱导方法和叶片再生体系,为推进优化苹果矮化砧组织培养技术提供参考价值。
1 材料与方法
1.1 材料
试验材料于3~4月中旬采自新疆生产建设兵团第一师10团苗圃基地(81°18′E,40°35′N)苹果矮化自根砧‘T337’枝条,将剪下的枝条用保鲜膜包裹带回实验室,插入自来水中培养一周待叶芽饱满接近萌动,使用时将其剪成2~3 cm带单芽的茎段或幼嫩茎尖。
1.2 方法
1.2.1 外植体类型及消毒时间的筛选
试验以单芽茎段和幼嫩茎尖为外植体,通过消毒试验进行筛选适宜的外植体类型。
单芽茎段消毒先用75%酒精处理30 s,后用2%次氯酸钠处理10 min,无菌水冲洗3次,用手术刀将休眠芽鳞片及周围白色绒毛剥去,切下休眠芽进行二次消毒,设置不同消毒时间处理组合,75%酒精三个处理时间(5 s、7 s、9 s),1%的次氯酸钠三个浸泡处理时间(1 min、3 min、5 min),共9个处理组合。
幼嫩茎尖仅采取一次消毒,设置不同消毒时间处理组合,75%酒精三个处理时间(10s、20s、30s),2%次氯酸钠两个浸泡处理时间(10 min、15 min),共6个处理组合,无菌水冲洗3次,接种在诱导培养基(MS+6-BA 1.50 mg·L-1+NAA 0.10 mg·L-1)上。每个处理接种30个外植体,重复3次,接种后置于培养室,温度(25±2)℃,光照强度2000 lx,光照时间14 h/d(后续培养条件皆与此相同),接种30 d后统计污染率、死亡率和褐化率。
污染率=外植体污染数∕外植体接种数×100%
死亡率=外植体死亡数∕(外植体接种数-外植体死亡数)×100%
褐化率=外植体褐化数∕外植体接种数×100%
1.2.2 启动诱导培养基的筛选
选择6-BA与NAA的激素组合,以MS为基本培养基,加入30 g·L-1蔗糖、6.5 mg·L-1琼脂、不同浓度的6-BA(1.00 mg·L-1、1.50 mg·L-1、2.00 mg·L-1)和 NAA(0.10 mg·L-1、0.30 mg·L-1、0.50 mg·L-1),pH值为5.8,以空白MS培养基为对照,共10个处理组合,每个处理接种30个外植体,重复3次,30 d后统计各处理的芽诱导率。
1.2.3 增殖培养基的筛选
将前期诱导获得的幼苗进行增殖培养,以MS为基本培养基,内附加不同浓度的6-BA(0.50 mg·L-1、0.75 mg·L-1、1.00 mg·L-1)和 IBA(0.30 mg·L-1、0.50 mg·L-1),每个处理接种30个外植体,重复3次,30 d后统计各处理芽的增殖系数和平均芽高。
1.2.4 愈伤组织的诱导
选取长势一致的组培苗,用剪刀将叶片剪成大小约0.5 cm2,远轴面朝上接种在培养基上,以MS为基本培养基,设置附加2,4-D与6-BA的组合和6-BA与NAA组合的8个处理,见表1,每个组合接种10瓶,从中选取最优的愈伤组织诱导组合,设置不同的暗培养天数(0 d、7 d、14 d、21 d、28 d),统计愈伤组织诱导情况。
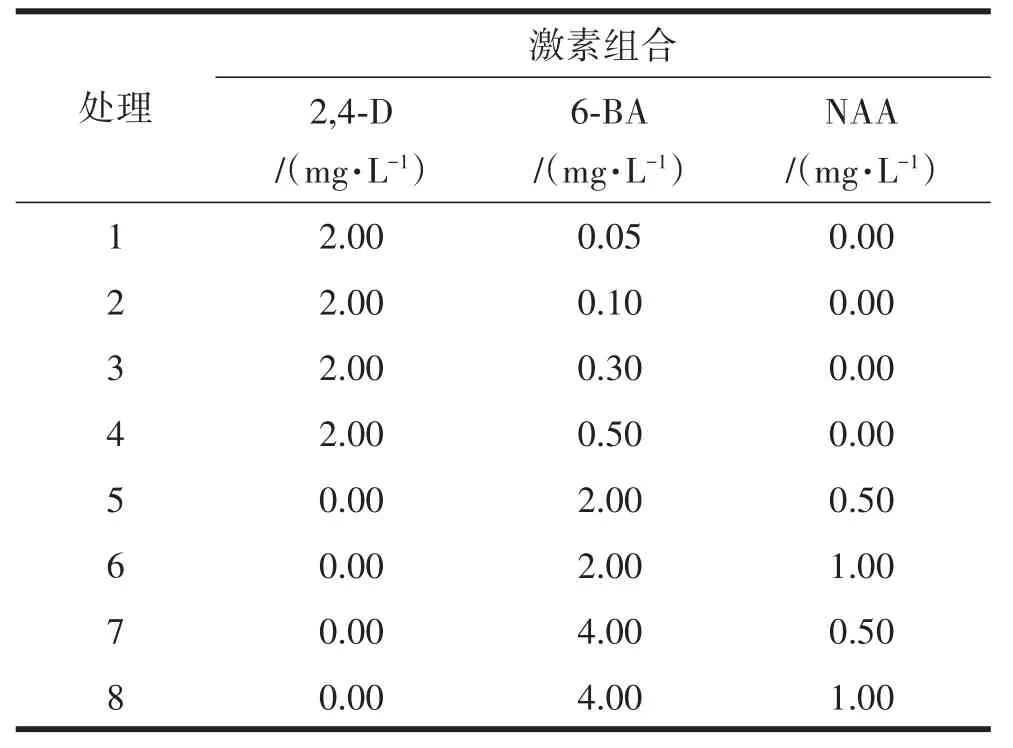
表1 苹果‘T337’叶片愈伤组织诱导组合
1.3 数据分析
试验数据采用Microsoft office Excel 2010和DPS 7.05统计软件进行方差分析和Duncan多重比较分析差异显著性(P<0.05)。
2 结果与分析
2.1 不同外植体类型及消毒时间对‘T337’诱导的影响
从表2可知,随着酒精和次氯酸钠处理时间的延长,休眠芽和茎尖培养的污染率呈下降趋势,死亡率和褐化率呈上升趋势,污染率最高的为休眠芽酒精处理5 s,次氯酸钠浸泡1 min,污染率为58.89%,原因可能是酒精处理时间过短未能使消毒剂次氯酸钠充分渗入消毒造成,但休眠芽消毒褐化率整体结果较低(图1a),且长势较好(图1b、图1c)。死亡率最高的为茎尖酒精处理30 s,次氯酸钠浸泡15 min,死亡率为64.41%,虽然其污染率较低,但同时褐化率也是最高的为70.00%(图1d)。相比两种外植体生长及消毒处理表现,以茎尖作为外植体组培时死亡率和褐化率远高于休眠芽,且宜长愈伤组织不利于芽的诱导(图1e、图1f),说明休眠芽更适宜作为‘T337’组培的外植体材料,综合比较,最优的消毒处理方法为酒精处理5 s,次氯酸钠处理5 min,污染率、死亡率和褐化率都相对较低。
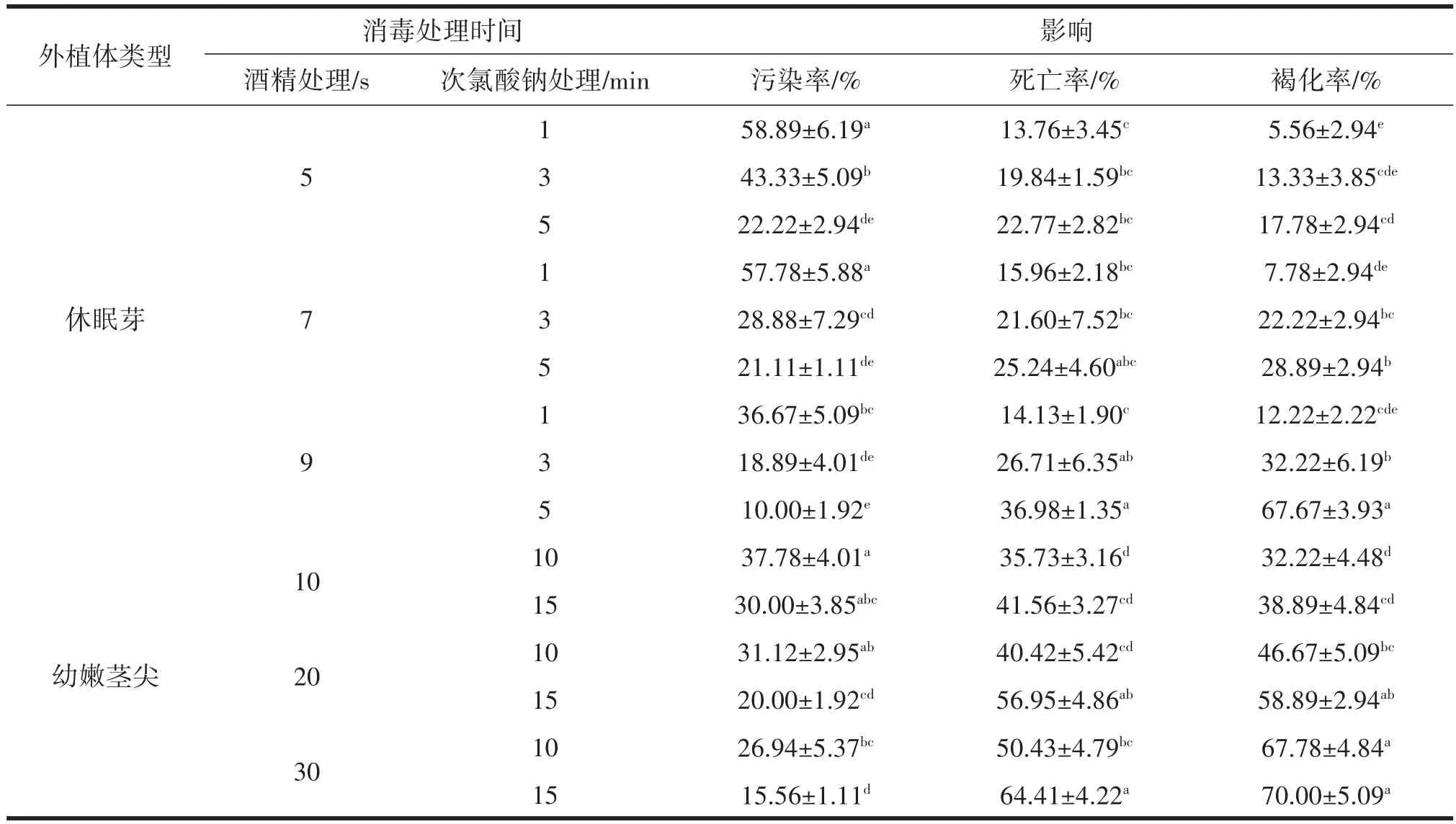
表2 不同外植体类型及消毒时间处理下污染率、死亡率和褐化率的比较

图1 外植体消毒试验
2.2 不同激素配比组合对休眠芽组培诱导的影响
初代培养选用休眠芽作为外植体,由表3可知,当6-BA浓度为1.00 mg·L-1,NAA浓度为0.30 mg·L-1时,休眠芽诱导率最高为63.33%,休眠芽在接种6 d左右开始萌动。在空白MS培养基中,外植体约16 d才有萌发迹象,且萌发后长势较弱。在同一NAA浓度下,诱导率随着6-BA浓度的提升而逐渐下降,在同一6-BA浓度下,诱导率随着NAA浓度的提高而整体趋向于升高。‘T337’休眠芽诱导最适宜的激素组合为6-BA 1.00 mg·L-1+NAA 0.30 mg·L-1,其次为6-BA 1.50 mg·L-1+NAA 0.50 mg·L-1。
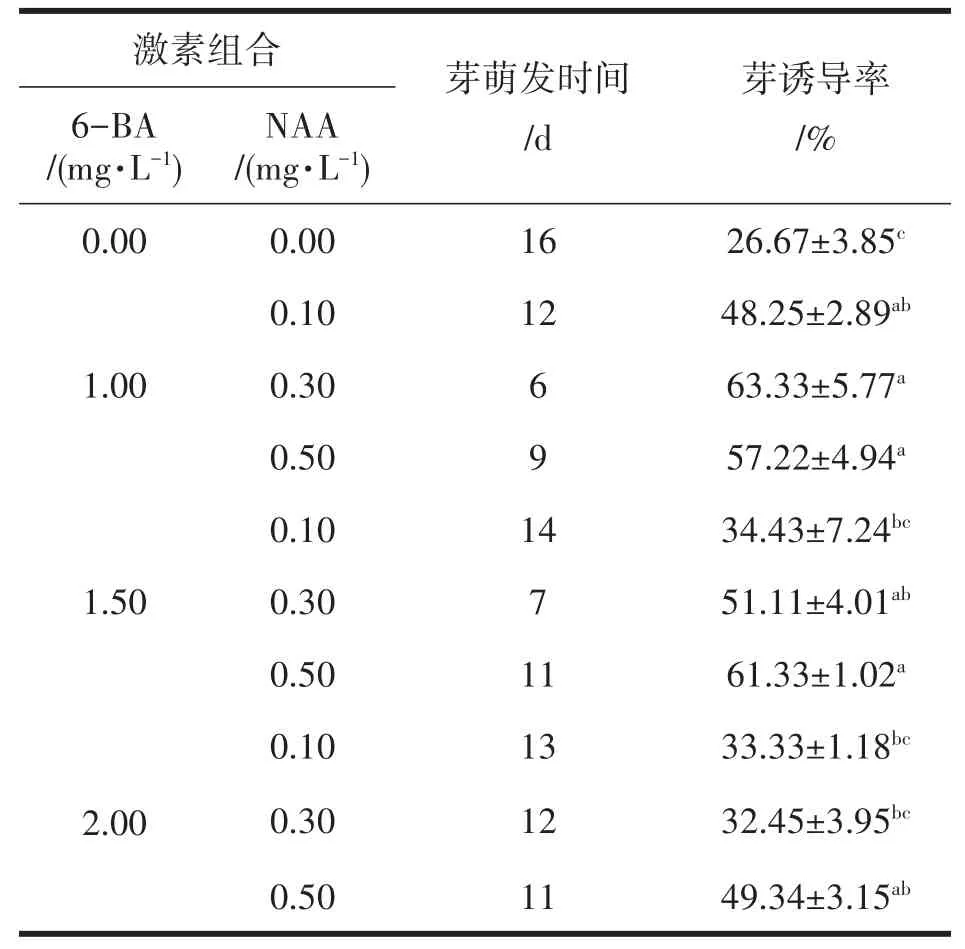
表3 不同激素配比对休眠芽萌动与诱导的影响
2.3 不同激素配比组合对组培苗增殖培养的影响
增殖试验结果见表4,在6-BA浓度逐渐增加时,增殖系数整体呈先上升后降低的趋势,在6-BA浓度为 0.75 mg·L-1,IBA 为 0.50 mg·L-1时增殖系数为2.60,平均芽高为2.41 cm,均达到最高值,且组培苗生长旺盛,叶片翠绿(图2a),其增殖系数除了与6-BA 0.50 mg·L-1+IBA 0.30 mg·L-1(图2b)激素组合无显著差异外,均显著高于其他浓度处理;平均芽高除了与 6-BA 0.75 mg·L-1+IBA 0.30 mg·L-1激素组合无显著差异外(图2c),均显著高于其他浓度处理。综合考虑,适宜‘T337’增殖培养的6-BA添加量为0.75 mg·L-1,IBA添加量为0.50 mg·L-1,其生长状态最理想。

图2 组培苗增殖试验

表4 不同激素配比对组培苗从生芽诱导的影响
2.4 不同处理对愈伤组织形成的影响
2.4.1 不同激素处理对‘T337’叶片愈伤组织形成的影响
由表5可知,含有2,4-D激素的组合(图3a~图3d),除了处理1外均能高效地诱导愈伤组织,且愈伤组织发生较快,最快的为7天,愈伤组织特征均较为致密,且诱导率随着6-BA浓度的上升而增加。含有6-BA和NAA的组合(图3e~图3h),诱导的愈伤组织整体较疏松,愈伤开始发生的时间也较晚,在6-BA浓度加倍情况下,愈伤组织也能比较有效地形成,但颜色和质地较含有2,4-D的组合差,且各处理间愈伤形成差异较大。说明愈伤组织的形成在2,4-D和NAA一定范围浓度下可以产生类似的组织,而在仅使用6-BA和NAA时愈伤组织形成会较明显受到浓度变化的影响。综上,最佳的激素组合为处理4,愈伤组织发生时间为7 d,诱导率为69.33%

表5 不同激素配比对叶片愈伤组织形成的影响

图3 叶片愈伤组织诱导试验
2.4.2 不同暗培养天数对愈伤组织形成的影响
选取最优的愈伤组织诱导组合2,4-D 2.00 mg·L-1+6-BA 0.50 mg·L-1的培养基进行暗培养。由表6可知,全光照培养条件下基本无愈伤组织形成,且形成的少数愈伤组织质地较差,最终会逐渐变褐死亡。最佳的暗培养天数以7~14 d为宜,形成的愈伤组织转入光照培养后增殖速度快,颜色鲜艳有光泽;若超过14 d暗培养时间,愈伤组织增殖速度慢,且逐渐呈灰白色、底部变褐。因此说明‘T337’叶片愈伤组织的诱导需要7~14 d的黑暗条件来启动,而后应尽快转入光照条件下进行后续的生长分化。

表6 不同暗培养天数对愈伤组织形成的影响
3 讨论
苹果组织培养过程中外植体的建立尤为重要,选取合适的外植体类型直接影响无菌苗的获取效率。理论上植物细胞具有全能性,任一部位都能诱导出完整的植株,但各个部位所诱导的结果存在差异[13]。在以往有关‘T337’组培诱导的研究中外植体材料均为茎段和茎尖[7,9],以休眠芽为外植体的研究在果树中报道较少,在有关柿[14-15]的组织培养中也少有报道。通过对比茎尖和休眠芽两种外植体消毒结果,说明休眠芽更适合作为外植体材料,进行二次消毒的方法能有效避免将茎尖作为外植体时褐化率过高,同时使死亡率和污染率保持较低水平。另外,消毒时间直接影响外植体的建立,同属不同种的不同外植体器官所需消毒时间也存在一定的差异,本试验表明随着消毒时间的延长,外植体组织所受毒害越重[16],褐化率死亡率越高,造成诱导效果不理想的结果与成思琼等[7]对‘T337’的消毒试验研究结果一致。
在外植体启动阶段,植物外植体生长发育情况受到不同植物生长调节剂种类、配比和浓度的影响[17],试验在同一NAA浓度下,随着6-BA浓度的增加,诱导率逐渐降低,在6-BA浓度为1.00 mg·L-1时,其诱导率最高,这与马荣群等[18]研究结果一致,在启动培养基中添加6-BA1.00 mg·L-1和NAA0.01 mg·L-1的萌芽诱导效果较好。在增殖培养中,增殖系数是衡量增殖效果的重要指标,成思琼等[7]和韩秀清[9]对‘T337’继代培养研究表明,6-BA和IBA浓度在0.50~0.75 mg·L-1之间增殖系数和平均芽高均保持较高水平,本研究与其结果相似。在培养基上添加不同浓度的6-BA、NAA和IBA来观察外植体启动诱导和增殖培养的变化,为优化‘T337’组织培养方法和再生体系提供理论基础,但其他种类和浓度的植物生长调节剂对‘T337’组织培养诱导体系的影响和作用有待进一步深入研究。
叶片愈伤组织的诱导中通过不同配比及浓度的外源激素能够获得目标所需且质地优良的类型,高兵等[19]在“嘎拉”苹果叶片愈伤组织诱导中发现含2,4-D的组合都能比较高效地诱导愈伤组织的形成,但随着2,4-D浓度的变化,愈伤组织的特征变化也较大,这与本试验结果存在部分差异,可能是由于基因型不同产生愈伤组织形态特征及所需的激素种类和浓度也存在差异。外界环境因素,如温光等都能够明显影响苹果植株组织培养的过程,而其中暗培养是诱导叶片愈伤形成的关键步骤之一。王瑞敏等[20]对‘高原之火’北美海棠的叶片进行愈伤诱导发现,光照培养下叶片无愈伤产生,而转入暗培养第7 d可诱导出生活力旺盛的幼嫩白色愈伤,至15 d时大量的愈伤组织长出。本试验完全光照培养的叶片愈伤组织诱导率极低,而经过7~14 d暗培养形成的愈伤组织转入光照培养后增殖速度快,颜色鲜艳有光泽,说明适宜天数的黑暗条件能够有效地诱导出愈伤组织。这与孙克聪[10]的研究结果一致,‘T337’叶片愈伤组织诱导需要暗培养天数为14 d。崔美等[21]在‘国光’‘富士’苹果叶片愈伤组织诱导及达克东等[22]在‘千秋’苹果叶片愈伤组织诱导上均有同样的结论。目前关于苹果矮化砧‘T337’组培快繁的研究较少,叶片愈伤组织的诱导及再生体系的构建有待进一步地深入研究。
4 结论
本试验结论表明,‘T337’最佳外植体类型为休眠芽,且采取二次消毒,先用75%酒精处理30 s,2%次氯酸钠处理10 min,然后二次消毒为75%酒精处理5 s,1%次氯酸钠处理5 min。最适宜的启动诱导激素组合为 6-BA 1.00 mg·L-1+NAA 0.30 mg·L-1,在第6 d芽就开始萌发,诱导率高达63.33%。增殖培养在6-BA 0.75 mg·L-1+IBA 0.50 mg·L-1培养基中增殖数最多为2.60且平均芽高最高为2.41 cm。叶片愈伤组织的诱导在含有2,4-D的培养基中诱导的愈伤组织较致密且生长较快,激素组合为2,4-D 2.00 mg·L-1+6-BA 0.50 mg·L-1时愈伤组织诱导率最高为69.33%,暗培养最佳时间为7~14 d。

