FM-生物菌肥在设施温室马铃薯微型薯生产中的应用
姚乔花,程永龙,王姣敏*,吕海龙,魏镛频,安 德,安学文
(1.定西市安定区农业技术推广服务中心,甘肃定西 743000;2.定西市农业科学研究院,甘肃定西 743000;3.甘肃汇丰农业科技发展有限公司,甘肃定西 743000)
生物菌肥广义上是指微生物经诱变、复壮后,与草木灰、褐煤、粉煤灰等混合在一起,经过发酵后加工而成的生物制剂,不含氮、磷、钾等营养元素,是一种微生物组合物。生物菌肥含有活体微生物,不是传统意义上的肥料[1-4],施用后不破坏土壤原有结构、有助于保持土壤养分的平衡,且对动植物均无毒。
我国现有的生物菌肥产品较多,近年来,有关菌肥的研究多集中在固氮菌类、微生物拌种剂和复合菌类等方面[5]。马铃薯营养丰富、适应性强[6-7],是一种重要的粮食及蔬菜作物,栽培面积广,被认定为第四大粮食作物,在保障全球粮食安全中扮演重要角色。2015 年,农业部正式提出“马铃薯主粮化战略”,有力推动了中国马铃薯产业发展;2018 年,我国马铃薯种植面积达到4.9×106hm2。研究表明,在常规生产下生物菌肥及其有益菌的代谢产物能有效促进马铃薯的生长、提高其产量[8-10]。马铃薯微型薯可进行工厂化生产,以及用于大规模、高标准生产马铃薯脱毒种薯。由于微型薯体积小、质量轻,便于大批量运输,解决了马铃薯调种运输困难的问题,成为脱毒种薯生产的主要措施之一,因此种植范围不断扩大。为了探索生物菌肥在马铃薯微型薯上的应用效果,本研究检测了马铃薯微型薯生长指标、粒数分级及光合作用相关参数,探究不同浓度的FM-生物菌肥对马铃薯生长、产量及产量合格率(商品率)的影响,以期为生物菌肥在马铃薯微型薯的种植上提供一些数据支撑。
1 试验材料
1.1 供试品种
供试马铃薯品种为‘青薯9 号’脱毒苗,苗龄为25 d。
1.2 供试肥料
FM-生物菌肥:N-P-K≥12%,有效活菌数≥0.50 亿/mL,液状,pH 值为6.8,由甘肃富民生态农业科技有限公司提供。
1.3 仪器与设备
智能微型薯点数机,昆山食品机械有限公司;7200分光光度计,尤尼柯(上海)仪器有限公司;便携式光合仪(MC-1020),北京盟创伟业科技有限公司。
1.4 试验概况
本试验栽培设施为日光温室,顶高2.80 m,钢管骨架,长40 m,宽6.5 m,棚面覆盖50 筛目的尼龙网纱防止害虫进入,特别是马铃薯病毒主要传播媒介——蚜虫。结合旋地每667 m2施入腐熟的牛粪2 000 kg、复合肥(N-P-K:18-18-18)40 kg,整地,地面铺设一层尼龙网纱,用砖块每隔250 cm 做一条走道,宽24 cm,走道中铺好蛭石,将马铃薯微型薯脱毒苗栽入蛭石,加盖遮阳网遮阳,进入正常管理。
在苗期、结薯期追施三维全效有机肥(N-P-K:16-8-16),每667 m2用量为40 kg;住商复合肥(N-P-K:16-8-22),每667 m2用量为20 kg。本试验所选小区面积16.25 m2,每667 m2种植166 750 株。
1.5 试验设计
本试验设在西川园区日光温室进行,试验于2021 年7—11 月进行,马铃薯脱毒苗于7 月11 日移栽于温室,株行距4 cm×10 cm,7 月下旬进行茎部压苗,8 月上旬进行压苗,10 月10 日扣棚,11 月中旬收获。
试验采用单因素随机区组设计,设5 个处理,按FM-生物菌肥不同的稀释倍数进行叶面喷施,稀释倍数分别为300 倍(T1)、400 倍(T2)、500 倍(T3)和600 倍(T4),以不喷施为对照。以1 畦为1 个处理,共设3 次重复,每个处理面积为2.5 m×6.5 m。其中,每隔30 d(9 月1 日、10 月1 日、11 月1 日)用喷雾器根据稀释倍数喷施1 次,共喷施3 次。
1.6 测定项目及方法
1.6.1 生长指标测定
观测记载马铃薯微型薯生长情况,分别于叶面肥喷施后一周(9 月8 日、10 月8 日、11 月8 日)测定脱毒苗的株高、茎粗和叶片厚度。株高用直尺测量,从地面到新叶最顶端的距离;茎粗用游标卡尺测量,离地面1 cm 处测量植株的直径;叶片厚度用游标卡尺测量,测量植株顶端从上往下第3 片叶的厚度。
1.6.2 产量测定
收获后分级测定马铃薯微型薯产量,用分粒机进行数粒分级。
1.6.3 功能叶的叶绿素含量
马铃薯脱毒种苗定植后,分别于叶面肥喷施后一周(9 月8 日、10 月8 日、11 月8 日)测定叶片色素。选取植株由顶端数第3 片抽生功能叶片(能够进行光合作用,积累有机物,并将积累的有机物运送到生长中心的叶片),将选取的叶片清洗后用滤纸吸干[11]。剪碎叶片中间部分混匀,然后称取0.1 g 叶片放入25 mL 具塞试管中,加入10 mL、80%的丙酮浸没叶片,于黑暗环境下充分浸提。每12 h 震荡1 次,至48 h 叶片发白时,用分光光度计在663 nm、645 nm 两个波段进行比色。按照公式(1)~(4)计算光合色素含量。
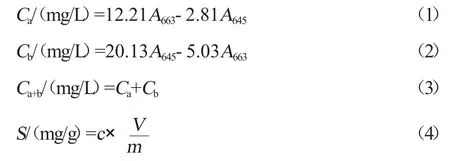
式中,Ca为叶绿素a 浓度,mg/L;Cb为叶绿素b 浓度,mg/L;Ca+b为叶绿素a 和叶绿素b 的总浓度,mg/L;A663、A645分别为叶绿素溶液在663 nm、645 nm 处的吸光度,S为叶绿素含量,mg/g;c为叶绿素浓度,mg/L;V为提取液体积,mL;m为样品质量,mg。
1.6.4 光合参数
于马铃薯原种收获期的上午9:00—11:00,选择晴朗天气测定光合指标。采用便携式光合仪,每小区选取6~10 株测定顶端向下数第3 片功能叶的叶片蒸腾速率(Tr)、光合速率(Pn)、气孔导度(Gs)及胞间二氧化碳(Ci)。
1.7 数据处理
数据用IBMSPSS Statistics 19.0 软件进行方差分析。
2 结果与分析
2.1 不同浓度FM-生物菌肥对马铃薯微型薯生长表现的影响
2.1.1 不同浓度FM-生物菌肥对微型薯株高的影响
图1 显示了FM-生物菌肥不同处理组马铃薯微型薯的株高。由图知在第1 次测定时,各处理组株高与对照组之间无明显区别,第2、3 次测定时,马铃薯微型薯脱毒苗株高为T3>T4>T2>T1>CK。T3 处理组在3 次追施之后马铃薯微型薯脱毒苗的株高分别为23.5、38.4、47.6 cm,均为同一时间内最高,分别比对照组高4.9、4.5、4.5 cm;其次为T4 和T2 处理组。T2、T3、T4 处理组在第2 次和第3 次测定时与T1、CK 组有明显差异(P<0.05)。

图1 FM-生物菌肥不同处理对马铃薯微型薯株高的影响Fig.1 The effect of different treatments of FM-biological fertilizer on the plant height of mini-potatoes
整体而言,稀释倍数为500 倍时株高最大,其次为稀释600 倍和400 倍的,稀释300 倍时,株高与对照组接近。这说明FM-生物菌肥不同的稀释倍数对株高都有促进作用,稀释倍数为500 倍时株高最大。
2.1.2 不同浓度FM-生物菌肥对茎粗的影响
图2 显示了FM-生物菌肥不同处理组脱毒苗的茎粗,3 次测定时株高均为T3>T4>T2>T1>CK,T3 处理组马铃薯微型薯脱毒苗的茎粗最大,分别为4.78、9.24、12.66 mm,比对照高0.28、2.14、3.69 mm;其次为T4 处理组,在3 次测定时作用效果稍弱于T3 处理组的,分别比对照粗0.11、1.90、3.53 mm;然后是T2 和T1 处理组。
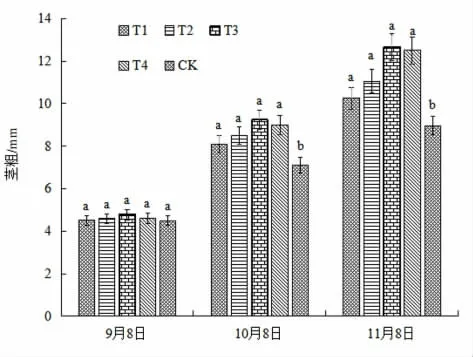
图2 FM-生物菌肥不同处理对马铃薯微型薯茎粗的影响Fig.2 The effect of different treatments of FM-biological fertilizer on the stem thickness of mini-potatoes
在第1 次测定时,各处理组跟对照组结果近似,第2次和第3 次测定时,各处理与对照间均有显著差异(P<0.05)。可见追施不同稀释倍数的FM-生物菌肥对茎粗都有促进作用,稀释倍数为500 倍时茎粗最高。
2.1.3 不同浓度FM-生物菌肥对马铃薯微型薯叶片厚度的影响
各处理组在3 次测定时叶片厚度如图3 所示。由图知,T3 处理组马铃薯微型薯脱毒苗的叶片厚度在第1 次和第2 次测定时期最高,分别为1.15 mm、1.39 mm,比对照组厚0.17 mm 和0.27 mm。在第3 次测定时则是T4 处理组的叶片厚度最大,为1.58 mm,比对照组厚0.25 mm。第1 次测定时,T3 处理叶片厚度与其余几组差异明显,第2 次和第3 次测定时,四个处理组与对照均差异显著(P<0.05)。这说明FM-生物菌肥不同的稀释倍数对叶片厚度都有促进作用,第1、2 次测定时稀释500 倍叶片厚度最大,稀释倍数为600 倍时在第3 次追施后叶片厚度最大。
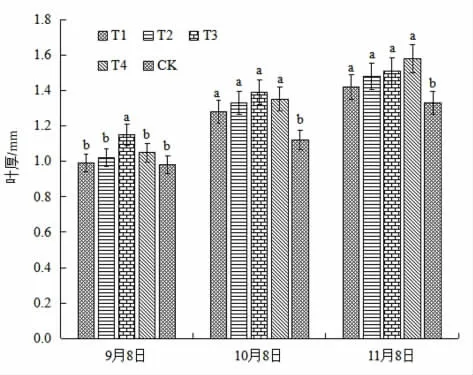
图3 FM-生物菌肥不同处理对马铃薯微型薯叶片厚度的影响Fig 3 The effect of different treatments of FM-biological fertilizer on the leaf thickness of mini-potatoes
从整个试验周期来看,FM-生物菌肥不同稀释倍数对株高、茎粗及叶片厚度均有不同程度的促进作用,其中,500 倍处理时植株株高和茎粗均最大。600 倍处理在第3 次测定时叶片最厚。稀释400 倍和300 倍的生长指标虽低于500 倍和600 倍,但仍比对照组高。在本实验中,稀释倍数为500 倍的生长指标优于浓度最大的300倍;从生长指标来看,生物菌肥的浓度并不是越高越好,因此,在施用生物菌肥时,应探寻出最适宜的施用浓度。
2.2 不同浓度FM-生物菌肥对马铃薯微型薯分级和合格粒数的影响
由表1 可知,FM-生物菌肥不同处理脱毒苗的薯块分级及合格率均有所不同。其中,T3 处理组马铃薯微型薯脱毒苗产量最高,单株粒数、总粒数、合格率也均为各组内最高。T3 组单株粒数达到3.2 粒,比对照组高0.6粒;总粒数为800.4 万粒/hm2,比对照组高150.1 万粒/hm2;合格率为95.4%,比对照组高10%。分级2~5 g和>5 g 为合格微型薯,T3 组在这两个级别的粒数均最多。T4 处理组稍低于T3 组,合格率为93.5%,比对照组高7.9%;T2 和T1 处理组合格率分别比对照组高6.5%和4%。T3 处理组的单株粒数与其余4 组差异明显(P<0.05);总粒数和合格率与T4 处理组差异不明显,与其他三组则有明显差异。
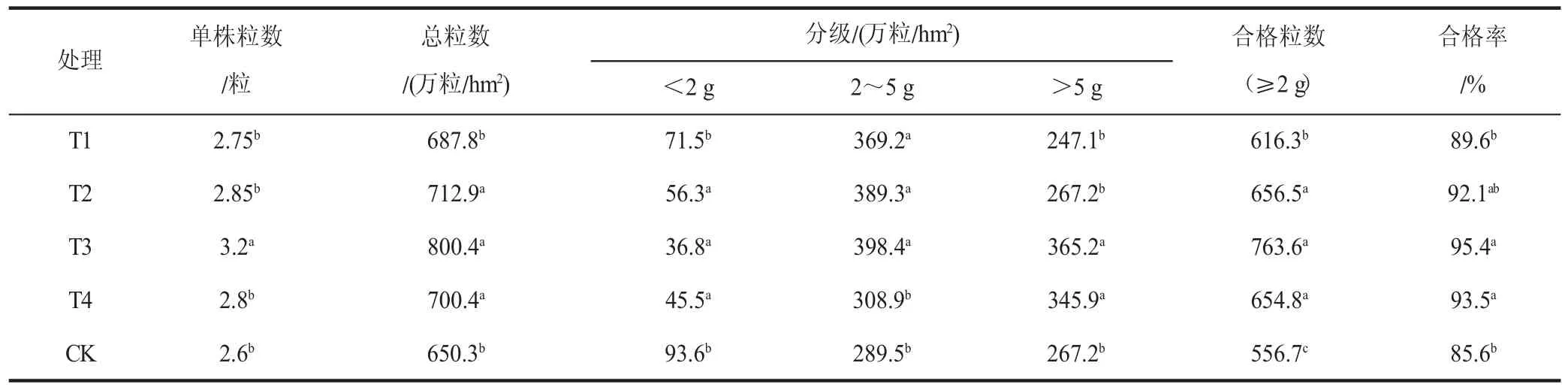
表1 FM-生物菌肥不同处理对马铃薯微型薯块分级及合格率的影响Table 1 The effect of different treatments of FM-biological fertilizer on the classification and qualification rate of mini-potato chunks
实验结果表明,FM-生物菌肥不同的稀释倍数对产量和合格率都有促进作用,稀释倍数为500 倍时对马铃薯微型薯产量和合格率的促进作用最大。
2.3 不同浓度FM-生物菌肥对马铃薯植株功能叶色素的影响
由表2 可知,叶片的叶绿素含量随着稀释倍数增加而不同。其中,T4 处理组叶绿素含量最高,在3 次追施后均高于其他处理,在第3 次追施后,叶绿素a、叶绿素b和叶绿素a+b 含量分别为1.732、0.605、2.337 mg/g,比对照组高0.377、0.045、0.422 mg/g。其次分别为T3、T2 和T1处理,均高于对照组。在整个测定过程中,各处理组与对照均有显著差异(P<0.05);第2 次和第3 次测定时T4处理组与其余各组差异明显(P<0.05),T3、T2、T1 组之间差异不显著。
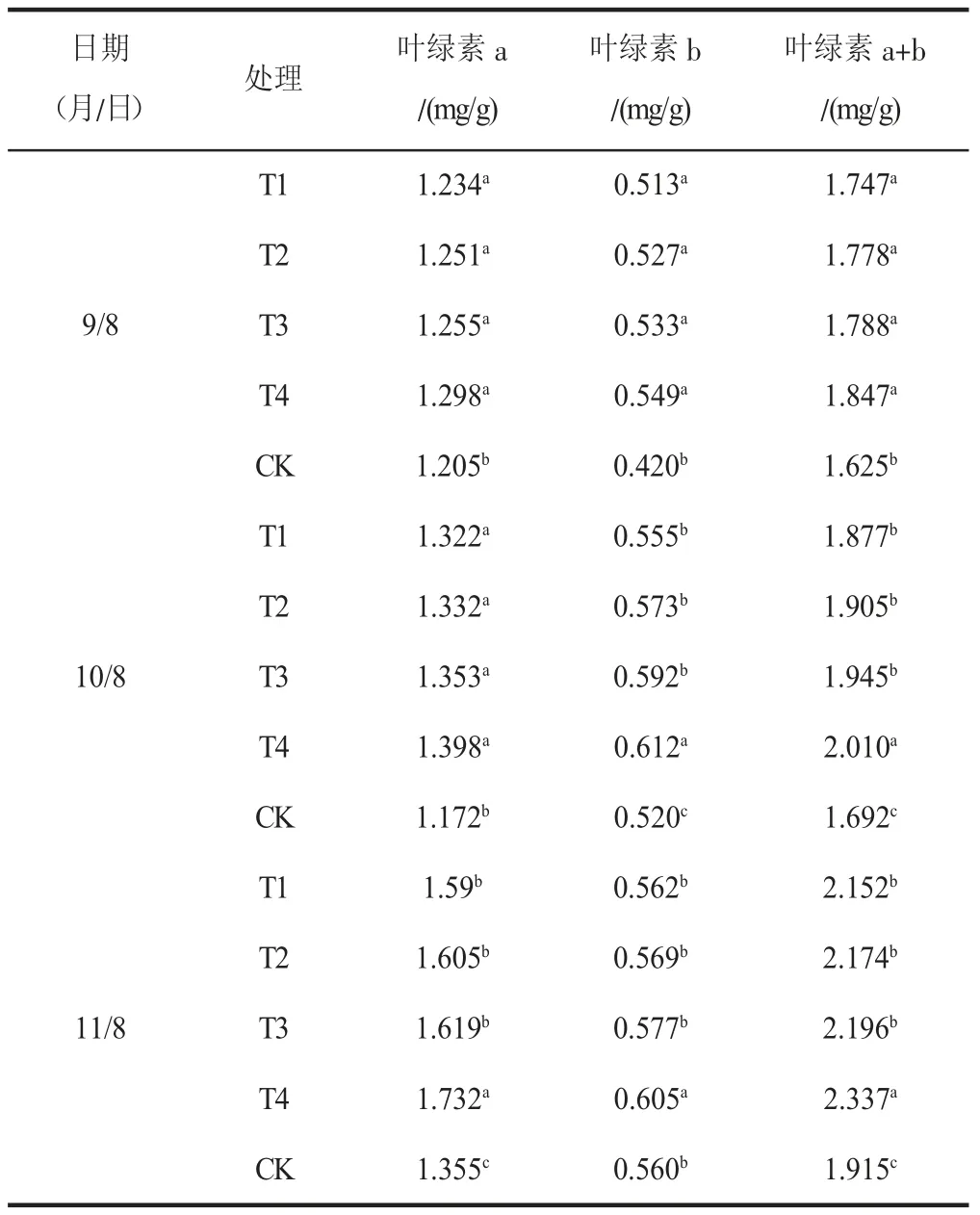
表2 FM-生物菌肥不同处理对马铃薯微型薯植株功能叶色素的影响Table 2 Effects of different treatments of FM-biological fertilizer on functional leaf pigments of mini-potato plants
由于生物菌肥处理有固氮作用,因此,适当浓度的生物菌肥处理可以有效提高马铃薯植株对氮素的吸收,促进植株叶绿素含量的增加[6]。本实验结果显示,叶绿素含量与生物菌肥浓度有关,其中,稀释倍数为600 时叶绿素含量最高,这也说明生物菌肥对植株叶绿素含量有很好的促进作用,特别是施用适宜浓度的生物菌肥。
2.4 不同浓度FM-生物菌肥对马铃薯植株光合参数的影响
由表3 可以看出,各处理组对马铃薯植株光合参数的影响不同,T4 处理组的影响最大,蒸腾速率为3.79 nmol/(m·s),比对照组高0.89 nmol/(m·s);光合速率为17.33 μmol/(m·s),比对照组高6.21 μmol/(m·s);气孔导度为0.22 mol/(m·s),高出对照组0.15 mol/(m·s);二氧化碳浓度为345.00 μmol/(m·s),比对照组高68.78 μmol/(m·s)。T3、T2 的蒸腾速率、光合速率、气孔导度和二氧化碳浓度也均高于对照组;T1 除气孔导度与对照组相同外,蒸腾速率、光合速率和二氧化碳浓度也都高于对照组。T4 对于蒸腾速率、二氧化碳浓度的影响,与其余四组处理相比差异明显(P<0.05);T4、T3 对光合速率和气孔导度的作用效果较为相似。
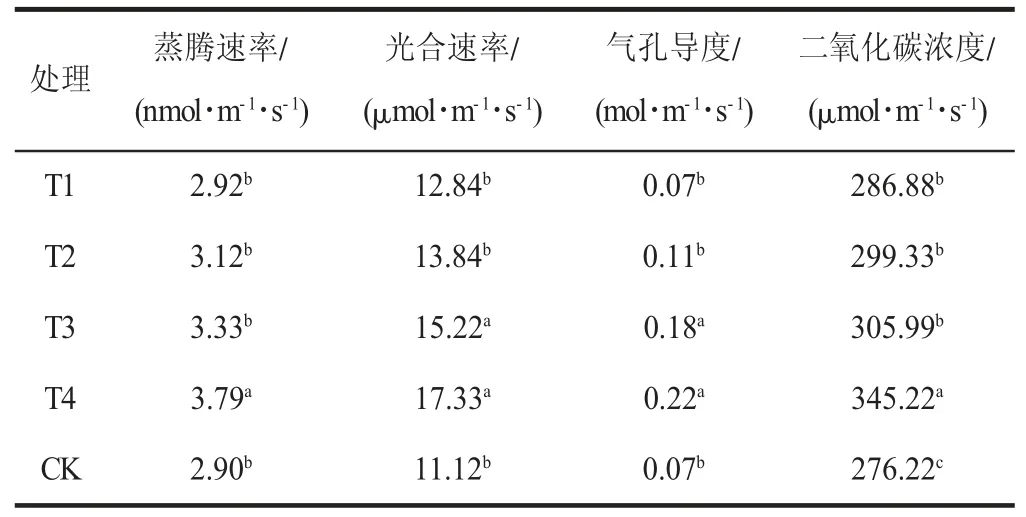
表3 FM-生物菌肥不同处理对马铃薯微型薯植株光合参数的影响Table 3 Effects of different treatments of FM-biological fertilizer on photosynthetic parameters of mini-potato plants
从整体分析看,不同浓度FM-生物菌肥对马铃薯植株光合参数的影响不同,稀释倍数越高,蒸腾速率、光合速率、气孔导度和二氧化碳浓度等指标越高。从以上指标的测定可以看出,施用适当浓度的生物菌肥,可以在很大程度上促进植物的光合作用,对马铃薯生长有利。
3 结论
有研究表明,生物菌肥在番茄、黄瓜、小白菜等蔬菜上施用后产量较对照组可明显增加作物的产量[12-16]。生物菌肥通过固定氮素、分解磷素、分解钾素等作用,可将土壤中作物需要但不能被吸收的某些元素转化为营养成分,供作物吸收,为农作物提供了生长发育所需的多种营养成分,提高作物的产量。
本试验在施用有机肥的基础上,增施不同稀释倍数的FM-生物菌肥,发现不同浓度的生物菌肥在第2 次追施后,均可促进马铃薯微型薯的生长,通过对马铃薯粒数分级的检测结果也显示生物菌肥能够提高作物产量,适宜浓度的生物菌肥处理能大幅提高作物的产量,其中稀释500 倍处理组的效果最好,总粒数达到800.4 万粒/hm2,合格率高达95.4%,极大地提高了产量和合格率;然后是稀释600 倍的,再次为稀释400 倍的,稀释倍数300 倍的作用不明显。通过检测马铃薯功能叶绿素和光合作用参数,也证明生物菌肥可以促进作物光合作用,但追施不同浓度生物菌肥的光合作用与生长指数、产量等规律稍有区别,值得进行进一步的探究。整体来说,以稀释500 倍的FM-生物菌肥作为追肥,能很好地促进马铃薯微型薯的生长,提高产量和商品率。

