脊尾白虾UCHL5的基因克隆及其在卵巢发育中的功能研究*
高 威 戴 琴 张 攀 宋崇阳 朱杉杉 赖晓芳 ,2,3 高 焕 ,2,3 阎斌伦 ,2,3①
(1. 江苏省海洋生物资源与生态环境重点实验室 江苏省海洋生物技术重点实验室 江苏海洋大学江苏 连云港 222005;2. 江苏省海洋生物产业技术协同创新中心 江苏 连云港 222005;3. 江苏省农业种质资源保护与利用平台 江苏 南京 210014)
泛素-蛋白酶体途径(ubiquitin-proteasome pathway, UPP)是广泛存在于真核生物中的一种高效的蛋白质降解途径,单个或者多个泛素分子通过一系列酶的作用结合到底物蛋白上,被标记的蛋白可被特异性地识别并被降解(于佳瑞等, 2019)。然而这一过程并不是不可逆的,去泛素化的存在使得泛素化这一修饰过程可以保持在一个稳定的状态,去泛素化酶(deubiquitinating enzymes, DUBs)可将已经泛素化的蛋白上的泛素移除,防止底物蛋白的降解(贾雪冰等,2020)。UCH 家族(ubiquitin carboxy termina hydrolases,UCH)的结构在去泛素化酶家族中是最先被发现和报道的,UCH家族属于半胱氨酸蛋白酶,大多是小分子蛋白,通常作用于一些小分子的蛋白底物,通过裂解C末端76位的甘氨酸,将泛素单体释放出来(陈雨晗等, 2014)。研究表明,UCH家族与生殖调控有着密切的关系,Mochida等(2002)研究发现,UCH的mRNA在罗非鱼(Oreochromsmossambcus)的脑和卵巢中表达,并且通过免疫组织化学分析发现,UCH定位在罗非鱼卵巢的卵黄发生前期的卵母细胞中,推测其对卵母细胞的生长有重要作用。
Han等(2018)研究发现,UCHL3和UCHL5在拟穴青蟹(Scylla paramamosain)卵巢中的表达水平显著高于其他组织,表明其在拟穴青蟹的性腺发育中起着重要的作用。孙兆贵等(2003)研究发现,中华大蟾蜍(Bufogargarizans)泛素羧基末端水解酶(tUCH)对卵母细胞成熟过程中卵泡的破裂起到调控作用。
脊尾白虾(Exopalaemon carinicauda)具有繁殖周期短、生长速度快、适应性强等优点,是我国特有的经济虾类之一(王盼等, 2021)。王绪峨(1987)初步研究了脊尾白虾的性腺发育、生殖蜕皮、交尾、产卵等生理活动。栗治国等(2014)利用石蜡切片和 HE染色技术对脊尾白虾的精巢和卵巢进行组织结构观察,将脊尾白虾卵巢发育分为增殖期(Ⅰ)、小生长期(Ⅱ)、大生长期(Ⅲ)、成熟期(Ⅳ)和产后恢复期(Ⅴ) 5个时期。除细胞水平的研究外,对性腺发育的研究也深入到了分子水平,许多与脊尾白虾卵巢发育相关的功能基因也被相继报道(李志敏等, 2016; 马骊等, 2018; Liang et al, 2020)。但关于UCHL5基因在脊尾白虾卵巢发育中的功能研究尚未见报道。本研究拟克隆脊尾白虾UCHL5全长cDNA序列,并分析其在不同组织和卵巢发育不同时期的表达情况,构建UCHL5原核表达载体并诱导表达,为在分子水平上阐明脊尾白虾的卵巢发育机制提供理论基础。
1 材料与方法
1.1 实验材料
本研究所用脊尾白虾是由实验室自繁而来的同一个家系中的个体。选取身体健康、大小一致[体长为(5.90±0.30) cm,体重为(1.65±0.12) g]的脊尾白虾,取眼柄、鳃、心脏、肝胰腺、卵巢、胃、肠、腹索神经和肌肉9个组织(每个组织样品均由 3只虾混合而成),加入Trizol后于-80℃保存。参照栗治国等(2014)对脊尾白虾卵巢分期的方法,根据卵巢的形状、颜色,取不同卵巢发育时期的脊尾白虾卵巢组织,以相同的方法保存。
1.2 总RNA提取及cDNA合成
1.2.1 总 RNA 的提取 采用 UNIQ-10柱式 Trizol总RNA提取试剂盒[生工生物工程(上海)股份有限公司]分别提取上述组织RNA,1%的琼脂糖凝胶电泳检测RNA的完整性,Gene Quantity Pro测定 RNA的纯度及浓度,合格的RNA样品于-80℃备用保存。
1.2.2 cDNA 第一链的合成 使用 SMARTer RACE 5′/3′试剂盒(TaKaRa),以脊尾白虾9个组织混合RNA为模板分别合成 5′和 3′ RACE-ready cDNA,用于基因片段的克隆。使用 Primer ScriptTMRT Master Mix试剂盒(TaKaRa)将脊尾白虾9个组织和不同时期的卵巢RNA分别反转录为cDNA,用于不同组织及卵巢不同时期基因表达情况的检测。
1.3 引物合成
实验所用引物由生工生物工程(上海)有限公司合成,序列见表1。
1.4 脊尾白虾UCHL5基因的克隆
1.4.1 脊尾白虾UCHL5基因cDNA核心片段的克隆
根据脊尾白虾转录组序列,设计UCHL5基因核心序列引物(表1),PCR扩增得到UCHL5基因核心片段,回收纯化产物经克隆转化送至生工生物工程(上海)有限公司测序。
1.4.2 脊尾白虾 UCHL5 基因 cDNA 5′和 3′的快速扩增 根据获得的核心片段设计特异性引物UCHL5-GSP-194、UCHL5-GSP-593用于5′端的快速扩增,UCHL5-GSP-569、UCHL5-GSP-809用于 3′端的快速扩增(表 1)。按 SMARTer RACE 5′/3′试剂盒(TaKaRa)进行PCR反应,产物经过纯化和克隆测序后,使用DNAMAN 8对测序结果进行拼接,得到完整的cDNA序列。

表1 引物序列Tab.1 Primers sequence
1.5 脊尾白虾UCHL5基因的生物信息学分析
使用 NCBI (https://www.ncbi.nlm.nih.gov/)对 UCHL5基因的cDNA序列及氨基酸序列进行比对;利用ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析 UCHL5基因的开放阅读框及其编码的氨基酸序列;利用DNA star进行理论等电点和分子量的计算;利用GeneDoc进行氨基酸序列的多重比对;利用MEGA 6.0进行系统进化树的构建。
1.6 脊尾白虾UCHL5基因表达特征分析
根据获得的UCHL5基因cDNA序列设计荧光定量引物,以脊尾白虾18S rRNA为内参基因(表1)进行组织表达特征分析(孙金秋等, 2020)。根据SYBR Premix ExTaq试剂盒(TaKaRa)说明书,设置反应体系和程序,使用Step One Plus仪进行qRT-PCR扩增,2-ΔΔCt法分析定量结果(易健明等, 2015)。
1.7 原核表达载体的构建
根据UCHL5的cDNA序列设计原核表达引物UCHL5-F3和 UCHL5-R3 (表 1),在引物的 5′端分别添加EcoRⅠ和XhoⅠ的酶切位点。PCR扩增产物进行胶回收后连接到pEASY-T3载体上进行克隆转化,挑选阳性克隆送至公司测序。挑取测序正确的菌液抽取质粒,然后用EcoRⅠ和XhoⅠ酶切导入目的片段的pEASY-T3质粒和pET32a质粒,胶回收目的片段和载体,T4连接酶4℃过夜连接。转化到感受态细胞,提取重组质粒进行双酶切和PCR鉴定,同时送至公司测序。
1.8 重组蛋白的诱导表达
将构建成功的重组质粒转化到BL21感受态细胞中,挑选单克隆获得重组菌液,将重组菌液接种于含氨苄青霉素的LB液体培养基中,37℃振荡培养3 h左右,菌液光密度(OD600 nm)达到0.4~0.6时,加入IPTG至最终浓度为1 mmol/L,30℃继续培养诱导表达。以pET32a空载体为阴性对照,分别于表达2、4、6和8 h时取2 mL菌液保存,离心沉淀,裂解后,进行SDS-PAGE电泳分析,通过Western blot检测His标签,验证重组蛋白的正确性。
1.9 数据分析
实验最终各定量结果采用SPSS 18.0和Excel软件进行统计分析,并进行单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 UCHL5基因cDNA全长序列分析
如图1所示,UCHL5基因全长cDNA序列为1440 bp,其中,5′UTR 为 164 bp,3′UTR 为 286 bp,开放阅读框为990 bp,编码329个氨基酸,预测蛋白质分子量为37.57 kDa,理论等电点为5.51,N8-Y213为泛素羧基末端水解酶家族1的保守序列。

图1 脊尾白虾UCHL5基因cDNA序列及氨基酸序列Fig.1 cDNA sequence and amino acid sequence of UCHL5
2.2 系统发育分析
利用GeneDoc软件进行多重序列比对,结果如图2所示,脊尾白虾UCHL5氨基酸序列与其他物种的此氨基酸序列具有较高的同源性,其中与凡纳滨对虾(Litopenaeus vannamei)的同源性最高,为83%。使用MEGA 6.0,采用邻位相接法,将脊尾白虾UCHL5与其他物种的氨基酸序列构建系统进化树,结果如图3所示,进化树分为两大分支,脊尾白虾UCHL5先与凡纳滨对虾聚为一小支,再与拟穴青蟹和三疣梭子蟹(Portunus trituberculatus)等无脊椎动物聚为一分支;小家鼠(Mus musculus)、褐家鼠(Rattus norvegicus)、牛(Bos taurus)、原鸡(Gallus gallus)、斑点叉尾(Ictalurus punctatus)、斑马鱼(Daniorerio)、非洲爪蟾 (Xenopus laevis)等脊椎动物聚为一支。
图2 脊尾白虾UCHL5氨基酸序列的多重比对结果Fig.2 Alignment of the amino acid sequences of different UCHL5 proteins

图3 基于UCHL5氨基酸序列的系统进化树Fig.3 NJ phylogenetic tree based on amino acid sequences of the UCHL5
2.3 UCHL5基因在脊尾白虾不同组织的表达
以18S rRNA作为内参基因,实时荧光定量PCR检测UCHL5基因在脊尾白虾不同组织中的表达水平,结果如图4所示,UCHL5在脊尾白虾9个组织中都有表达,在鳃中表达最高,卵巢次之,显著高于其他组织(P<0.05)。
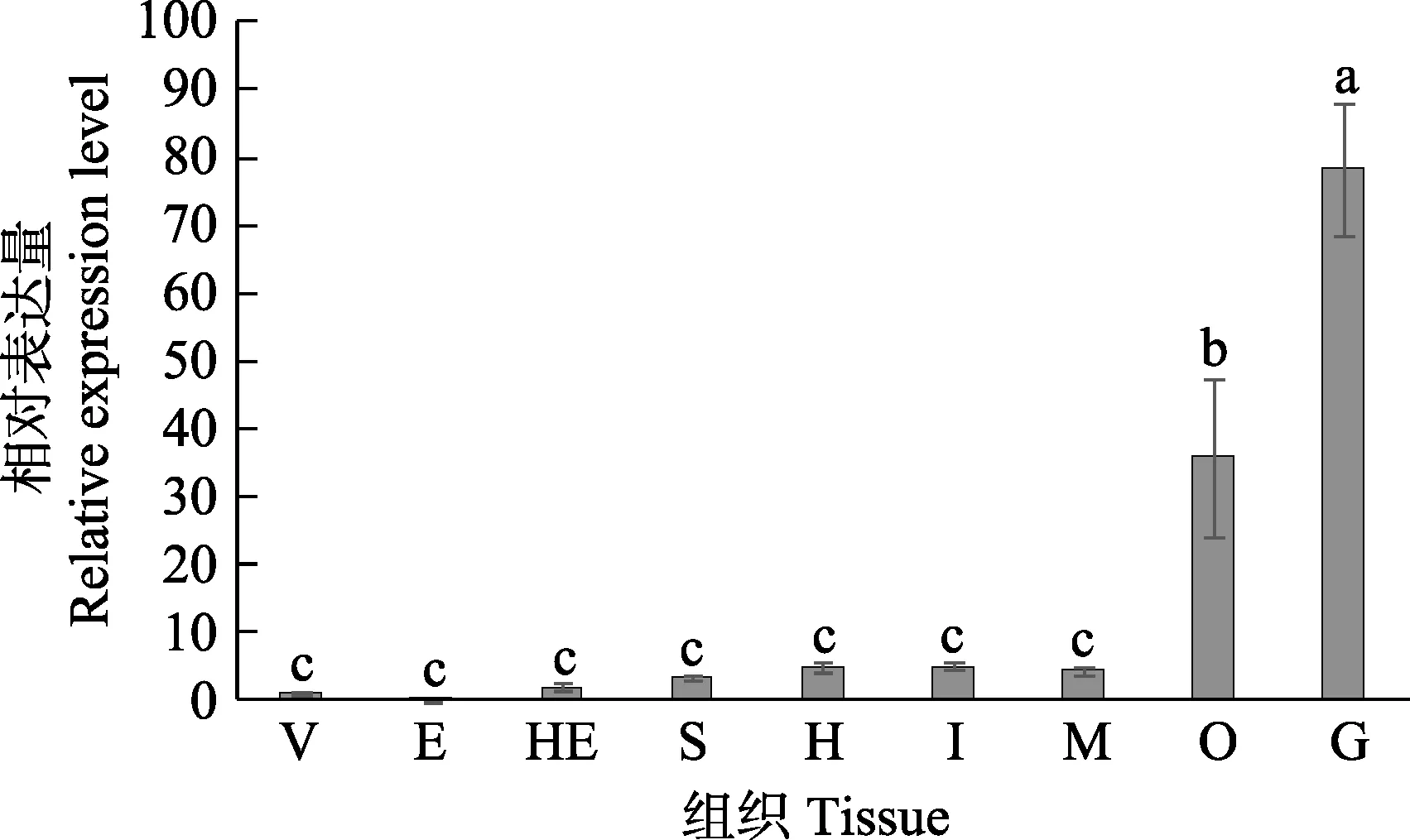
图4 UCHL5基因在不同组织中的表达特征Fig.4 UCHL5 gene expression in different tissues
2.4 UCHL5基因在卵巢不同发育时期的表达
如图5所示,在脊尾白虾卵巢的不同发育阶段,UCHL5基因的相对表达量呈先上升后下降的趋势,Ⅳ期达到最高值,Ⅴ期下降到最低水平,具有显著性差异(P<0.05)。

图5 UCHL5基因在卵巢不同发育时期的表达Fig.5 Expression pattern of UCHL5 in different ovary developing stages
2.5 UCHL5基因的原核表达载体构建及原核表达分析
成功构建了脊尾白虾UCHL5原核表达重组质粒(pET32a-UCHL5),通过菌液PCR、测序等方法验证了重组质粒的正确性。同时进行UCHL5基因的原核表达,在1 mmol/L IPTG、30℃条件下,得到了一条位于52 kDa的蛋白条带,符合预期的蛋白大小(图6)。利用Western blot进行验证,重组蛋白可以检测出His标签,并且和预期大小相一致(图7)。

图6 UCHL5在大肠杆菌中的表达Fig.6 Expression of UCHL5 in Escherichia coli

图7 重组蛋白 Western blot检测Fig.7 Western blot detection of recombinant protein
3 讨论
研究报道,UCH家族在卵母细胞的成熟中起着重要的作用,UCHL1和UCHL3的mRNA在小鼠和恒河猴(Macacamulatta)的GⅤ和 MⅡ期的卵母细胞中高度表达(Mtango et al, 2012),在猪卵母细胞的GⅤ和MⅡ期也检测到UCHL1的高表达(Ellederova et al,2004),UCHL3和UCHL5在拟穴青蟹卵巢中的表达量也显著高于其他组织(Han et al, 2018)。本研究获得了脊尾白虾UCHL5的全长cDNA序列,与凡纳滨对虾、三疣梭子蟹和拟穴青蟹的UCHL5具有较高的同源性。荧光定量结果显示,UCHL5在脊尾白虾鳃和卵巢中表达水平较高,且显著高于其他组织。鳃是脊尾白虾的主要免疫器官之一,UCHL5可能通过对免疫相关蛋白的去泛素化以防止免疫相关蛋白被降解,从而在免疫反应中发挥作用。M a z u m d a r等(2 0 1 0)研究指出,Rpn13/UCHL5的复合体参与调节与免疫相关的一氧化氮合酶和NF-κB的降解,在免疫调节中发挥作用。细胞分裂需要一系列细胞周期蛋白的调控,细胞周期蛋白大多都依靠UPP途径降解,如细胞周期蛋白、细胞周期依赖激酶抑制蛋白等(周蕊等,2003)。脊尾白虾卵巢的细胞分裂水平比其他组织要高,所以UCHL5在卵巢中有较高的表达,这与韩坤煌(2010)的研究结果相一致。克氏原螯虾泛素结合酶E2基因表达量从卵巢发育初期到成熟期逐渐上升,产卵后表达量下降(石宝通等, 2018);斑节对虾泛素结合酶UBE2H基因表达量在卵巢不同发育时期呈先上升后下降的趋势,在卵巢Ⅱ期表达量最高(唐蕾等,2016);拟穴青蟹泛素Ub基因在卵巢发育Ⅴ期表达量最高,Ⅱ期表达量最低(戴燕彬等, 2012)。以上研究表明,泛素及其相关基因对卵巢的发育起着重要的调控作用。本研究中,在脊尾白虾卵巢不同发育时期,UCHL5表达量呈先上升后下降的趋势,在Ⅴ期急剧下降到最低水平。梁俊平(2013)研究发现,脊尾白虾卵黄蛋白原(vitellogenin)基因在卵巢发育不同时期也呈先上升后下降的趋势,说明UCHL5对脊尾白虾卵黄蛋白原的合成起着重要的作用。
为进一步研究脊尾白虾UCHL5的生物学活性和蛋白表达情况,本研究构建了pET32a-UCHL5的重组表达质粒,诱导表达出大小约为52 kDa的融合蛋白。通过Western blot检测His标签,得到了符合预测大小的蛋白条带,由此可推断,诱导出的蛋白为目的蛋白,为接下来的抗体制备、免疫印迹、卵巢组织免疫组化提供实验材料,以便进一步研究UCHL5蛋白在脊尾白虾卵巢发育过程中的功能与作用。

