多普勒超声技术在肉芽肿性乳腺炎和乳腺浸润性导管癌诊断及鉴别中的应用
陆超 姚春 涂美琳 姚洁 谷美玉
肉芽肿性乳腺炎又称为肉芽肿性小叶性乳腺炎(granulomatous lobular mstitis,GLM)是临床相对少见的乳腺炎症性疾病,其影像学与乳腺浸润性导管癌(invasive ductal carcinoma,IDC)极为相似,易被误诊为IDC[1,2]。彩色多普勒血流显像(color Doppler flow imaging,CDFI)则是重要的影像学辅助检查方式,其无创、价格低廉、应用广泛,也是现阶段乳腺疾病筛选的主要影像学方式[3]。病灶血流信号作为判断肿瘤疾病良恶性的重要参考指标[4],但现阶段尚无乳腺肿块周边血流与内部血流信号间的关系报道。本次研究拟通过回顾性分析方式,基于CDFI 检查分析GLM、IDC 肿块周边血流与内部血流间的差异,以期为GLM、IDC 的临床诊断提供新思路。现报道如下。
1 资料与方法
1.1 一般资料 选择2017 年1 月至2019 年1 月杭州市中医院收治的GLM、IDC 患者。纳入标准包括:①经组织病理学诊断为GLM 或IDC;②临床资料完整,能满足本次研究需要;③CDFI 检查前未接受任何治疗。并剔除:①GLM、IDC 以外的良恶性乳腺疾病患者;②合并其他良恶性肿瘤疾病患者;③既往有乳腺手术病史患者。最终纳入33 例,其中GLM 12 例,年龄29~41 岁,平均年龄(33.83±4.53)岁;IDC 21 例,年龄36~82 岁,平均年龄(58.24±12.24)岁。
1.2 方法 选择Mylab Classc 彩色多普勒超声诊断仪(由意大利百胜公司生产),配备L523探头。所有患者扫查体位均为仰卧位,充分暴露双乳,多切面扫查乳腺并对可疑肿块的二维结果进行观察,而后CDFI 扫查获得对应肿块的血流信号分布情况,测定收缩期峰值流速(peak systolic velocity,PSV)、舒张末期流速(end-diastolic velocity,EDV),以及阻力指数(resistance index,RI),重复测量3 次,取均值。超声检查由2 位高年资超声影像学医师采用双盲法检测,一致性良好。
1.3 统计学方法 采用SPSS 16.0 统计学软件进行数据分析。计量资料以均数±标准差()表示。组间计量资料比较采用t检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析,以曲线下面积反映诊断鉴别效能。设P<0.05 为差异有统计学意义。
2 结果
2.1 GLM 的内部血流与边缘血流显象结果比较见表1

表1 GLM的内部血流与边缘血流显象结果比较
由表1可见,GLM 内部血流PSV、EDV 明显低于边缘血流,差异均有统计学意义(t分别=3.86、2.97,P均<0.05),GLM 肿块内部RI 与边缘RI 比较,差异无统计学意义(t=1.44,P>0.05)。
2.2 IDC 的内部血流与边缘血流显象结果比较见表2
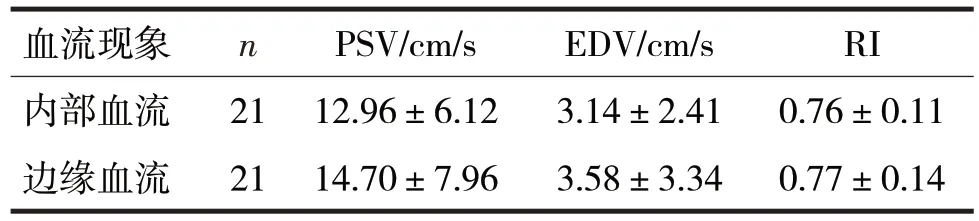
表2 IDC的内部血流与边缘血流显象结果比较
由表2 可见,IDC 肿块内部血流PSV、EDV、RI与边缘血流PSV、EDV、RI 比较,差异均无统计学意义(t分别=0.65、0.33、0.21,P均>0.05)。
2.3 GLM、IDC 的内部血流与边缘血流差值比较见表3
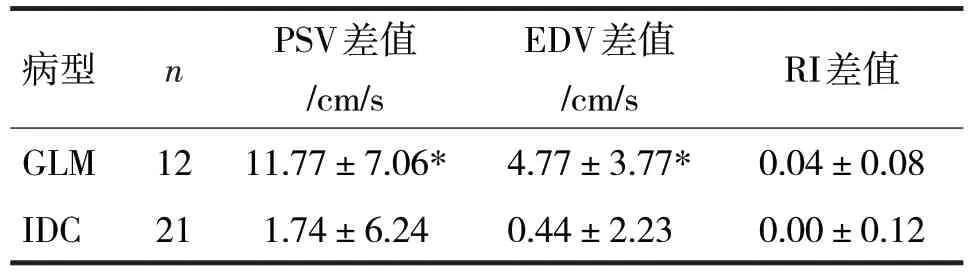
表3 GLM、IDC的内部血流与边缘血流差值比较
由表3可见,GLM 肿块内部血流PSV、EDV 与边缘血流PSV、EDV 差值高于IDC,差异均有统计学意义(t分别=4.23、4.16,P均<0.05),GLM 肿块内部血流RI 与边缘血流RI 差值比较,差异无统计学意义(t=1.03,P>0.05)。
2.4 GLM、IDC 内部血流与边缘血流差值对GLM、IDC的诊断价值分析见图1
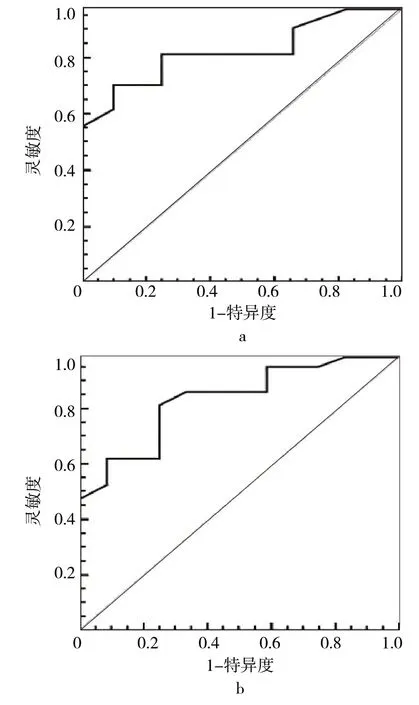
图1 GLM、IDC内部血流与边缘血流差值对GLM、IDC的诊断价值ROC曲线
由图1 可见,PSV 鉴别GLM、IDC 的曲线下面积为0.83(P<0.05),临界值≤2.9 cm/s,灵敏度、特异度分别为71.43%、91.67%;EDV 鉴别GLM、IDC 的曲线下面积为0.83(P<0.05),临界值≤2 cm/s,灵敏度、特异度分别为80.95%、75.00%;但PSV 与EDV鉴别GLM、IDC 的曲线下面积比较,差异无统计学意义(Z=0.08,P>0.05)。
3 讨论
GLM 以乳腺终末导管小叶单位为中心的肉芽肿炎症反应为病理表现,是乳腺良性病变的一种[5]。当前GLM 的病因机制尚不明确,一般认为其发生于机体自身免疫反应存在密切关联,且多数并未表现出急性感染性症状,血常规检查白细胞计数、中性粒细胞数也无异常表现,多因单侧乳房触及肿块而就诊[6]。IDC 则是乳腺恶性肿瘤疾病的一种,此类患者早期亦无明显特异性症状,就诊原因也与GLM 类似,多因乳房可触及肿块而就诊[7]。GLM 病变在临床表现、超声影像学资料与IDC 比较不具明显特异性差异,有一定相似之处,因此临床极易误诊[8]。超声影像学作为诊治乳腺良恶性疾病的重要影像学辅助检查手段,在乳腺良恶性疾病的临床诊治中发挥着举足轻重的作用,应用极为广泛[9,10]。有研究指出肿瘤在无血管期仅能生长到数毫米,肿瘤的生长、侵袭、转移皆需充足的养分,而血流生长速度越快,肿块内部血流越丰富,这也是CDFI 诊断鉴别乳腺良恶性肿块的基础[11]。
吴朝贵等[12]研究指出,乳腺恶性肿瘤的PSV、EDV 及RI 要明显高于良性肿瘤。但上述血流动力学参数可能存在部分重叠,这也导致临床难以界定PSV、EDV、RI 诊断鉴别乳腺良恶性肿块的临界值,临界值过高可能降低敏感性,增加假阴性风险,而过低又可能降低特异性,导致假阳性增多[13]。另外,受操作者熟练程度、患者月经周期、肿块大小等因素影响,且乳腺癌内血管还容易形成动静脉交通或血管吻合,此时肿块内可探及高速低阻血流,并在一定程度上造成RI 被低估,但也有研究指出,此时若在肿块周边仔细探查可出现高速高阻血流信号[14,15],这也是影响CDFI 血流动力学参数对乳腺良恶性肿块鉴别价值的重要原因。现阶段关于乳腺良恶性肿块CDFI 血流动力学参数的研究多集中于两者间的对比,分析乳腺良恶性肿瘤各自内部血流与边缘血流差异的临床报道罕见,尤其是GLM、IDC。基于此,结合临床实践经验,本次研究采集GLM、IDC 患者的CDFI 血流动力学资料,探究GLM、IDC 肿块内部血流与边缘血流的差异。本次研究结果显示,GLM 肿块内部血流RI 与边缘血流RI 比较差异无统计学意义,但PSV、EDV 明显低于边缘血流;而GLM 肿块内部血流PSV、EDV、RI 与边缘血流PSV、EDV、RI 比较差异无统计学意义,分析原因可能GLM 为炎症充血血流信号,而IDC 则为滋养血供有关。为进一步完善其临床应用,本次研究也对GLM、IDC 肿块内部血流动力学参数与边缘血流动力学参数差值进行了分析,结果同样显示GLM 肿块内部血流PSV、EDV 与边缘血流PSV、EDV 差值明显高于IDC(P均<0.05)。经ROC 曲线分析则显示肿块内部血流PSV、EDV 与边缘血流PSV、EDV 差值均可对GLM、IDC 的鉴别发挥一定效能,曲线下面积分别达0.83、0.83,分别以2.9 cm/s、2 cm/s 为临界值,灵敏度为71.43%、80.95%,特异度分别为91.67%、75.00%。但本次研究也有不足之处,如总样本数量较少,可能存在一定统计学误差,结论尚需更大样本量后进一步深入探究。
综上所述,GLM 患者CDFI 影像所示肿块内部血流PSV、EDV 与边缘血流存在明显差异,而IDC 肿块内部血流PSV、EDV与边缘血流则未见明显差异,GLM 内部血流与边缘血流的PSV、EDV 差值或可作为临床诊断鉴别GLM、IDC的重要依据。

