大蒜油自微乳的抑菌作用
肖小年,盛丹梅,周 洁,易孜成,朱碧泉,张 俊,易 醒*
(1 南昌大学中德联合研究院 南昌 330047 2 南昌大学中德食品工程中心 南昌 330047)
大蒜油(Garlic oil,GO)是从大蒜鳞茎中提取出的一种挥发油,微溶于水,易溶于有机溶剂和大多数非挥发性油,且容易被氧,光,热,水分和其它腐蚀性物质降解[1]。GO 化学成分复杂,主要活性成分为有机硫化物、氨基酸类、酶类、苷类、糖类和微量元素等[2],其活性功能有抗菌消炎[3-4]、抗氧化[5-6]、降血脂、降血压[7-8]、抑制癌症和肿瘤[9-12]及提高免疫力[13]等。
自微乳是由油相、表面活性剂、助表面活性剂组成的一种混合体系,在温和搅拌下遇水可自乳化成粒径小于100 nm 的水包油型乳剂。将GO 制备成自微乳,可改善大蒜油的溶解性能,延缓活性物质水解,提高稳定性和生物利用度。
目前关于大蒜挥发油[14]、大蒜素[15]和大蒜有机硫化物[16]等抑菌研究的报道较多,而对大蒜油自微乳 (Garlic oil self-microemulsion,GO-SMEDDS)抑菌机理的研究鲜有报道,对GO 自微乳化后的抑菌作用了解不多。本研究以GO-SMEDDS 为对象,研究GO-SMEDDS 对6 种食品常见腐败菌的抑制效果,同时以金黄色葡萄球菌和大肠杆菌为研究对象,通过分析和测定抑菌圈、微观结构、菌液电导率、碱性磷酸酶 (alkaline phosphatase,AKP)含量变化、谷丙转氨酶(alanine aminotransferase,ALT) 和谷草转氨酶 (aspartic transaminase,AST)的酶活变化等,探讨GO-SMEDDS 对试验菌株的作用机制,为GO 的进一步开发应用提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料 大肠杆菌(ATCC29922)、金黄色葡萄球菌 (ATCC6538);枯草芽孢杆菌(CMCC63501)、铜绿假单胞菌(ATCC27853)、白色念珠菌(CMCC98001)、酿酒酵母(ATCC9763)、脑心浸液培养基、营养肉汤、营养琼脂、马铃薯葡萄糖液体培养基、马铃薯葡萄糖琼脂培养基,广东环凯生物科技有限公司;0.1 mol/L 磷酸盐缓冲液(pH 7.4)、2.5%戊二醛固定液、溶菌酶,福州飞净生物有限公司;六甲基二硅氨烷、乙酸异戊酯,西陇试剂;碱性磷酸酶(AKP)测试盒、谷丙转氨酶(ALT)试剂盒、谷草转氨酶(AST)试剂盒,南京建成生物工程研究所。
1.1.2 主要设备与仪器 SW-CJ-1F 洁净工作台,苏州安泰空气技术有限公司;GR85DA 高压蒸汽灭菌锅,SANYO 公司;LRH-100SDP 药物稳定性试验箱,上海印溪仪器仪表有限公司;TGL-12C高速离心机,上海菲恰尔分析仪器有限公司;SHZ-82A 恒温培养摇床,上海一恒科学仪器有限公司;DNM-9602 全波长酶标仪,Thermo Scientific公司;DDS-307 电导率仪,上海精密科学仪器有限公司;JSM-6701F 冷场发射扫描电子显微镜,日本电子株式会社。
1.2 试验方法
1.2.1 GO-SMEDDS 制备 采用本试验室先前方法[17]制备GO-SMEDDS。
1.2.2 菌种的活化和菌悬液的制备 根据说明书将冻干菌种活化,放入恒温培养摇床(细菌培养温度为37 ℃,真菌培养温度为27 ℃;以下培养条件相同)120 r/min 培养至对数生长期 (细菌培养10 h,真菌培养16 h)。将培养好的菌悬液稀释10-1,10-2,10-3,10-4,10-5,10-6后,将稀释好的菌悬液分别取100 μL 涂布在相应的平板上,培养24 h 后计算菌落平均数,并计算每毫升中菌落形成单位(Colony-forming unit,CFU):CFU=菌落平均数×稀释倍数×10。菌落数调至106~107CFU/mL 制成菌悬液,置4 ℃条件储存,备用。
1.2.3 抑菌圈的测定 用打孔器制作直径6 mm滤纸片,并将其灭菌备用。用二倍稀释法将GO 和GO-SMEDDS 稀释成质量浓度为15,7.5,3.75 mg/mL 的溶液,将已灭菌的滤纸片分别放入上述3 种质量浓度的溶液中浸泡8~10 h。取100 μL 106CFU/mL 的菌悬液于琼脂培养基均匀涂布,取3 片不同质量浓度的滤纸片贴于培养基中,倒放培养。培养24~48 h 后,分别取出培养皿,打开培养皿的盖子,用镊子取出滤纸片,再盖上玻璃盖观察抑菌圈出现情况及直径大小,并用游标卡尺测量直径并记录。试验重复3 次,计算平均值。
1.2.4 最低抑菌浓度和最低杀菌浓度的测定 采用两倍稀释法测定GD-SMEDDS 对菌株的最低抑菌浓度(Minimum inhibitory concentration,MIC)。将9 支无菌试管进行编号并加入5 mL 液体培养基,1 号试管中加入5 mL 稀释后的GO-SMEDDS或GO,采用二倍稀释法稀释1~7 号试管的样品浓度,使无菌试管中GO-SMEDDS 的最终质量浓度为25,12.5,6.25,3.125,1.563,0.781,0.391 mg/mL,GO 的最终质量浓度为3.75,1.875,0.938,0.469,0.234,0.117,0.059 mg/mL,再分别加入5 mL 菌悬液;8 号试管以5 mL 菌悬液和5 mL 液体培养基作为生长对照组,9 号试管以5 mL 菌悬液和5 mL 蒸馏水作为空白对照组。混匀后恒温摇床培养观察各试管中菌种的生长情况,无菌生长的试管中的样品质量浓度为样品对该菌种的最低抑菌浓度。试验重复3 次。
取无菌生长试管中的液体100 μL 涂平板,倒置培养后,观察无肉眼可见的菌落生长的最高稀释度 (最低质量浓度) 为最低杀菌质量浓度(Minimum bactericidal concentration,MBC)。
1.2.5 细胞形态的SEM 检测 将大肠杆菌和金黄色葡萄球菌加入液体培养基中,恒温摇床培养24 h 后各取10 mL,加入GO-SMEDDS,使菌悬液中液体GO-SMEDDS 的终浓度为1 MIC,继续培养24 h,分别于4,12,24 h 取菌悬液离心(3 000 r/min,10 min),弃去上清液。沉淀用0.1 mol/L 磷酸盐缓冲液漂洗3 次,2.5%戊二醛溶液4 ℃固定4 h,弃去戊二醛后经一系列乙醇(体积分数为50%,70%,90%,100%) 逐级脱水,各浓度各浸泡8 min,100%酒精浸泡15 min,每一步后都离心(3 000 r/min,5 min)。乙酸异戊酯浸泡过夜后涂到金属箔片上,滴入六甲基二硅氨烷,样品干燥后镀金,上SEM 观察。
1.2.6 细胞壁通透性的测定 将大肠杆菌和金黄色葡萄球菌加入液体培养基中,恒温摇床培养24 h 后配置成106CFU/mL 的菌悬液(各3 组),加入GO-SMEDDS,使菌悬液中GO-SMEDDS 质量浓度分别为0 mg/mL,1 MIC,2 MIC,继续培养8 h,分别于0,1,2,4,6,8 h 取菌悬液离心 (3 500 r/min,10 min),按照AKP 试盒法处理上清液并计算酶活。
1.2.7 菌液电导率的测定 将大肠杆菌和金黄色葡萄球菌加入液体培养基中,恒温摇床培养24 h后配置成106CFU/mL 的菌悬液 (各3 组),加入GO-SMEDDS,使菌悬液中GO-SMEDDS 质量浓度分别为0 mg/mL,0.5 MIC,1 MIC,继续培养8 h,于0,1,2,4,6,8 h 取菌悬液离心(3 500 r/min,10 min),用电导率仪测定上清液的电导率。
1.2.8 ALT 和AST 的测定 将大肠杆菌和金黄色葡萄球菌加入液体培养基中,恒温摇床培养24 h 后配置成106CFU/mL 的菌悬液(各3 组),加入GO-SMEDDS,使菌悬液中GO-SMEDDS 质量浓度为1 MIC,继续培养48 h,于6,12,18,24,48 h取菌悬液离心 (3 500 r/min,10 min),分别按照ALT 和AST 试剂盒法处理上清液并计算酶活。
1.3 数据处理
每组试验3 次平行处理,用Excel 软件进行平均值分析,用Origin8.5 软件绘制曲线。
2 结果与分析
2.1 抑菌圈
由表1可知,GO 和GO-SMEDDS 对6 种常见菌均有抑制作用,且抑菌效果随着其质量浓度增加而增强。整体上,两种样品的抑菌效果大小为:真菌(白色念珠菌和酿酒酵母)>革兰氏阳性菌(金黄色葡萄球菌和枯草芽孢杆菌)>革兰氏阴性菌(铜绿假单胞菌和大肠杆菌)。GO 及其自微乳体系对真菌的抑制作用强于细菌,可能是由于GO 的亲脂性可以穿透细胞膜和细胞器膜导致线粒体等细胞器损伤,最终导致真菌死亡[18],或者GO 中活性成分破坏了细胞生长的能量来源及磷脂双分子结构,从而破坏了细胞的完整性,最终显示抑菌效果[19]。
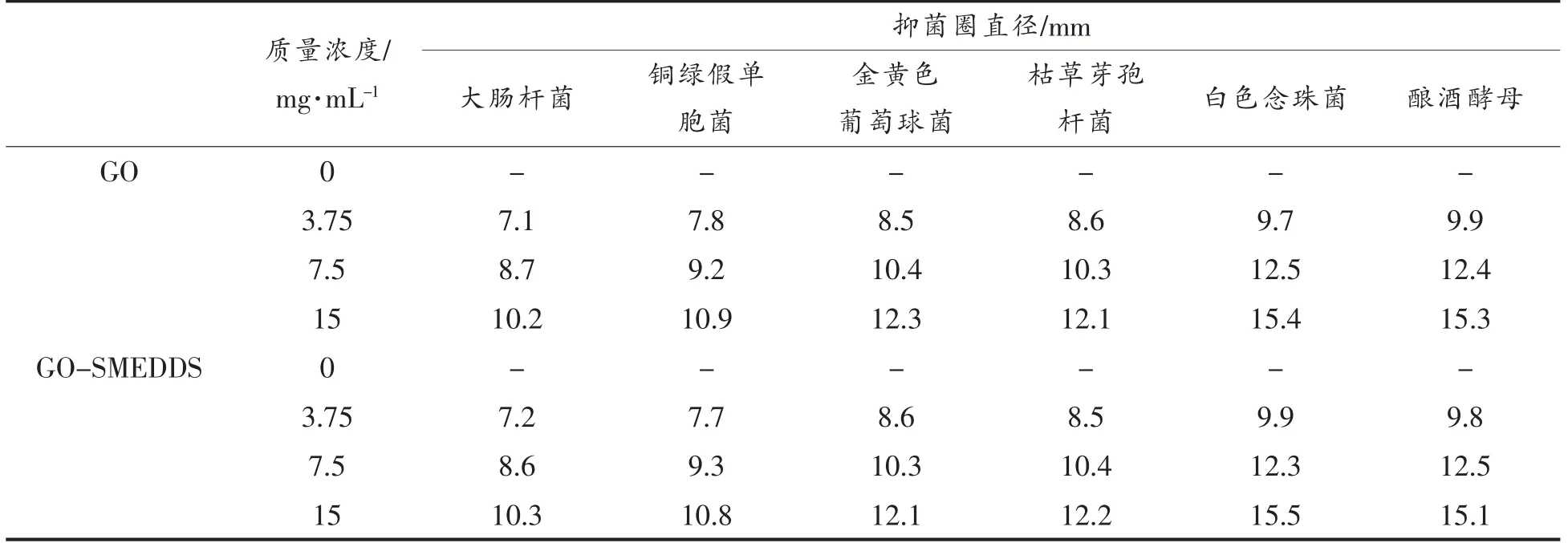
表1 不同浓度GO 和GO-SMEDDS 的抑菌圈Table 1 Bacteriostatic cycles of GO and GO-SMEDDS at different concentrations
两种样品对革兰氏阳性菌的抑制作用都强于革兰氏阴性菌,这可能与两者细胞壁结构不同有关。革兰氏阳性菌的细胞壁是由一层厚而致密的肽聚糖和包括磷酸壁的酸性多糖组成,而革兰氏阴性菌的细胞壁是由肽聚糖,脂蛋白,磷脂和脂多糖构成,形成交联度低,结构松散的多层结构。细胞壁的结构不同,会导致两种细菌对样品液的敏感性不同[20]。
2.2 GO-SMEDDS 的最小抑菌浓度和最低杀菌浓度
采用比浊法测定了GO 和GO-SMEDDS 对6种菌种的MIC 和MBC,结果见表2。GO 对大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌和酿酒酵母的MIC 分别为0.938,0.469,0.234,0.234,0.117,0.117 mg/mL,GO-SMEDDS 对上述6 种菌株的MIC 分别为1.875,0.938,0.469,0.469,0.234,0.234 mg/mL,两种样品液均对真菌有较强的抑制效果,对大肠杆菌抑制效果最差,这与抑菌圈试验结果相一致,进一步说明细胞壁的差异会影响抑菌效果。由表2可知GOSMEDDS 的MIC 和MBC 均高于GO 的MIC 和MBC,表明GO-SMEDDS 的抑菌效果低于GO,可能是由于微乳液包埋体系对GO 的抗菌效果产生了负面影响[21],因为表面活性剂会对系统的抗菌性产生影响,且表面活性剂质量浓度越高,抗菌性越弱[22]。

表2 大蒜油及其自微乳体系对细菌和真菌的MIC 和MBCTable 2 MIC and MBC of garlic oil and its microemulsion system to bacteria and fungi
2.3 GO-SMEDDS 的抑菌机理
2.3.1 SEM 分析 经GO-SMEDDS 处理后大肠杆菌和金黄色葡萄球菌的形态见图1和图2。
由图1可知,对照组大肠杆菌呈杆状,表面平滑,两端圆润,无芽孢。经MIC 浓度的GOSMEDDS 处理4,12,24 h 后,大肠杆菌表面开始皱缩,产生褶皱,扭曲变形,处理24 h 的菌体已发生明显萎缩并融为一体;由图2可知,对照组金黄色葡萄球菌表面光滑,菌体饱满,经GO-SMEDDS 处理后,菌体表面产生凹陷和不规则的凸起。且两株菌种随着GO-SMEDDS 处理时间的延长,菌体变形现象逐步加重。

图1 透射电子显微镜下大肠杆菌的形态结构(×10 000)Fig.1 Morphological structure of E.coli under transmission electron microscope(×10 000)

图2 透射电子显微镜下金黄色葡萄球菌的形态结构(×20 000)Fig.2 Morphological structure of Staphylococcus aureus under transmission electron microscope(×20 000)
试验结果说明:GO 能使细胞生物膜受到破坏,使细胞发生严重的质壁分离,最终导致细胞死亡,这与王一非等[23]研究结果相似;且自微乳体系能减缓大蒜油的释放,因此GO-SMEDDS 能在较长时间里保持抑菌效果。
2.3.2 GO-SMEDDS 对细菌细胞壁通透性影响碱性磷酸酶(AKP)是位于细胞壁和细胞膜之间的一种重要的酶,正常情况下很难在菌体细胞外检测到AKP 酶存在,当细胞壁被破坏后,AKP 酶会泄露到细胞外,使得胞外能检测到AKP 酶[24]。由图3可知,在GO-SMEDDS 作用后的菌液里可以检测到AKP 酶,且随着作用时间的延长酶活不断升高;在2 h 后空白对照组的AKP 酶活趋于稳定,而处理组样品AKP 酶活显著高于空白对照组,反映了GO-SMEDDS 可使菌体的细胞壁完整性遭到破坏,可导致AKP 泄露。这与陈梦玲等[25]研究发现细菌细胞壁被破坏后,菌液AKP 活力显著提升相一致。
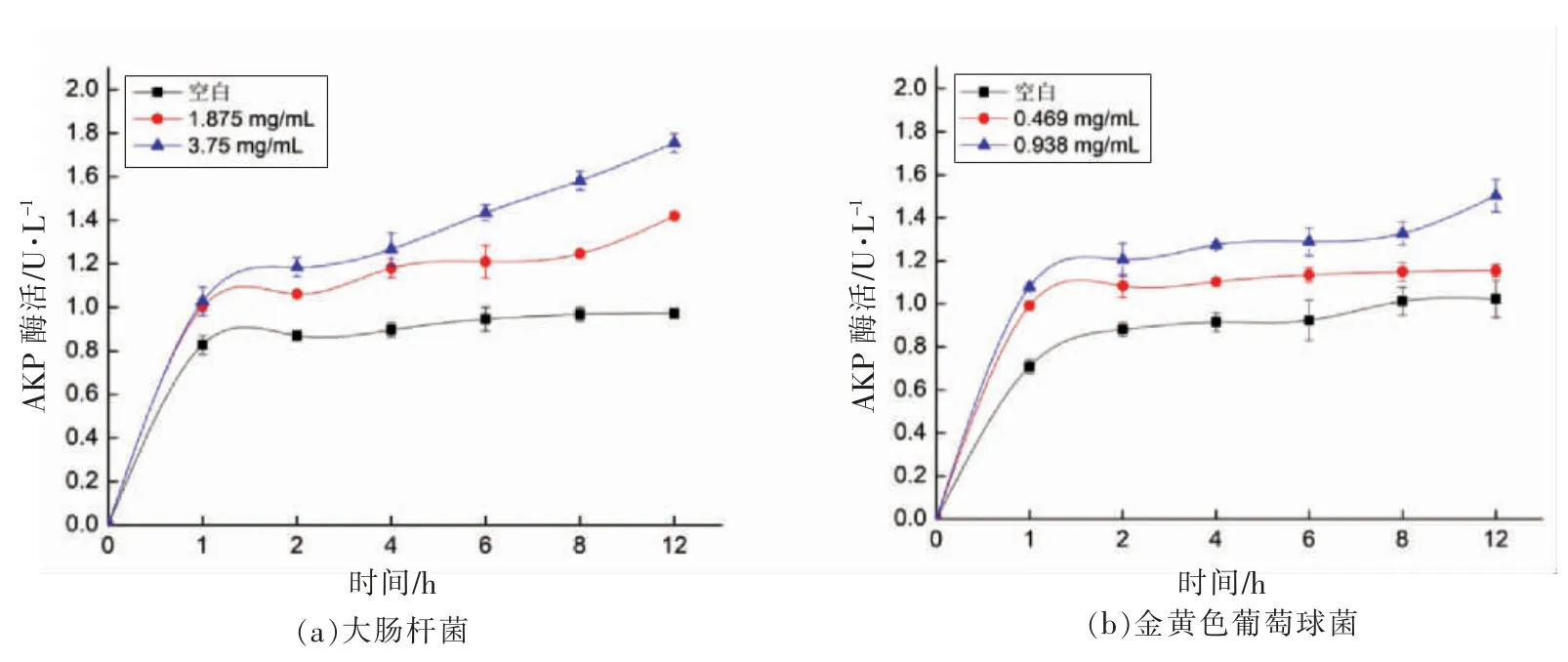
图3 AKP 酶活Fig.3 The activity of AKP
2.3.3 GO-SMEDDS 对菌液电导率的影响 细胞膜在菌体正常生长过程中起重要作用,当菌体细胞膜被破坏时,菌体内部K+,Na+等金属离子和细胞电解质会渗出到培养液中,使电导率变大,故可通过电导率的改变反映出菌体细胞膜通透性的变化[26-27]。由表3可知,经GO-SMEDDS 处理的菌液的电导率均高于空白对照组,且处理时间越长,菌液电导率越高,大蒜油的质量浓度与电导率呈正相关,表明GO-SMEDDS 能破坏细菌的细胞膜,大蒜油对细菌的作用呈剂量依赖性,这与李桥妹等[28]的研究结果相似。

表3 GO-SMEDDS 对两种菌液电导率(μs/cm)影响Table 3 Influence of GO-SMEDDS on the conductivity (μs/cm) of the two strains
2.3.4 GO-SMEDDS 对菌液中ALT 酶和AST 酶的影响 转氨酶是一种胞内酶,在氨基酸合成中起核心作用,能够间接影响蛋白质的合成,转氨酶中常被用来作为细菌细胞被破坏的指标酶为ALT和AST,因此,检测上清液中ALT 和AST 的活力即可判断细胞膜被破坏的程度[29]。
试验中分别检测对照组和GO-SMEDDS 组的ALT 和AST 活力,并用图4的ALT 和AST 标准曲线计算出转氨酶的活力,结果见图5、图6。试验表明,经GO-SMEDDS 作用后的菌液中的ALT 和AST 活力均有升高,并在24 h 时达到最大值,但随着时间的延长,菌液中两者活力均呈现下降趋势,可能是菌液中细菌达到衰亡期,菌体代谢减弱,代谢酶含量也随之减少[30]。大肠杆菌菌液中酶活高于金黄色葡萄球菌,说明GO-SMEDDS 能够破坏细菌的细胞膜,扰乱细菌胞内酶的体系,抑制细菌生长,其中对大肠杆菌的影响效果更为明显。

图5 ALT 酶活Fig.5 The activity of ALT
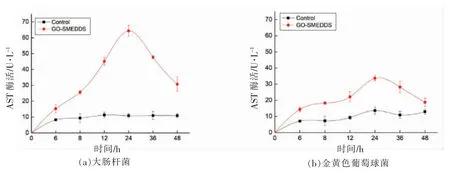
图6 AST 酶活Fig.6 The activity of AST
3 结论
本文考察了GO-SMEDDS 对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌和酿酒酵母的体外抑菌活性和抑菌机制。由抑菌圈直径可知,GO-SMEDDS 对白色念珠菌的抑制作用最强,抑菌圈直径可达15.5 mm;对大肠杆菌的抑制作用最弱,抑菌圈直径为10.3 mm;且抑菌作用随着大蒜油质量浓度的增加而增加。根据最低抑菌质量浓度和最低杀菌质量浓度结果可知,GO-SMEDDS 对真菌的抑制作用最强,其次是革兰氏阳性菌,最后是革兰氏阴性菌。GOSMEDDS 的抑菌机制是通过影响和破坏菌体细胞壁结构,引起细胞形态变形,AKP 酶泄露,以及通过再减弱细胞膜选择透过性,引起菌体内ALT,AST 等胞内物质外泄和电导率升高,影响细胞多肽和蛋白质代谢等的正常降解与合成,从而最终导致菌体死亡,发挥抑菌效果。
研究中考察了GO-SMEDDS 对6 种常见菌种的体外抑菌活性,初探了对大肠杆菌和金黄色葡萄球菌的抑菌机理,后续可关注GO-SMEDDS 对菌体蛋白质的合成量,呼吸代谢,遗传物质DNA或RNA 的合成等方面的影响,获得GO-SMEDDS抑菌更全面的认识。本研究可为GO-SMEDDS 在食品行业的广泛应用提供理论参考。

