不同光周期对菊花生长发育及内源激素的影响
陆思宇,杨再强,2,杨 立,张源达,郑 涵
(1.南京信息工程大学,气象灾害预报预警与评估协同创新中心,江苏 南京 210044;2.江苏省农业气象重点实验室,江苏 南京 210044)
随着中国城市化进程的加快,切花需求量以每年20%的速度在快速增加,一年四季均有需求[1]。菊花作为世界四大切花品种之一,多年来在花卉市场上占有很大比重,但受长日照的限制,部分秋菊品种在春夏季节无法正常开花。光周期现象为植物通过感知日照长度的变化而控制植物开花的现象[2]。秋菊属于短日植物,当日照长度小于其临界日长时方才开花[3]。不同菊花品种的临界日长不同,光周期诱导效应也不同。光周期诱导是指利用光周期对植物花期的调节作用,人为控制日长,进而控制植物的开花时间,实现反季开花[4]。目前,国内外已有关于光周期对菊花花期调控方面的研究,短日光照环境是秋菊开花的关键,通常认为暗期对菊花花芽分化的启动起决定性作用,而光期通过光合作用影响植株的营养状况,进而对开花数量产生影响[5]。光周期不仅影响菊花的成花诱导,作为光合作用的必要条件,直接影响着植株的营养生长和生理特性[6]。敖地秀等[7]研究发现,菊花在日长小于11 h的光照条件下开始花芽分化,延长至14 h则花期延迟,营养生长旺盛[8],而过分缩短日长则不利于菊花的生长。李海云等[9]发现,叶绿素含量随日照时长的减少而减小,8 h菊花长势较差,植株瘦弱,花卉质量下降[10]。汪菊渊等[11]发现,菊花从光周期处理到开花所需时间因品种而异,而与花型无关,10 h日长为46~87 d不等,神马菊在9 h日长下花芽分化最快,历时23 d[12]。持续的短日照处理可促使秋菊、寒菊提前开花,短日和长日交替则引发菊花毫无规律的花序分化,并出现花畸形[13],适宜光周期的中断或打乱可显著影响成花诱导过程及其规律性[14]。
光周期对花期的调控作用主要是通过红光(Pr)、远红光((Pfr)2种光敏色素间的相互转化,实现植物体内生理代谢的转变过程[15]。当菊花受到持续性的短日光周期处理后,Pfr/Pr降低至临界值,引发与促花反应相关的激素代谢[16],在激素的共同作用下形成开花刺激物传递至茎尖分生端,诱发一系列生理代谢促使花芽分化[17]。Torrey[18]认为,由光周期引发的这种激素类生长调节物的变化可影响作物根系对营养元素的吸收。植物接受光照时间长,有利于根系的生长,根系活力也较高,同时也有利于作物生长,叶片生长速率、地上部生长量和干物质量均较大[19]。随着日长的缩短,菊花花期提前,但株高、茎粗和平均节间长度等减小,不同处理植株外观形态有很大差异[20]。关于不同短日、长日光周期对菊花生长发育特性及其与内源激素、光合色素间的关系研究较少。姜贝贝等[21]发现,28~35 d是切花菊精云达到成熟的成花感受态的生长年龄,要获得高品质切花,菊花前期的营养生长要达到35 d以上才能进行遮光处理。本研究通过设置系列梯度光周期处理,选取达到成花感受态的菊花苗,研究不同光照时长对菊花光合色素、生长形态,花序发育不同阶段历时及其内源激素、切花品质的影响,了解不同光周期的成花效应,找到菊花最适日长,为切花秋菊的反季栽培提供理论指导。
1 材料和方法
1.1 试验材料
试验于2020年7月17日在南京信息工程大学农业气象试验站日光温室(118°42′E、32°12′N)内进行,供试菊花品种红面为短日照植物,生长势强,喜阳耐干,忌积涝,花瓣面呈红色,属于莲座状中轮花。于试验前2020年6月10日将幼苗定植于口径为25 cm的PVC盆中,栽培基质为微酸性土壤,每盆1株,阴凉处缓苗后移至向阳处长日照下生长,以备试验使用。
1.2 试验设计
试验在罩黑膜的不透光棚(高1.5 m)中进行,采用定时开关棚的方法人工控制植株接受光照的时间。试验共设5个处理,分别为昼长7(以下记为Ph7),8(记为Ph8),9(记为Ph9),10(记为Ph10),11 h(记为Ph11),并利用南京夏季自然光照长度作为CK(13~14 h)。其中Ph7光照时间为11:00-18:00,Ph8光照时间为10:00-18:00,Ph9光照时间为9:00-18:00,Ph10光照时间为8:00-18:00,Ph11光照时间为7:00-18:00,其余时间均处于黑暗不透光环境。于定植后的第37天即2020年7月17日,随机选取暂未开始花芽分化的植株(40±2) cm,放入遮光棚的不同小区,每处理30株。不同处理除光照时长不同外,水肥管理措施均相同,盆土变干时将水浇透而盆内不汪水,不干则不浇;植株统一薄肥勤施,现蕾前主要施氮肥,孕蕾现花阶段主要施磷钾肥,后期生殖生长停止施肥。
7-8月所有处理光源均为自然光,9-11月由于自然光照时长缩短,自然光照外的时段均采用生长补光灯进行人工补光,补光灯光强为1 000 lx。冠层上方1.5 m太阳光合有效辐射由传感器(WatchDog 2000,美国)自动采集,如图1所示。
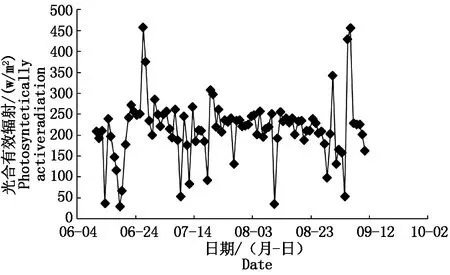
图1 试验期间光合有效辐射日变化Fig.1 Diurnal variation of photosynthetically active radiation during the experiment
1.3 测定指标与方法
1.3.1 生长指标及叶绿素含量的测定 于试验后每30 d测定1次植株的株高、茎粗、叶片数和叶绿素,即30,60,90,120 d 4次测量,每个处理3次重复。
株高:由菊花植株基部至主茎生长点的自然高度;茎粗:距土面20 cm处的茎秆直径;叶片数:叶长大于1 cm的可见叶片数;叶绿素含量:取中部成熟叶片0.2 g,参照李合生等[22]的方法在分光光度计(UV-1800,日本岛津)中完成470,649,665 nm下的比色测定,并按下式分别计算叶绿素a(Chla)、叶绿素b(Chlb)、类胡萝卜素(Car)以及叶绿素总含量(Chl)。
Chla=13.95D665-6.88D649
Chlb=24.96D649-7.32D665
Chl=Chla+Chlb
Car=(1 000D470-2.05Chla-114.8Chlb)/245
其中D470、D649、D665分别表示提取液在470,649,665 nm下的比色值。
1.3.2 发育期参考刘彩迎[23]的花期划定方法 依据以下标准判断并记录下菊花植株达到现蕾(1/2以上植株出现花蕾)、破蕾(1/2以上植株花蕾顶端露白)、初绽(1/2以上植株舌状花瓣形成,回心而抱)、初花(1/2以上植株外轮舌状花瓣外展)、盛花(1/2以上植株舌状花全展开,中部黄色雄蕊可见)以及初萎(1/2以上植株花序外2圈花瓣枯萎)的日期,并计算不同处理下菊花现蕾历时、破蕾历时、初绽历时、初花历时、盛花历时以及初萎历时。其中现蕾历时为从试验开始到植株现蕾的天数,破蕾历时为从现蕾到破蕾的天数,初绽历时为从破蕾到初绽的天数,初花历时为从初绽到初花的天数,盛花历时为从初花到盛花的天数,初萎历时为从盛花到初萎的天数。
1.3.3 内源激素的测定 分别于以上6个发育期,取菊花中部成熟叶片1 g,用80%冷甲醇提取过夜,经多次萃取脱色、调节pH值和减压蒸发后,过0.45 μm微孔滤膜,采用高效液相色谱法(HPLC)测定玉米素(ZT)、赤霉素(GA3)、生长素(IAA)和脱落酸(ABA)含量,具体参考刘英翠[24]的方法。
1.3.4 切花品质和根系活力的测定 于盛花期时测定并记录单株花数、花径(花序最大横径)、花瓣花青素含量以及根系活力。取1 g菊花花瓣,通过水浴振荡快速提取菊花中的花青素,采用分光光度计法测定花青素含量,具体参考刘长姣等[25]的方法。根系活力的测定采用氯化三苯基四氮唑法(TTC法),无色的TTC被根系还原后生成红色不溶于水的TTF,TTC的还原强度可表示根系脱氢酶活性,并作为根系活力指标[26]。
1.4 统计分析方法
采用SPSS 26对试验所得数据进行ANOVA方差分析、Duncan多重比较(α=0.05),数据采用平均值±标准差表示。
2 结果与分析
2.1 光周期对菊花生长指标的影响
由图2可知,菊花株高随着发育期的推进均不断增加。从第90天开始,CK株高均为最大,Ph11株高最小,差异显著。从第60天开始,Ph7的茎粗始终最小,CK茎粗始终最大。Ph7、Ph8的茎粗随着处理天数的增加始终在减小,这与植株所处的光照环境有关,植株需通过增加株高以在极有限的光照时间内捕获更多光能,进而弥补光照时间的不足,受限于光照过短茎干变细、株茎比增加,植株徒长纤弱。试验60 d开始,Ph7的株茎比始终最大,Ph11的株茎比最小,差异显著。叶片作为植物重要的营养器官之一,其数目的多少直接受光照时间的影响。试验30 d,Ph7、Ph8的叶片数已显著小于其他处理组,Ph7叶片数仅为CK的53.3%,到120 d Ph7仅有CK的41.78%。整个试验过程Ph7的叶片数始终最小,CK叶片数最大,差异显著,Ph11与Ph9、Ph10的叶片数差异不显著,次于CK。可见,光周期可直接影响植株的光形态建成,Ph7、Ph8由于光照时间过短,植株徒长高度而茎秆纤细,表现为极易倒伏,叶片小且少,长势最差;长日照CK则生长最旺盛,株高、茎粗、叶片数均最大;Ph9、Ph10与Ph11差异未达显著水平,与Ph11一样,均具有矮壮粗的形态特征,植株体态矮化且匀称。
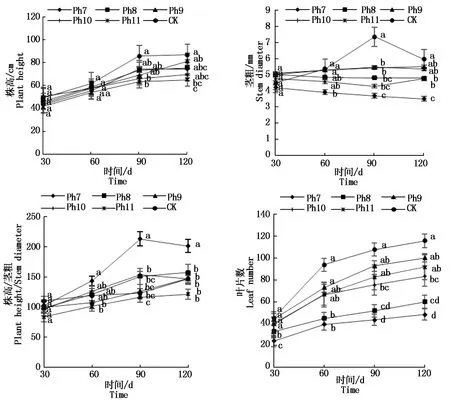
不同小写字母表示不同光周期处理在0.05水平上的差异显著性(P<0.05)。图3,5-6同。Different lowercase letters indicate the significant difference at the level of 0.05 among different photoperiod treatments(P<0.05).The same as Fig.3,5-6.
2.2 光周期对菊花叶片叶绿素含量的影响
叶绿素为植物进行光合作用的主要捕光色素,与植物体内的代谢生长有关。菊花叶片内色素含量由高到低依次为叶绿素a、叶绿素b、类胡萝卜素。由图3可知,试验第30天,以上3种色素均以Ph7的含量最高,叶绿素总量也最大,CK的光合色素含量最低,光合色素含量随光照时长的增加而减少,其中CK的叶绿素a仅有Ph7的47.28%,类胡萝卜素为Ph7的31.18%,差异显著。60 d则以CK的类胡萝卜素、叶绿素a、叶绿素b及叶绿素总量最高,Ph7的色素含量始终最低,光合色素含量随光照时长的减少而减小,其中CK的类胡萝卜素、叶绿素总量约为Ph7的2倍,差异显著。90 d Ph9除外,光合色素含量随着光照时长的减少而不断减小,即以CK最大,Ph11次之,Ph7最小。120 d,随着光照时长增加,叶绿素b、叶绿素总量均呈双峰趋势变化,第1峰值出现在Ph8,第2峰值出现在Ph11,且第2峰值均大于第1峰值,即Ph11光合色素含量最大,Ph7叶绿素含量最小,差异显著。由此可见,光周期可显著影响菊花叶片内光合色素含量,试验初光合色素含量与光照时长呈反比,以极短日Ph7的色素含量最高,这可能是植物的一种抗逆应激反应,在光照时间严重不足时,植物在短时间内通过增加色素的合成以最大限度地捕获光能进行光合作用,维持生长需要。光照可提高植物体内的叶绿素含量,随着光周期试验的推进,光合色素含量与光照时长呈正比。
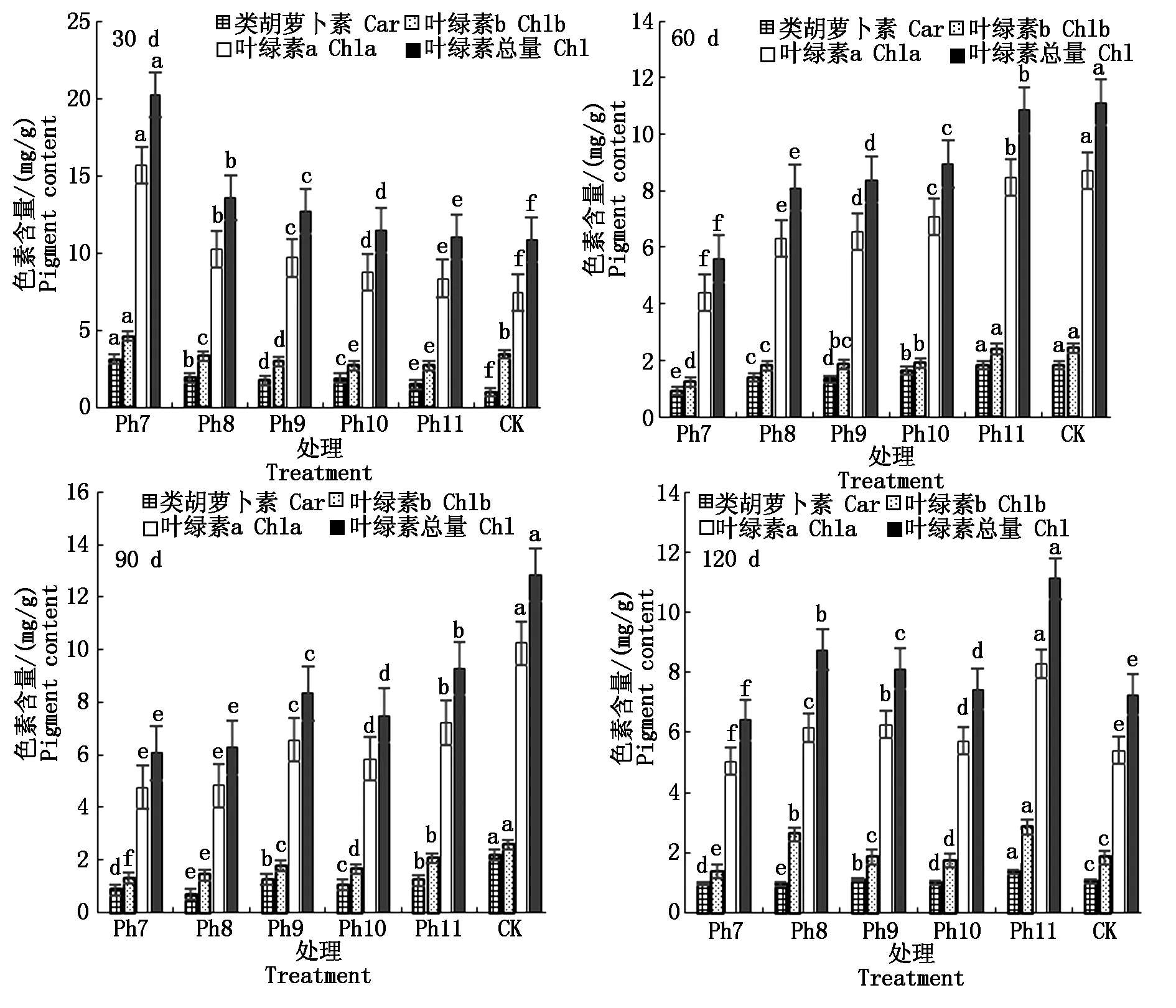
图3 不同光周期处理下菊花光合色素的比较Fig.3 Comparison of photosynthetic pigments in chrysanthemum under different photoperiod treatments
2.3 光周期对菊花发育进程的影响
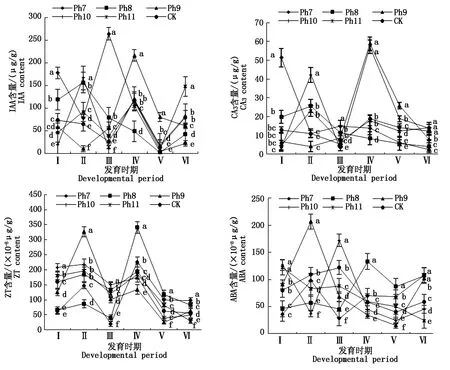
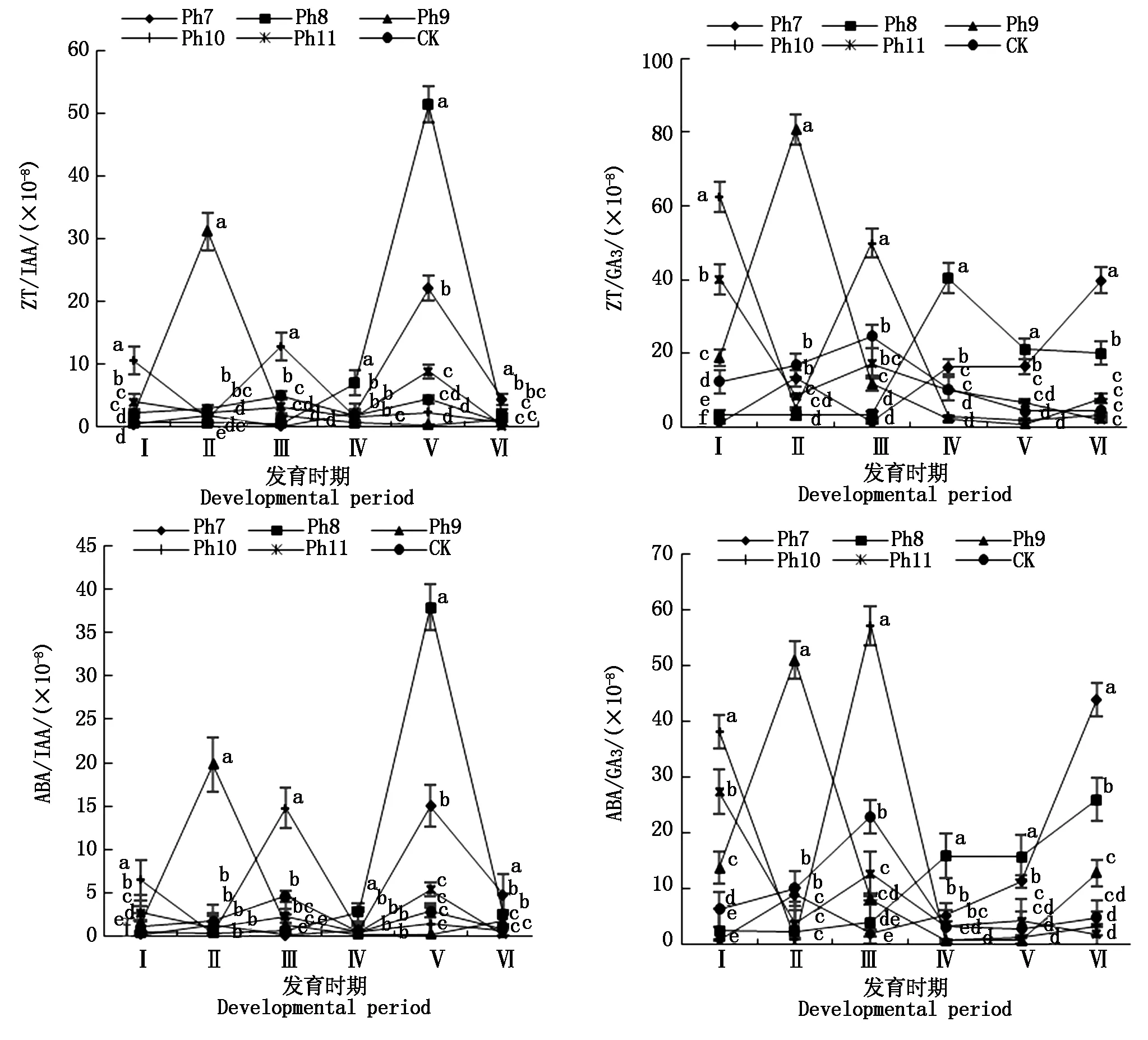
由图4可知,不同光周期可明显干扰菊花的花蕾发育进程,以现蕾历时的组间差异最大。Ph10最先开始花芽分化,仅需35 d出现花蕾,Ph11次之,历时39 d。Ph7从处理到现蕾历时最长,105 d为Ph10的3倍,CK次之,历时95 d,Ph8历时78 d。可见,对菊花的成蕾过程起诱导作用的最适宜光周期为Ph10,诱导天数为35 d,Ph7与长日光周期下的菊花成蕾均严重滞后。不同光周期从处理到舌状花完全外展的盛花历时,总体表现为Ph10 图4 不同光周期处理下菊花发育历时的比较Fig.4 Comparison of chrysanthemum development duration under different photoperiod treatments 由图5可知,光周期可显著影响菊花叶片的内源激素含量,不同发育期下激素含量也不尽相同。菊花叶片IAA、GA3含量高于ZT、ABA。不同光周期的IAA和GA3含量在同一发育期的大小情况基本一致。现蕾期IAA、GA3均以Ph10含量最低,Ph7含量最高,Ph8次之,差异显著;初绽期IAA、GA3以Ph10最低,Ph7最高,差异显著;初花、盛花期IAA、GA3以Ph8最低,Ph9最高,差异显著;Ph10的IAA含量次于Ph9,初萎期IAA、GA3以Ph7含量最低,Ph11含量最高,差异显著,Ph10的IAA含量次于Ph11。随着发育期的推进,ZT含量呈双峰曲线变化,2次峰值出现在破蕾期和初花期,初绽、盛花期时ZT含量下降。破蕾期除外,不同光周期的ABA、ZT在同一发育期的大小情况基本一致。现蕾和初绽期ZT、ABA含量以Ph10最高,Ph7、Ph8较低,差异显著;初花、盛花期Ph8含量最高,Ph7仅次之,Ph9、Ph10含量较低,差异显著;初萎期依然以Ph7、Ph8含量较高,Ph11最低,Ph10仅次于Ph11,差异显著。 Ph10在现蕾、初绽期,IAA、GA3含量最低,ZT、ABA含量最高,在初花、盛花以及初萎期IAA、GA3含量较高,ZT、ABA含量最低。Ph7、Ph8在现蕾、初绽期,IAA、GA3含量较高,ZT、ABA含量较低,初花、盛花以及初萎期IAA、GA3含量较低,ZT、ABA含量较高。可见,同一发育期内源激素含量的高低与光照周期有关,叶片内IAA、GA3与ZT、ABA存在着一定的拮抗作用。 Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ分别表示现蕾期、破蕾期、初绽期、初花期、盛花期、初萎期。图6同。Ⅰ,Ⅱ ,Ⅲ ,Ⅳ ,Ⅴ ,Ⅵ represent budding stage,bud breaking stage,petal formation stage,initial flowering stage,full blooming stage,early wilting stage,respectively.The same as Fig.6. 由图6可知,不同光周期的4种激素比值在同一发育期的相对大小情况相同,现蕾期以Ph10比值最大,Ph11次之,Ph7最小;初绽期时以Ph10最大,Ph7、Ph8较小;初花、盛花期时均以Ph8最大,Ph9最小,Ph10次之;初萎期时以Ph7、Ph8比值较大,Ph11最小,Ph10次之,差异均显著。 图6 不同光周期处理下菊花内源激素比值的比较Fig.6 Comparison of endogenous hormone ratios in chrysanthemum under different photoperiod treatments 不同光周期ZT/IAA、ABA/IAA随发育期变化的曲线走势基本一致,ZT/GA3、ABA/GA3曲线走势基本一致,这与菊花叶片内IAA、GA3含量大于ZT和ABA有关。Ph10现蕾期,ZT/IAA和ABA/IAA分别为最小值Ph7的30,31倍,初绽期Ph10的ZT/IAA和ABA/IAA快速增加,分别为最小值Ph7的170,140倍;Ph7、Ph8在盛花期,ZT/IAA和ABA/IAA快速增大,以Ph8的增加幅度最大,其中Ph8的ZT/IAA为最小值Ph9的170倍,差异显著。对于ZT/GA3和ABA/ GA3而言,现蕾期Ph10远远大于其他处理组,ZT/GA3为最小值Ph7的52倍,ABA/GA3为Ph7的54倍;初绽期Ph10的ZT/GA3为最小值Ph7的37倍,ABA/ GA3为Ph7的30倍;初花期Ph8的ZT/GA3为最小值Ph9的18倍;初萎期时Ph7、Ph8的ZT/GA3和ABA/GA3快速增加,以Ph7的上升幅度最大,分别为最小值Ph11的19,26倍,差异显著。可见,光周期可显著影响不同发育期叶片内的激素平衡,并以Ph7、Ph8、Ph10的激素变化最大。 不同光周期下菊花根系活力差异显著,Ph7、Ph8的根系活力均显著大于CK,其中Ph7根系活力为CK的2倍,为最小值Ph9的2.7倍,差异显著,这与Ph7、Ph8光照时间过短有关,根系活力的提高为植株抗逆性的表现。总体表现为Ph7>Ph8>CK>Ph10>Ph11>Ph9,Ph10、Ph11与Ph9根系活力差异不显著。 不同光周期下的切花数量和切花质量有显著差异。长日照CK的单株花数最多,其次为Ph10,Ph7、Ph8单株花数最少,均小于CK的10%,差异显著。从表1可以看出,Ph7、Ph8的花径和花青素最小。长日CK的花径最大,Ph11次之,而花青素以Ph11最大,CK次之,可见,切花最大,花瓣不一定开得最鲜艳,同样地,花瓣鲜艳程度也不一定与花径呈正比。 表1 不同光周期处理下菊花根系活力和切花品质的比较Tab.1 Comparison of root activity and flower quality of chrysanthemum under different photoperiods CK由于光照充足,单株花数和花径均最大,说明长日照有利于花径和花数的提高,Ph10的单株花数和花径较大,花青素含量较低,Ph7、Ph8不仅切花数量少且小,切花品质也最低。 光作为植物最重要的能量来源,对植物的营养积累与生长发育过程有着深刻的影响[27]。有研究表明,光周期能诱导植物体内与营养生长相关的基因表达[28],延长光照时间可增大油葵芽苗菜的植株高度和叶面积[29],增大黄瓜的茎粗并加快其生长速率[30]。在本试验中,不同光周期下菊花的外观形态存在差异显著,长日照CK由于光合时间最长,叶绿素合成增加至最大,生长最旺盛,植株高大粗壮、叶片浓密。光周期的延长使植株进行光合作用的时间增加,合成积累更多有机物以支持植物的生长发育,反之光周期缩短则有机物合成减少,生长受阻[31]。极短日光周期Ph7、Ph8的茎粗试验过程始终在减小,维持株高的不断增加,说明此光照条件已不能满足正常生长需要,植株受到光胁迫,需通过增加株高以捕获到更多光能,属于植物的一种抗逆性表现,其根系活力和叶绿素含量更是说明了这一点,Ph7、Ph8根系活力远大于CK,且试验初期叶绿素含量最大,这均为植株在不利环境下的应激表现,随着不利环境的持续,光合色素含量变为最小,叶片数最少,长势最差,极大的株茎比导致植株易倒伏,这与李海云等[32]的研究结果一致。Ph10与Ph11生长指标差异不显著,介于CK和Ph7、Ph8之间,均具有矮壮粗的形态特征,Ph11叶绿素含量则显著大于Ph10,由此可见,光周期可显著影响叶片内的光合色素含量,这与薛欢等[33]的研究结果一致。 对于短日植物秋菊而言,光周期是决定其花芽分化与否的重要环境因子。本研究表明,不同光周期下菊花的小花发育差异较大,Ph10最先开始花芽分化,仅需35 d即完成花蕾的发育过程,在长日照、极短日光周期Ph7、Ph8条件下,植株在很长一段时间内都处于营养生长状态,花期严重推迟,成蕾诱导天数长达105 d,这说明菊花对Ph10的光照环境(长暗期)较敏感,花芽分化的启动需经过一定长度的暗期,且开花响应不是简单地与暗期长度呈正比,这与房伟民等[34]的研究结果一致。植物的花芽分化和小花发育是一个受多物质调控的复杂过程,叶片内源激素就是其中一个关键因子,作物花芽发育进程与内源激素含量、激素平衡息息相关。IAA、GA3被认为是抑制小花发育的一种激素信号,对于短日植物而言,高含量的IAA、GA3抑制花芽分化[35]。林贵玉等[36]研究认为,高含量的ZT、ABA有利于短日植物的花芽分化。本研究表明,现蕾期时,Ph10的IAA、GA3含量最低,ZT、ABA含量最高,而CK和Ph7、Ph8的IAA、GA3含量较高,ZT、ABA含量较低,这与前人的研究结果一致。现蕾期时Ph10的ZT/IAA、ABA/IAA、ZT/GA3和ABA/GA3均较大,CK和Ph7、Ph8的激素比值较小更是说明了这一点,ZT/IAA、ABA/IAA、ZT/GA3以及ABA/GA3越大,越有利于菊花的花芽分化。 王彩侠[37]研究认为,菊花在破蕾显色后,花期将不再受光周期的影响。本研究表明,在初花和盛花期,均以Ph7、Ph8的IAA、GA3含量较低,ZT、ABA较高,ZT/IAA、ABA/IAA、ZT/GA3和ABA/ GA3较大,对应的初花、盛花发育历时较小,而从处理到盛花依旧是以Ph10的历时最短,Ph7、Ph8历时较长,说明光周期的促花作用主要是影响花芽分化启动、花蕾形成过程而达到花期调控的目的,舌状花瓣的展开过程虽然也受光周期的调节,但对花期的提前不起决定作用,这与前人研究结果基本一致。初萎历时即盛花持续时间以Ph10较长,且大于CK,这与植株体内ZT、ABA含量较低,IAA、GA3含量较高有关。以Ph7、Ph8的盛花持续时间最短。 营养生长是生殖生长的基础,开花质量与植株前期的营养生长状况息息相关。本研究表明,长日照CK菊花由于光合色素含量高,生长旺盛,单株花数和花径均最大,Ph10次之;Ph10植株体态矮化、匀称,生长充分,在高含量的促花激素ZT、ABA作用下,最先启动花芽分化出现花蕾,CK以抑花激素IAA、GA3含量较高而促花激素含量较低,植株保持过于旺盛的营养生长,花期滞后。Ph7、Ph8根系活力较大且在试验初出现光合色素远大于其余处理组的抗逆反应,光照时长过短植株已受到光胁迫,试验后期色素含量低、植株徒长纤弱,极度匮乏的营养生长以及体内含量极低的促花激素导致生殖阶段切花小且少、现蕾历时最长,切花质量最低,这与朱玲俐[38]的研究结果一致。 花青素表征着花瓣的鲜艳程度,使花瓣呈现出红色、紫色、蓝色[39]。Ph9、Ph11和CK的花期虽都晚于Ph10,但花青素含量却显著大于Ph10,光周期在促花的同时,也会对花色和切花品质产生影响[40]。Ph9花瓣色泽鲜艳,但花心外露植株出现畸形花,这可能与管状花发育不良有关。张翠华[41]研究表明,花心外露大多为光照时长过短造成,光周期下畸形花的形成机理还有待进一步研究。 综上所述,Ph10即10 h/14 h(昼/夜)对菊花开花的诱导效果最好,植株体态矮化且匀称,花芽分化早,花蕾发育周期短,花期集中,盛花产出快且不易萎蔫。生产上为获得高品质切花菊,对长日照下生长35 d以上处于成花感受态的菊花进行10 h/14 h光周期处理,可使菊花最快启动花芽分化,待破蕾显色后移至长日照下正常开花。此结论可为夏季南京地区的菊花栽培提供理论依据,实现秋菊的反季开花。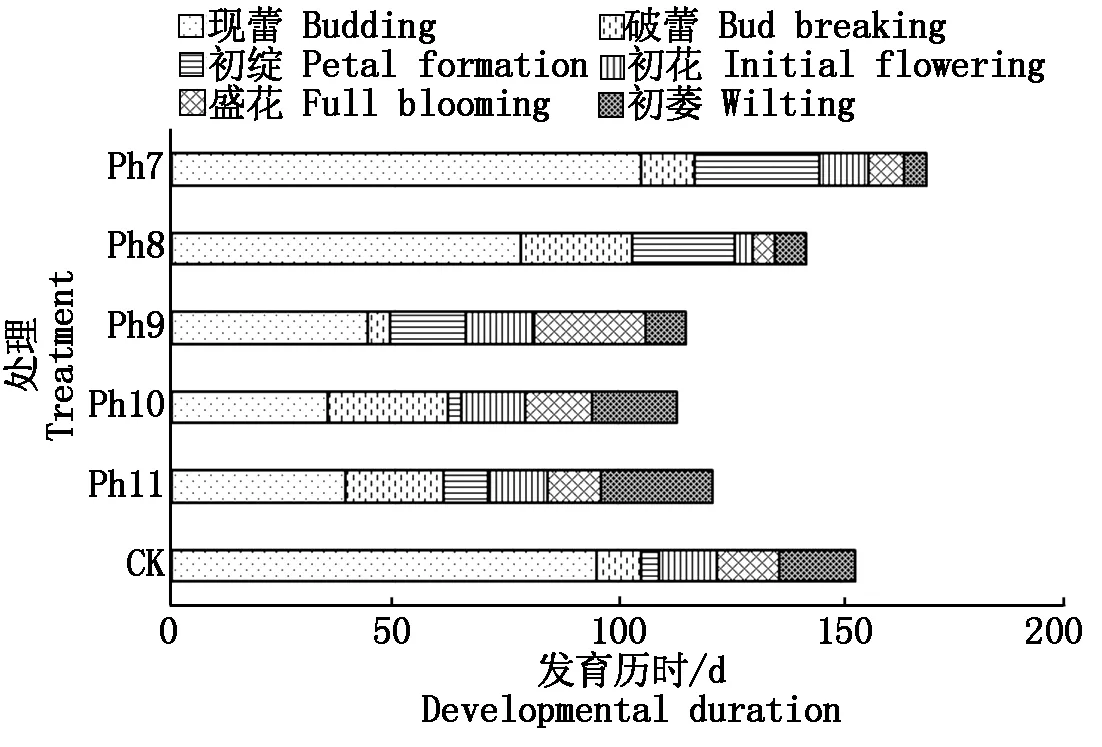
2.4 光周期对菊花叶片内源激素含量的影响
2.5 光周期对菊花叶片内源激素比值的影响
2.6 光周期对菊花根系活力和切花品质的影响

3 讨论与结论
3.1 光周期对菊花营养生长的影响
3.2 光周期对菊花生殖生长的影响
3.3 光周期对菊花生长发育的影响

