鹿茸菇多酚提取工艺优化及其抗氧化活性
杨斌,方柄栋,郑峻,单灿灿,李佳欢,3,程泳春,孙淑静,3,胡开辉,3*,金文松,3*
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建省食用菌技术推广总站,福建 福州 350002;3.福建农林大学(古田)菌业研究院,福建 宁德 352200;4.福建珍菌子生物科技有限公司,福建 宁德 352200)
鹿茸菇,学名荷叶离褶伞(Lyophyllum decastes),分类学地位为担子菌纲,伞菌目,白蘑科,离褶伞属,主要分布在我国的四川、云南、青海等地区。鹿茸菇营养丰富[1],风味独特,口感鲜美,已流行成为百姓餐桌上的一道美食;多篇文献报导鹿茸菇含有多种生物活性物质(多糖、嘌呤、甾醇等)[2-3],具有抗氧化[4-6]、抗肿瘤[7-9]、降血脂[10]、降血糖[11]等多种药用活性。
抗氧化剂是一类可以干扰自由基连锁反应,清除体内多余自由基的物质,根据来源不同可分为化学合成抗氧化剂和天然抗氧化剂。化学合成抗氧化剂相较于天然抗氧化剂具有工艺成熟、价格低廉、性能稳定等优势,因而目前市面上常见的抗氧化剂主要以化学合成为主,但是其对人体存在较大的副作用,安全性低,不宜大范围推广使用;天然抗氧化剂主要来自于果蔬、中草药、大型真菌,如维生素C、多酚类、生物碱等,来源广泛、绿色安全,具有大范围开发应用的潜力。近年来为丰富天然抗氧化剂的来源,提升食用菌的综合利用价值,研究人员对香菇[12]、金针菇[13]、杏鲍菇[14]、姬松茸[15]、灵芝[16]、桑黄[17-18]、灰树花[19]、海鲜菇[20-21]等常见食药用菌子实体中多酚的提取工艺和抗氧化活性进行了探究和报道。鹿茸菇是近年来新兴的工厂化栽培药食兼用菌,具有较高的营养价值,但是目前鹿茸菇的研究主要集中于工厂化栽培工艺方面,关于活性成分功能的相关研究较少,因而本试验以鹿茸菇为试材,采用响应面设计对超声辅助水提鹿茸菇多酚工艺进行优化,并对其体外抗氧化活性进行探究,为提升鹿茸菇的综合利用价值奠定一定的理论基础。
1 材料与方法
1.1 材料与试剂
鹿茸菇干品:福建珍菌子生物科技有限公司;无水乙醇、甲醇、乙酸乙酯、十二水合磷酸钠、福林酚(均为分析纯):国药集团化学试剂有限公司;无水碳酸钠、四水合钼酸铵(均为分析纯):西陇化工有限公司;1-1-二苯基-2-三硝基本肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH,纯度≥97%):梯希爱(上海)化成工业有限发展公司;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸 [2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS,纯度≥98%]:北京索莱宝科技有限公司;维生素C(纯度≥99%):美国Sigma公司;没食子酸(纯度≥99%):上海麦克林生化科技有限公司。
1.2 仪器与设备
高速多功能粉碎机(HC-700):永康市天祺盛世工贸有限公司;数控超声波清洗器(KH-500DE):昆山禾创超声仪器有限公司;多功能酶标仪(3020):赛默飞世尔科技有限公司;高速冷冻离心机(2-16KL):美国Sigma公司;电热恒温水浴锅(DK-S24):上海一恒仪器科技有限公司;电子天平(AL204):梅特勒托利多(上海)有限公司;紫外分光光度计(T6):北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 原材料预处理
将鹿茸菇干品用粉碎机粉碎,过60目筛,制成鹿茸菇粉末备用。
1.3.2 多酚含量测定
精确配制不同浓度的没食子酸标准液,多酚含量测定的反应体系按照张梅梅等[22]的测定方法,于750 nm测定标准液吸光度,以标准液浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制没食子酸标准曲线(图1),线性回归方程为y=10.308x+0.009 7,R2=0.999 4。取不同条件下制备的多酚水溶液,在750 nm处测定吸光度,按照式(1)计算多酚得率。
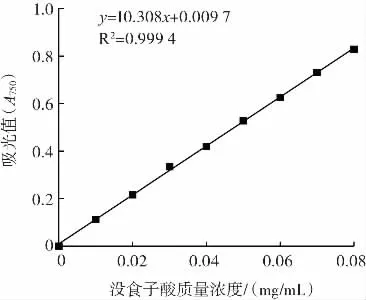
图1 没食子酸标准曲线Fig.1 Standard curve for determination of gallic acid
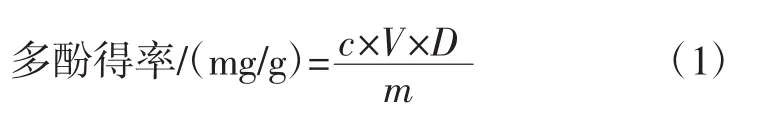
式中:c为标准曲线计算所得的多酚浓度,mg/mL;V为提取液总体积,mL;m为干粉质量,g;D为稀释倍数。
1.3.3 鹿茸菇多酚提取单因素试验
称取鹿茸菇粉末各1 g,分别探究不同溶剂(水、甲醇、乙醇、正丁醇、乙酸乙酯);不同液料比[40∶1、50∶1、60∶1、70∶1、80∶1(mL/g)];不同提取温度(30、40、50、60、70 ℃);不同提取时间(40、50 、60、70 、80、90、100、110 min);不同超声功率(200、250、300、350、400、450、500 W)对鹿茸菇多酚得率的影响。
1.3.4 响应面工艺优化
选取 A(液料比),B(提取温度),C(提取时间),D(超声功率)4个因素,基于单因素试验结果,采用Box-Beheken设计,以多酚得率为响应值,对超声水提鹿茸菇多酚工艺进行优化,根据Design-Expert 8软件设计了29组试验。
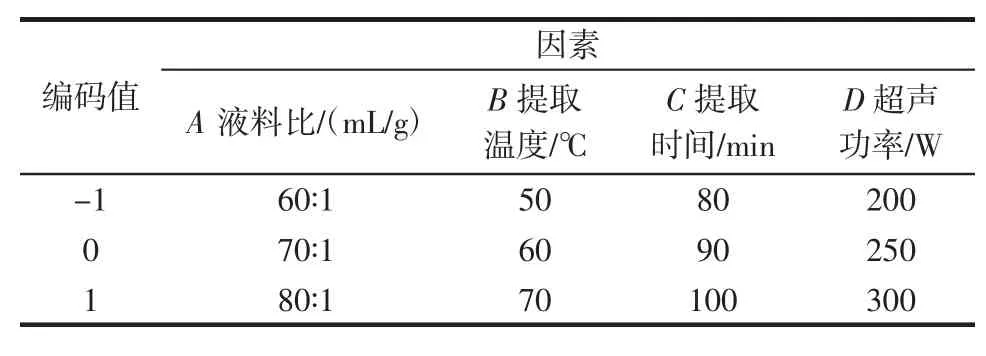
表1 Box-Behnken设计因素水平编码Table 1 Codes and levels of factors in Box-Behnken design
1.3.5 抗氧化活性测定
1.3.5.1 总抗氧化能力测定
反应体系参考梁引库等[23]的测定方法,待反应结束后,取反应液于695 nm处测定吸光度,以去离子水作空白,维生素C作阳性对照,每个浓度3个平行,取平均值。
1.3.5.2 DPPH自由基清除能力测定
反应体系参考Ma等[24]的测定方法,于515 nm处测定样品吸光度(As),以水作为空白对照测得吸光度(Ac),以无水乙醇代替DPPH工作液测得本底吸光度(Aj),每个浓度3个平行,以维生素C作阳性对照,按照式(2)计算DPPH自由基清除率。
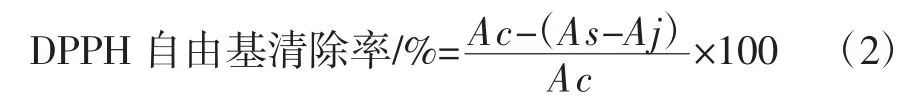
1.3.5.3 ABTS+自由基清除能力测定
反应体系参考Re等[25]的测定方法,于734 nm处测定样品吸光度(As),以水作空白测得空白吸光度(Ac),以无水乙醇代替ABTS工作液测得样品本底吸光度(Aj),每个浓度3个平行,以维生素C作为阳性对照,按照式(3)计算ABTS+自由基清除率。
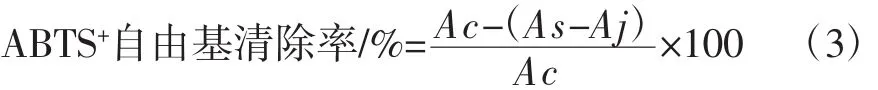
1.4 数据处理
试验结果取3次平行试验的平均值,数据表示为平均值±标准差,应用Graphpad prism 6软件进行数据统计分析。
2 结果与分析
2.1 单因素试验
2.1.1 不同溶剂对多酚得率的影响
不同溶剂对多酚得率的影响见图2。
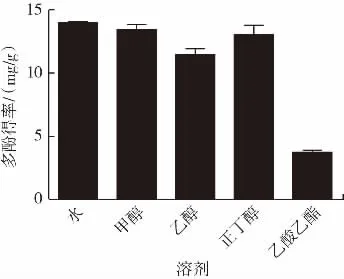
图2 不同溶剂对多酚得率的影响Fig.2 Effects of different solvents on the yield of polyphenols
由图2可知,以水作为提取溶剂,多酚得率最高,表明鹿茸菇多酚易溶于水,出于高提取效率和经济节约的原则,后续试验选择以水作为提取溶剂。
2.1.2 不同液料比对多酚得率的影响
不同液料比对多酚得率的影响见图3。
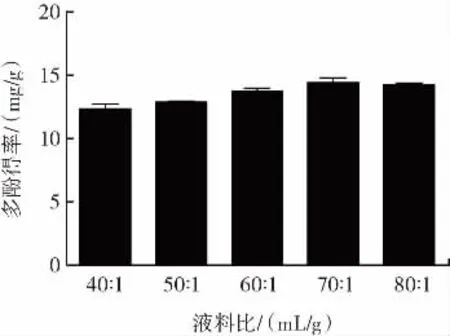
图3 不同液料比对多酚得率的影响Fig.3 Effects of different liquid-solid ratio on the yield of polyphenols
由图3可知,多酚得率随着液料比的增加整体呈先上升后趋于稳定的趋势,当液料比为70∶1(mL/g)时,多酚得率最高。试验结果表明增大液料比的比值可有效提升多酚得率,这主要是因为当样品量一定时,随着提取溶剂体积的增加,样品与溶剂接触的表面积增大,从而提高了胞内多酚的溶出效率。
2.1.3 不同提取温度对多酚得率的影响
不同提取温度对多酚得率的影响见图4。

图4 不同提取温度对多酚得率的影响Fig.4 Effects of different extraction temperatures on the yield of polyphenols
由图4可知,在30℃~60℃,升高温度有利于多酚提取,提取温度为60℃时,多酚得率最高。这可能是因为提取温度低,胞内多酚的溶出效率低,而多酚类物质性质不稳定,提取温度过高,可能会引起多酚氧化降解或结构受到破坏,导致多酚得率下降。
2.1.4 不同提取时间对多酚得率的影响
不同提取时间对多酚得率的影响见图5。
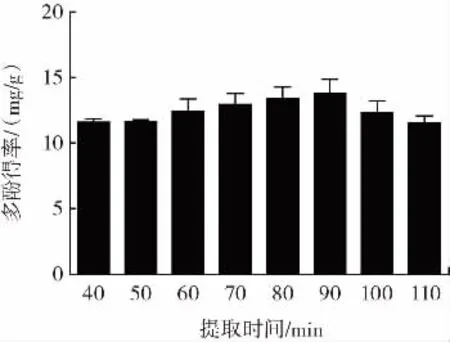
图5 不同提取时间对多酚得率的影响Fig.5 Effects of different extraction time on the yield of polyphenols
由图5可知,提取时间在40 min~110 min时,多酚得率随着提取时间的延长整体呈先上升后下降的趋势,提取时间为90 min时,多酚得率最高。这可能是因为提取时间过短,胞内多酚未能完全溶出,随着提取时间的延长,胞内多酚逐渐溶出,胞内胞外多酚浓度趋于饱和,多酚得率逐渐上升。
2.1.5 不同超声功率对多酚得率的影响
不同超声功率对多酚得率的影响见图6。
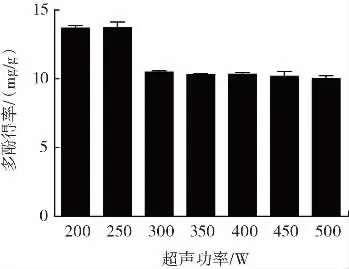
图6 不同超声功率对多酚得率的影响Fig.6 Effects of different ultrasonic power on the yield of polyphenols
由图6可知,超声功率在200 W与250 W时,多酚得率基本相当;当超声功率超过250 W时,多酚得率大幅下降。试验结果表明大额功率超声不利于多酚提取。
2.2 响应面优化试验
2.2.1 回归方程的建立
以单因素试验数据为参考,选取液料比、提取温度、提取时间、超声功率4个因素进行四因素三水平的提取工艺优化试验,Box-Behnken设计与结果如表2所示。
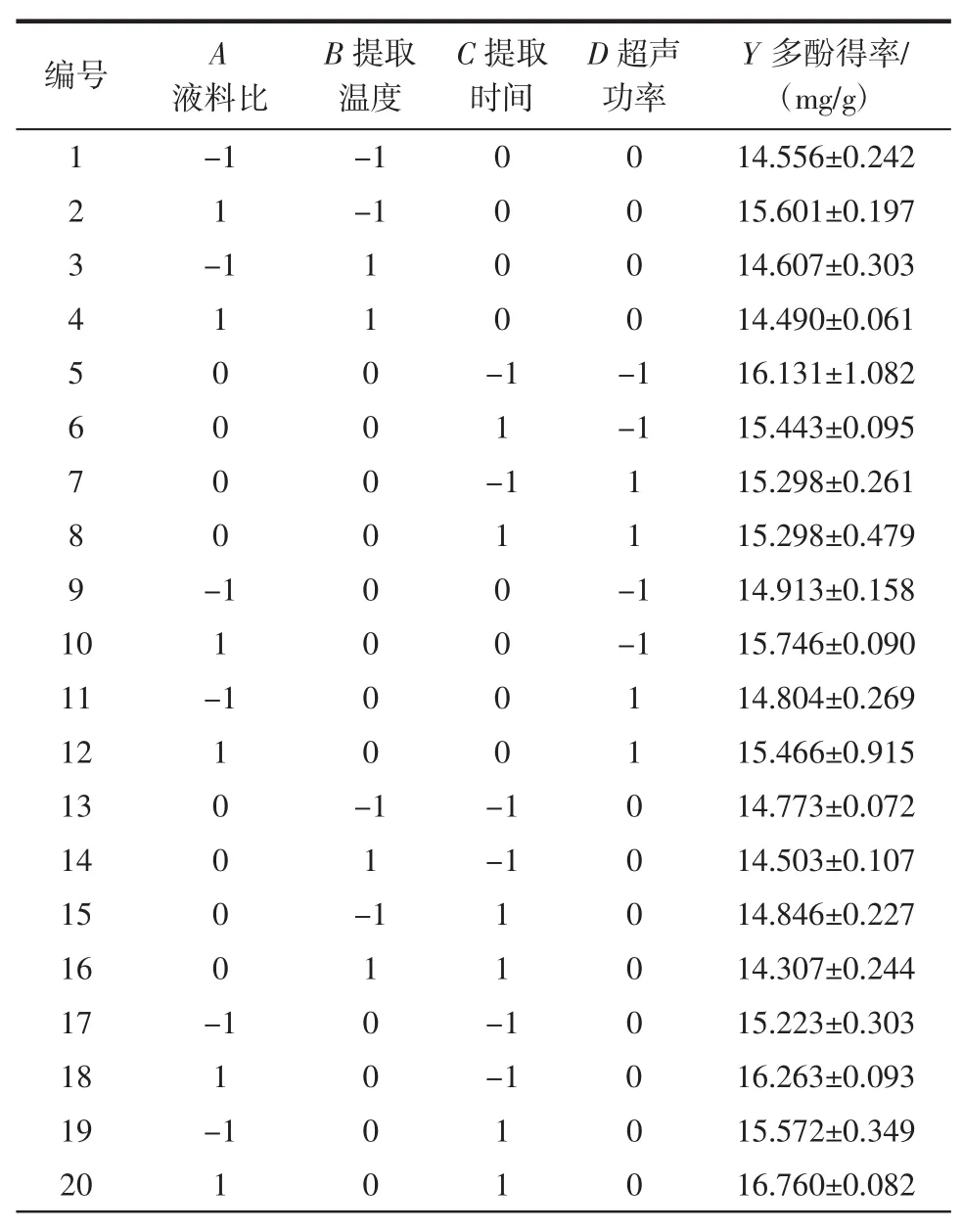
表2 Box-Behnken设计及试验结果Table 2 Box-Behnken design and the corresponding experimental results
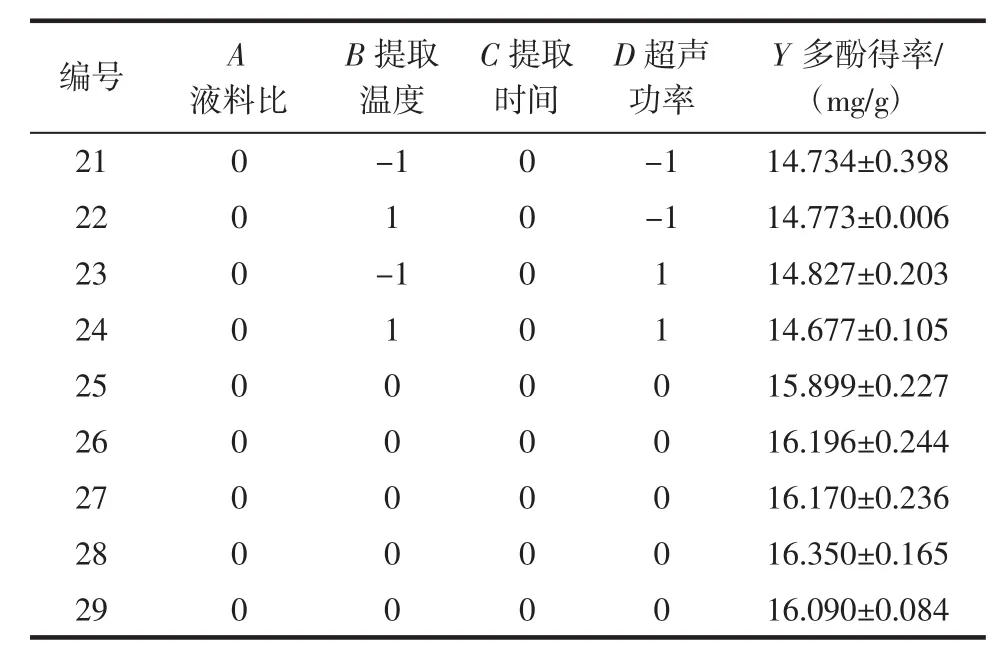
续表2 Box-Behnken设计及试验结果Continue table 2 Box-Behnken design and the corresponding experimental results
整理29组试验数据并利用Design Expert 8.0.6软件对试验数据进行分析,拟合得到二次回归方程:Y=16.13+0.27A-0.22B+0.02C-0.098D-0.29AB-0.14AC-0.042AD-0.067BC-0.22BD-0.048CD-0.27A2-1.09B2-0.33C2-0.52D2。
2.2.2 模型方差分析
响应面模型方差分析结果如表3所示。
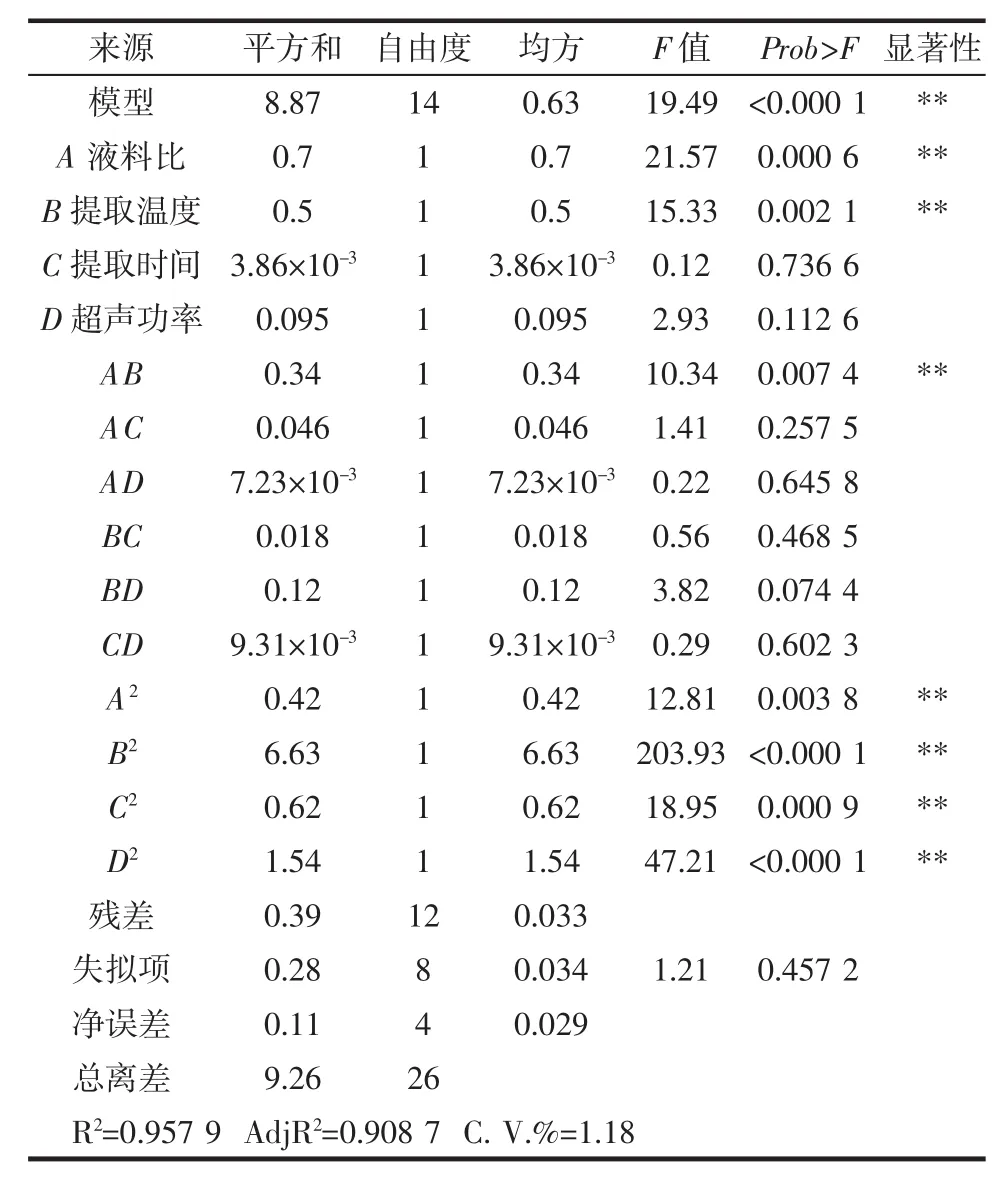
表3 回归方程方差分析结果Table 3 Results of quadratic regression model for response surface analysis
由表 3 可知模型 F 值=19.49,(Prob>F)<0.000 1,高度显著;而失拟项F值=1.21,(Prob>F)=0.457 2>0.05,不显著,表明所建模型可用于预测实际多酚得率,且具有统计学意义。相关系数R2=0.957 9,AdjR2=0.908 7,C.V.%值仅为1.18,以上分析结果表明所建模型与实际试验结果的拟合程度高,约90.87%的鹿茸菇多酚得率可用该模型来预测和描述,可应用于后续试验。
2.2.3 多酚得率响应面分析
由表3可知,液料比和提取温度两因素之间的交互作用对多酚提取得率的影响达极显著水平(P<0.01)。为较为直观的观察因素变化对多酚提取得率变化的影响,根据所拟合出的二次回归方程,利用Design Expert 8.0.6软件绘制的3D曲面图如图7~图9所示。
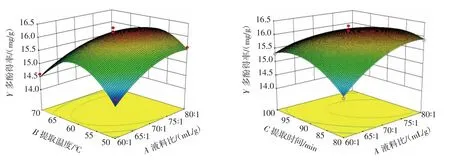
图7 液料比和提取温度、液料比和提取时间之间的交互作用对多酚得率的影响Fig.7 Effect of interaction between liquid-to-material ratio and temperature,liquid-to-material ratio and time on the yield of polyphenols
提取温度 55 ℃~65 ℃,液料比为 70∶1(mL/g)~80∶1(mL/g)时,多酚得率较高;提取时间 85 min~95 min,液料比 70∶1(mL/g)~80∶1(mL/g)时,多酚得率较高(图 7)。超声功率 225W~275W,液料比70∶1(mL/g)~80∶1(mL/g)时,多酚得率较高;提取时间 85min~95 min,提取温度60℃~65℃时,多酚得率较高(图8)。超声功率225 W~275 W,提取温度60℃~65℃时,多酚得率较高;超声功率225 W~275 W,提取时间85 min~95 min时,多酚得率较高(图9)。分析等高线图可知,所有的等高线均呈椭圆形,表明分析因素间存在一定的交互作用,其中提取温度和液料比之间的交互作用对多酚得率具有决定性的影响(图7)。综合方差分析与曲面图分析结果表明,因素间的交互作用对多酚得率不起主导作用,鹿茸菇多酚得率主要受到单个因素的影响。
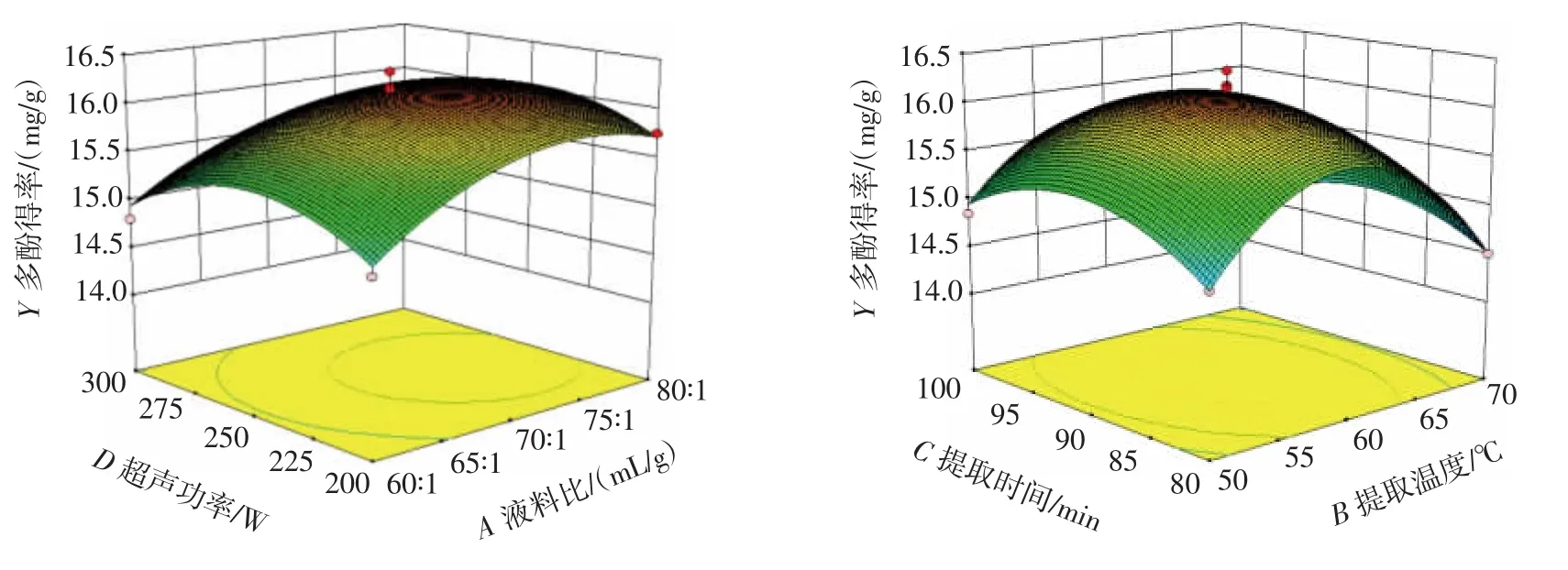
图8 液料比和超声功率、提取温度和提取时间之间的交互作用对多酚得率的影响Fig.8 Effect of the interaction between liquid-to-material ratio and power,temperature and time on the yield of polyphenols
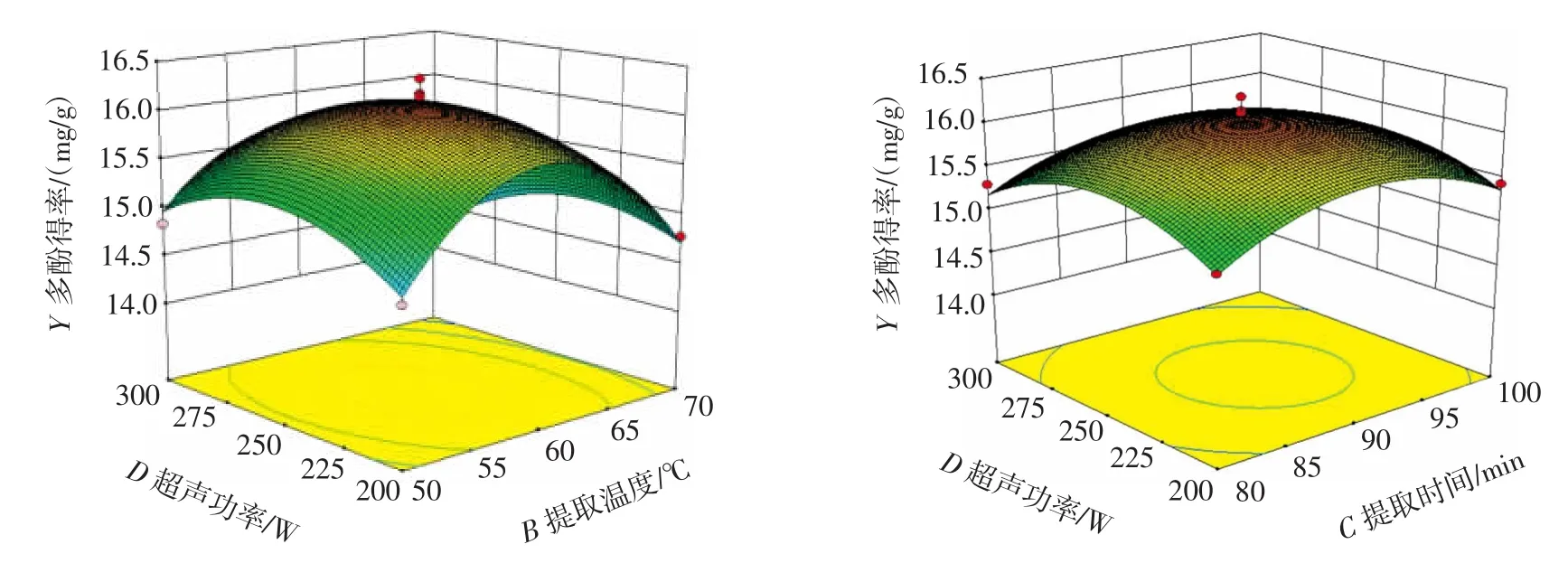
图9 提取温度和超声功率、提取时间和超声功率之间的交互作用对多酚得率的影响Fig.9 Effect of interactions between temperature and power,time and power on the yield of polyphenols
2.2.4 最优试验条件验证
经单因素设计与响应面优化设计得出鹿茸菇多酚的最佳提取工艺为液料比76.01∶1(mL/g)、提取温度58.27℃、提取时间89.3 min、超声功率246.14 W,多酚最大理论得率为16.760 mg/g。结合实验室的实际条件对上述工艺参数稍作改动,液料比为76∶1(mL/g)、提取温度60℃、提取时间90 min、超声功率250 W,多酚得率为(16.591±0.173)mg/g,与理论得率较为接近,表明所建模型能对鹿茸菇多酚实际提取得率进行预测,拟合程度高。
2.3 抗氧化活性测定
2.3.1 总抗氧化能力
多酚提取物和维生素C总抗氧化能力见图10。
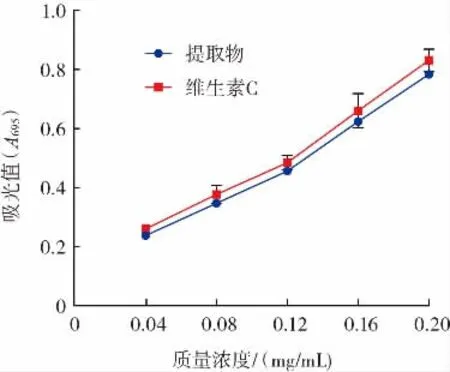
图10 多酚提取物和维生素C总抗氧化能力Fig.10 Total antioxidant capability of polyphenol extract and vitamin C
由图10可知,在0.04 mg/mL~0.20 mg/mL浓度范围内,鹿茸菇多酚提取物的总抗氧化能力随着浓度的增加逐渐上升,但整体略低于维生素C;根据线性拟合的结果,分别计算出了多酚提取物和维生素C的EC50,其中多酚提取的 EC50数值(0.123 mg/mL)与维生素C(0.114 mg/mL)较为接近。以上试验结果表明鹿茸菇多酚具有较强的总抗氧化能力。
2.3.2 DPPH自由基清除能力
多酚提取物和维生素C对DPPH自由基的清除能力见图11。
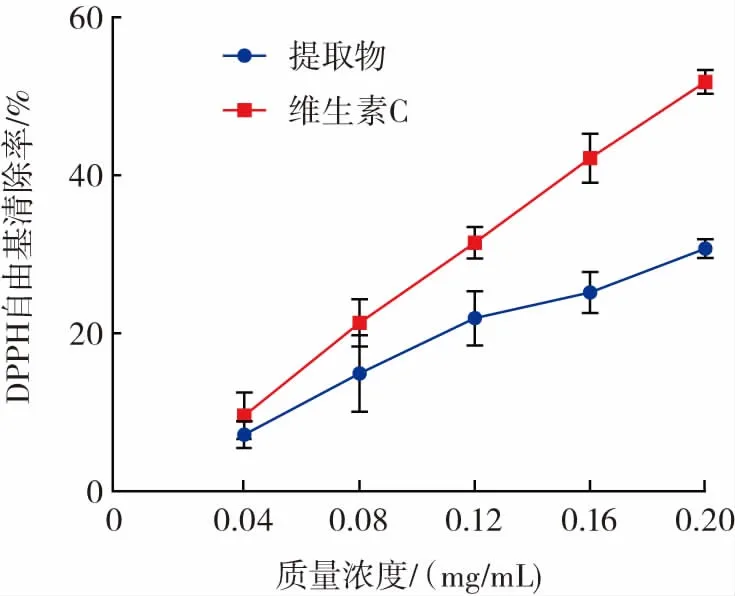
图11 多酚提取物和维生素C DPPH自由基清除能力Fig.11 DPPH free radical scavenging ability of polyphenol extract and vitamin C
由图11可知,在0.04 mg/mL~0.20 mg/mL浓度范围内,鹿茸菇多酚提取物对DPPH自由基的清除能力与多酚剂量成正相关;根据线性拟合的结果,鹿茸菇多酚提取物的IC50=0.303 mg/mL,维生素C的IC50=0.191 mg/mL。试验结果表明鹿茸菇多酚提取物具备清除DPPH自由基能力,但弱于维生素C。
2.3.3 ABTS+自由基清除能力
多酚提取物和维生素C对ABTS+自由基的清除能力见图12。

图12 多酚提取物和维生素C ABTS+自由基清除能力Fig.12 ABTS+free radical scavenging ability of polyphenol extract and vitamin C
由图12可知,在0.004 mg/mL~0.020 mg/mL浓度范围内,鹿茸菇多酚提取物对ABTS+自由基清除率的大小随着浓度增加而逐渐上升;根据线性拟合结果,分别计算出了鹿茸菇多酚提取物和维生素C的IC50值,其中鹿茸菇多酚提取物对ABTS+自由基表现出较强的清除活性,IC50数值(0.008 3 mg/mL)与维生素C(0.005 2 mg/mL)大小基本相等。
3 讨论与结论
近年来,研究人员为提升多酚得率,将传统提取方法与现代新兴技术相结合,对高效多酚提取工艺进行了探究和报道。Wen等[12]探究了颗粒度、提取时间、功率、液料比等因素对微波辅助有机溶剂提取香菇多酚的影响,发现颗粒度 1.75 nm,液料比 40∶1(mL/g),微波功率600 W,提取15 min,多酚得率较高;毛荣良等[26]对乙醇提取猴头菇多酚工艺进行了优化,最佳工艺:60%乙醇溶液,液料比 15∶1(mL/g),55 ℃水浴提取,多酚得率为16.701 mg/g;李丽等[27]对超声辅助乙醇提取保山桃红牛肝菌多酚工艺进行了优化,最优工艺:50%乙醇溶液,液料比 30∶1(mL/g),100 W,超声提取50 min,多酚得率为7.76 mg/g。本试验对超声辅助水提鹿茸菇多酚工艺进行了优化,最佳工艺:液料比76∶1(mL/g),250 W,60 ℃,提取 90 min,多酚得率为(16.591±0.173)mg/g,在本试验中鹿茸菇多酚的提取得率要远高于文献[27]报道的牛肝菌多酚提取得率,表明本提取工艺的提取效率较高,且具有经济节约、操作简单等优势,具有应用与实践生产的潜力。
建立自由基体外清除分析系统,如DPPH、ABTS+自由基等体系,可快速有效地对抗氧化活性成分进行筛选。王静等[28]研究发现采用热回流法提取的松茸多酚对ABTS+自由基展现出较强的清除能力,IC50=0.271 mg/mL;李彦坡等[29]研究发现松毛菇多酚能有效清除反应体系中的·OH、O2-·、DPPH·等自由基,且清除率大小与浓度具有剂量依赖效应;徐胜平等[30]研究发现4种云南野生牛肝菌(铜色牛肝菌、双色牛肝菌、美味牛肝菌以及灰褐牛肝菌)对DPPH自由基和ABTS+自由基均表现较强的清除活性,铁还原力IC50介于0.02和0.04之间。本试验中鹿茸菇多酚总抗氧化EC50=0.123 mg/mL,并能较高效清除DPPH自由基和ABTS+自由基,尤其对ABTS+自由基表现出较大清除活性,IC50=0.008 3 mg/mL,表明鹿茸菇多酚清除ABTS+自由基能力明显较松茸[28]、海鲜菇(IC50=0.94 mg/mL)[20-21]强。本研究结果表明鹿茸菇作为新兴的一种食用菌工厂化品种,其多酚具有较强的抗氧化活性,具有开发成抗氧剂的潜力。

