妊娠期糖尿病患者与正常妊娠妇女幽门螺杆菌感染等多因素对比分析研究
王国文,王文斌,高林
1.武威市凉州医院检验科,甘肃武威 733000;2.武威市人民医院病理科,甘肃武威 733000
糖尿病孕妇中80%以上为妊娠期糖尿病(gestational diabetes mellitus,GDM)[1],糖尿病合并妊娠(prepregnancy diabetes mellitus,PGDM)者不足20%[2]。GDM在我国发生率为1%~5%,近年有明显增高趋势[3]。GDM临床经过复杂,对孕妇及胎儿都有较大风险,应该给予较多重视。幽门螺杆菌(helicobacter pylori,Hp)易定植于胃中,感染影响世界大约1/2的人口,且在发展中国家更为普遍。全球约有44亿人患有Hp感染[4-7]。怀孕本身可能会增加对Hp感染的易感性,这可能是由于妊娠期间存在免疫适应以确保母体对半异体胎儿的耐受性[8]。并且,Hp感染也与通过脂多糖激活的toll样受体间接相关,导致代谢变化和胰岛素抵抗,最终引起GDM[9]。然而却很少有研究关注我国GDM孕妇Hp感染的发生率。基于此,该研究选取2020年2—8月进行产前检查确诊患有妊娠期糖尿病患者120例为研究对象,重点分析对患有妊娠期糖尿病(GDM)的孕妇进行幽门螺杆菌的检测,构建Logistic回归模型来筛选妊娠期糖尿病的独立影响因素,进一步明确妊娠期糖尿病与幽门旋杆菌感染的关系。现报道如下。
1 对象与方法
1.1 研究对象
选取产前检查确诊患有妊娠期糖尿病患者120例为GDM组,平均年龄(31.99±3.94)岁。纳入标准:符合GDM的诊断标准:进行糖筛查试验(50 g葡萄糖粉)及口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)实验(75 g糖耐量试验),检测出空腹血糖≥5.1 mmol/L和(或)OGTT后1 h血糖≥10.0 mmol/L和(或)OGTT后2 h血糖≥8.5 mmol/L;孕周24~28周;签订知情同意书。排除标准:孕前就患有糖尿病、高血压、脂质紊乱、肾脏疾病和溶血性贫血、地中海贫血、血红蛋白变异,或诊断不明确,或除GMD外还患有其他妊娠相关疾病者;年龄>40岁,或年龄<25;孕周<24周,或>28周;双胎或多胎妊娠者;临床资料不完整者。对照组120名,为产前检查排除患有妊娠期糖尿病及其他糖代谢异常等疾病的孕妇,平均年龄(30.47±2.78)岁。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
①一般资料的收集:产妇年龄以身份证信息为准、孕周以B超结果为准、询问是否吸烟等信息。使用标准方法测量女性的体质量和身高,然后计算其体质指数(BMI)=体质量/身高2(kg/m2)。②血糖监测:糖耐量试验在妊娠24~28周进行。妊娠期糖尿病的诊断基于国际糖尿病和妊娠研究组协会的建议。使用西门子ADVIA1800全自动生化分析仪仪器(通过葡萄糖氧化酶法)及其配套的试剂来检测血糖。③Hp的检测:GDM组和对照组均用14C尿素呼吸试验来检测幽门螺杆菌,空白试验及第2次、第3次所采集的试管用同位素质谱仪检测,超基准值(DOB值)>4.4为阳性,超基准值(DOB值)<3.6为阴性,比较GDM组及对照组各年龄阶段幽门螺杆菌感染率是否有统计学意义。不愿进行14C尿素呼吸试验的人群检测静脉血Hp抗体。
1.3 统计方法
采用SPSS 22.0统计学软件进行数据分析,计量资料的表达方式为(±s),组间差异比较采用t检验;计量资料的表达方式为[n(%)],组间差异比较采用χ2检验,采用Logistic回归,以是否患妊娠期糖尿病为因变量,是否HP感染、产妇孕前年龄、孕周、是否吸烟、孕前BMI等为自变量构建Logistic回归模型,筛选妊娠期糖尿病的独立影响因素,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料与临床特征比较
两组年龄分段、孕前BMI、吸烟比率和孕周比较,差异无统计学意义(P>0.05)。GDM组Hp感染的阳性率高于对照组(37.50%vs 17.50%),差异有统计学意义(P<0.05)。见表1。
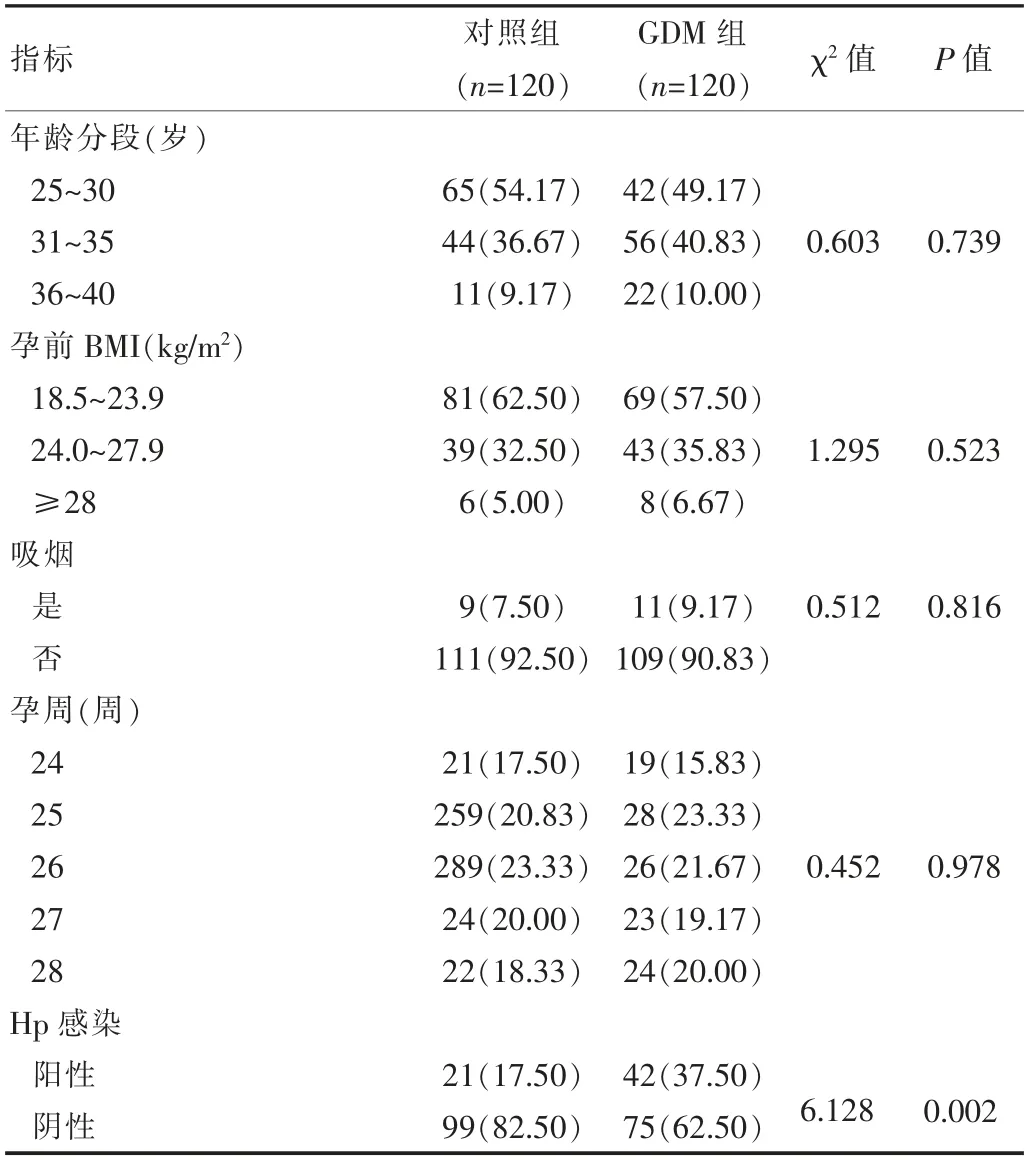
表1 两组一般资料和临床特征比较[n(%)]
2.2 GDM的Logistic回归模型多因素分析
以是否患妊娠期糖尿病为因变量,是否Hp感染、孕妇孕前年龄、孕周、是否吸烟、BMI等为自变量构建Logistic回归模型,筛选妊娠期糖尿病的独立影响因素。年龄31~35岁、36~40岁、孕前BMI 24~27.9 kg/m2、孕前BMI≥28 kg/m2、Hp感染为GDM的危险因素(OR调整后=1.54,95%CI=1.19~3.32,P<0.001;OR调整后=2.17,95%CI=1.24~3.88,P<0.001;OR调整后=2.11,95%CI=1.33~4.12,P<0.001;OR调整后=2.76,95%CI=1.78~5.32,P<0.001;OR调整后=2.62,95%CI=1.67~3.95,P=0.005)。Logistic(P)=1.98+1.082×年龄+1.012×孕前BMI-1.347×幽门螺杆菌感染。
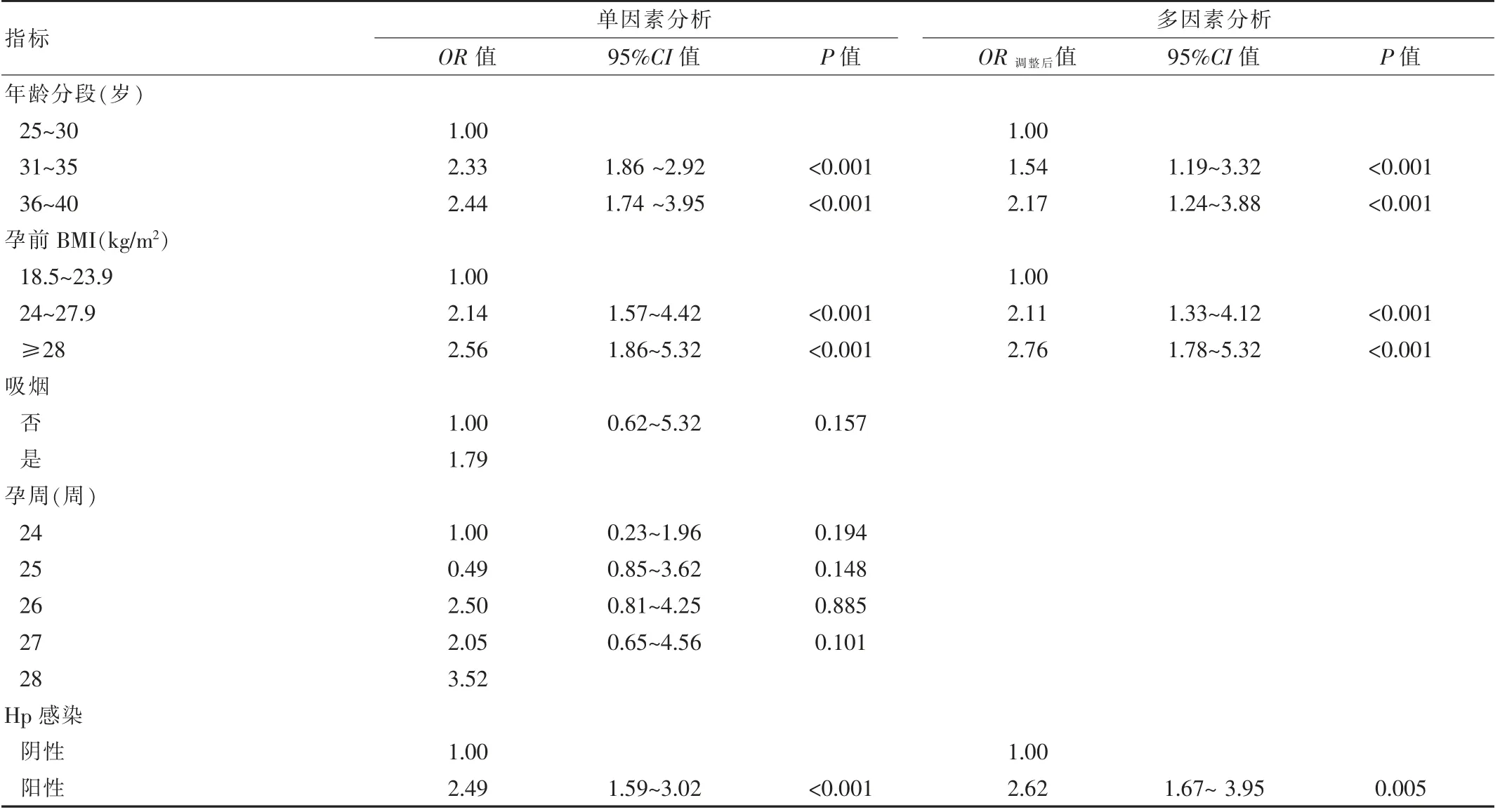
表2 GDM的Logistic回归模型多因素分析
3 讨论
革兰阴性杆菌Hp是慢性胃部感染的主要原因[4]。据估计,世界人口的50%感染了Hp,发展中国家的患病率更高。Hp不仅被认为是致病菌,而且还是一种致癌物[10]。虽然大多数感染Hp的患者倾向于发展为慢性胃炎,但其中一些会发展为胃和十二指肠溃疡、萎缩性胃炎、黏膜相关淋巴组织淋巴瘤、肠化生和胃癌。许多报告已经观察到Hp与心血管疾病和代谢综合征之间的关联。此外,Hp感染也与通过脂多糖激活的toll样受体间接相关,导致代谢变化,最终导致胰岛素抵抗。有文献描述了GDM和Hp之间的密切联系[11-13]。DIP的发生率为7%,其中GDM占DIP病例的86%,由于孕前和孕期血糖控制不佳,GDM可显著增加不良妊娠结局的风险,如流产、死产、早产、低出生体质量、巨大儿和新生儿死亡[14-15]。因此,它在世界范围内成了严重的公共卫生问题。基于此,该研究重点分析对患有GDM的孕妇进行幽门螺杆菌的检测,构建Logistic回归模型来筛选妊娠期糖尿病的独立影响因素,进一步明确GDM与幽门螺杆菌感染的关系。
该研究的主要发现是GDM与Hp感染阳性之间的关联,其中GDM组更有可能是Hp感染阳性。有许多文献也报道了Hp感染与糖尿病之间存在关联。卡达罗波利等人在2 820名孕妇中发现GDM与Hp之间存在很强的关联[16]。一个超过30 000人的大型中国队列显示,中年人中Hp感染与2型糖尿病之间的关联增加[17]。Bonfigli等[18]证明消除Hp感染改善了2型糖尿病患者的葡萄糖代谢。另一方面,许多研究人员报告了Hp感染与胰岛素抵抗之间的关联[17-19]。Hp感染与胰岛素抵抗之间的关联可以通过一些生物学机制来解释。首先,葡萄糖代谢的变化可能会导致胃黏膜发生化学变化,从而有助于检测Hp感染[19]。第二种解释是影响Hp胃部感染的促炎细胞因子水平增加,导致胰岛素受体的结构改变,抑制它们与胰岛素的相互作用[20]。同时,对小鼠的研究中表明,Hp和肠道微生物群之间存在相互作用,导致胰岛素抵抗增加。另外几个因素如孕前年龄、孕前BMI、幽门螺杆菌感染比较,差异有统计学意义(P<0.05),说明妊娠期糖尿病与以上几个因素存在一定联系。在Logistic回归模型中,证实孕前年龄、孕前BMI、幽门螺杆菌感染是妊娠期糖尿病的独立危险因素。此结论与以往文献中得到的结论一致,年龄和BMI与GDM的关系有多个文献已有报道[21-22]。
该研究也存在一定的局限性:①该研究观察的GDM病例相对教授;②该市区经济落后,居民可支配收入少,社保基金有限,部分患者未加入课题,无法延续治疗;③患者随访时间不够长,并未追踪GDM患者后续情况。
综上所述,孕前年龄、孕前BMI、幽门螺杆菌感染是妊娠期糖尿病的独立高危因素。年龄增加、孕前BMI、幽门螺杆菌感染会导致妊娠期糖尿病发生率增加。

