遗传性甲状腺髓样癌病人RET基因型与疾病表型的关系
张 刚, 张 哲, 张 姝, 李治荣, 田武国, 黄 琦, 汪玲俐, 徐 琰
(中国人民解放军陆军军医大学陆军特色医学中心(大坪医院)乳腺甲状腺外科,重庆 400042)
甲状腺髓样癌(medullary thyroid cancer,MTC)是甲状腺滤泡旁细胞或C细胞的神经内分泌肿瘤,是所有甲状腺癌中第3常见肿瘤。根据遗传特征,可将MTC分为遗传性甲状腺髓样癌(hereditary medullary thyroid carcinoma,HMTC) 和 散 发 性MTC[1]。根据临床表现,约25%MTC出现在由RET原癌基因胚系突变引起的家族性多发性内分泌肿瘤 2 型(multiple endocrine neoplasia type 2,MEN2)综合征中[1]。以常染色体显性遗传方式传播至下一代,MTC的外显率接近100%[1]。但MEN2的其他表现,如甲状旁腺功能亢进症或嗜铬细胞瘤的具体模式,存在家族间和家族内的差异。过去仅无甲状旁腺功能亢进或嗜铬细胞瘤的MTC被认为是一种独立的疾病,即家族性MTC(familial medullary thyroid carcinoma,FMTC),但现在被认为是MEN2A的一种变体[1]。MEN2B是罕见的最具侵袭性的MEN2综合征,100%合并MTC,50%合并甲状腺嗜铬细胞瘤[1-2]。目前研究表明,HMTC存在基因型-表型相关性[3-4]。HMTC病人的侵袭性与RET原癌基因突变风险等级直接相关[1]。也有研究指出,在家族内或不同家族间同一类型的RET原癌基因突变的临床表现可能不一致[4-5]。因此,探讨HMTC在不同地域和种族中的差别成为必要[6]。本研究旨在探讨中国西南地区HMTC病人不同风险等级RET基因型与疾病表型以及预后关系。
资料和方法
一、临床资料
在我院诊断为HMTC的13例病人纳入本研究。病人于2015年3月至2019年9月行手术治疗。采用Sanger测序方法行外周血RET基因突变分析。术前签署知情同意书并收集病人围术期的临床病理资料、血清降钙素(calcitonin,CT)和癌胚抗原(carcinoembryonic antigen,CEA)生化检测资料、影像学检查资料和随访信息。MTC采用第8版美国癌症联合委员会 (American Joint Committee on Cancer,AJCC)的TNM分期系统。
二、RET基因突变风险分类
按照美国甲状腺协会(American Thyroid Association,ATA)发布的指南[7],可将 HMTC 病人的 RET基因突变分为最高风险组(M918T位点)、高风险组(C634S和C634Y位点)和中风险组(C618G、C611Y位点)。本研究发现1例属于ATA指南中RET原癌基因最高风险突变(M918T位点),6例高风险突变(C634Y和C634S位点),6例中风险突变(C618G和C611Y位点)。比较RET基因型与疾病表型之间的关系。
三、手术治疗和随访
术前诊断肾上腺嗜铬细胞瘤的病人先行腔镜嗜铬细胞瘤切除术,然后同时行MTC手术或择期甲状腺手术。甲状腺手术范围,病人至少行甲状腺全切除手术,淋巴结清扫范围至少行双侧颈部中央区淋巴结清扫术。如明确颈侧区淋巴结转移,行颈侧区淋巴结清扫术。所有病人术后随访评估包括临床检查、血清CT、CEA含量检查,必要时行颈部超声或其他影像学检查。
结 果
根据HMTC的临床表现和内分泌特征确认MEN2分型,其中MEN2A综合征7例,MEN2B综合征1例,FMTC(MEN2A变体)5例。13例围术期临床特征资料分析见表1。病人平均确诊年龄(39.5±13.2)岁,其中男4例,女9例。术前MTC平均最大径为(25.8±10.8)mm。从首诊症状看,有7例因颈部包块就诊,2例因体检发现CEA异常升高,4例因头痛、头晕症状。临床T分期为,T1a期2例,T1b期3例,T2期5例,T3期3例。MTC手术范围,1例因嗜铬细胞瘤术后行RET基因筛查发现RET C634S位点突变,门诊随访甲状腺彩超检查未见占位病变,血清CT含量轻度升高(28.5 ng/L)在美国Franciscan Ear,Nose&Throat Associcate-Tacome行预防性甲状腺全切除术。术后病理检查提示双侧甲状腺多发MTC,病灶直径1~4 mm。1例因术中冷冻病理检查无法明确病灶性质,行甲状腺全切除术。1例因局部晚期,采取姑息性甲状腺全切除术,术后筛查基因检测发现RET M918T位点突变。9例行甲状腺全切除术+双侧颈部中央区淋巴结清扫术。1例行甲状腺全切除术+双侧颈部中央区淋巴结清扫术+颈侧区淋巴结清扫术。本研究1例RET C611Y位点突变病人在重庆市一家医院2次手术后来我院行甲状腺残余腺体切除术+双侧中央区淋巴结清扫术。合并肾上腺处理情况:3例双侧肾上腺嗜铬细胞瘤切除术,4例单侧肾上腺嗜铬细胞瘤切除术,2例腹部CT检查发现单侧肾上腺内支增粗,目前随访中。无合并甲状旁腺腺瘤病人,1例术前甲状旁腺激素异常升高,切除1枚异常甲状旁腺,病理检查提示甲状旁腺增生。根据目前掌握的临床资料确诊MEN2A 7例,MEN2B 1例,FMTC 5例。术后并发症发生有10例一过性甲状旁腺功能减退,随访至今,2例永久性甲状旁腺功能减退。平均随访时间(55.0±15.7)(24.0~78.0)个月,1例RET C618G位点突变病人在随访期出现颈侧区淋巴结转移,再手术获得临床治愈,CT含量下降明显。随访中无死亡病人。

表1 围术期临床特征(n=13)
HMTC的基因型及其ATA风险分组分析见表2。

表2 HMTC的基因型队列及其ATA风险分组(n=13)
基于病人RET基因突变的ATA风险类别,病人的年龄以及手术方式、生化检测、TNM分期、生化治愈和临床治愈结果以及手术方式的对比分析见表3。最高风险组确诊时MTC临床分期为Ⅳ期,基础CT和CEA含量远高于其余两组。高风险组MTC临床TNM分期中,Ⅰ期4例,Ⅲ期2例。中风险组Ⅰ期1例,Ⅱ期1例,Ⅲ期3例,Ⅳ期1例。高风险组平均年龄(40.5±17.2)岁,中风险组(41.3±5.0)岁。高风险组术前血清基础CT含量(537.7 ng/L比1 221.4 ng/L)和血清CEA含量 (41.7 μg/L比62.3 μg/L)的平均值低于中风险组。高风险组生化治愈率(83.3%比33.3%)和临床治愈率(83.3%比67.7%)优于中风险组。
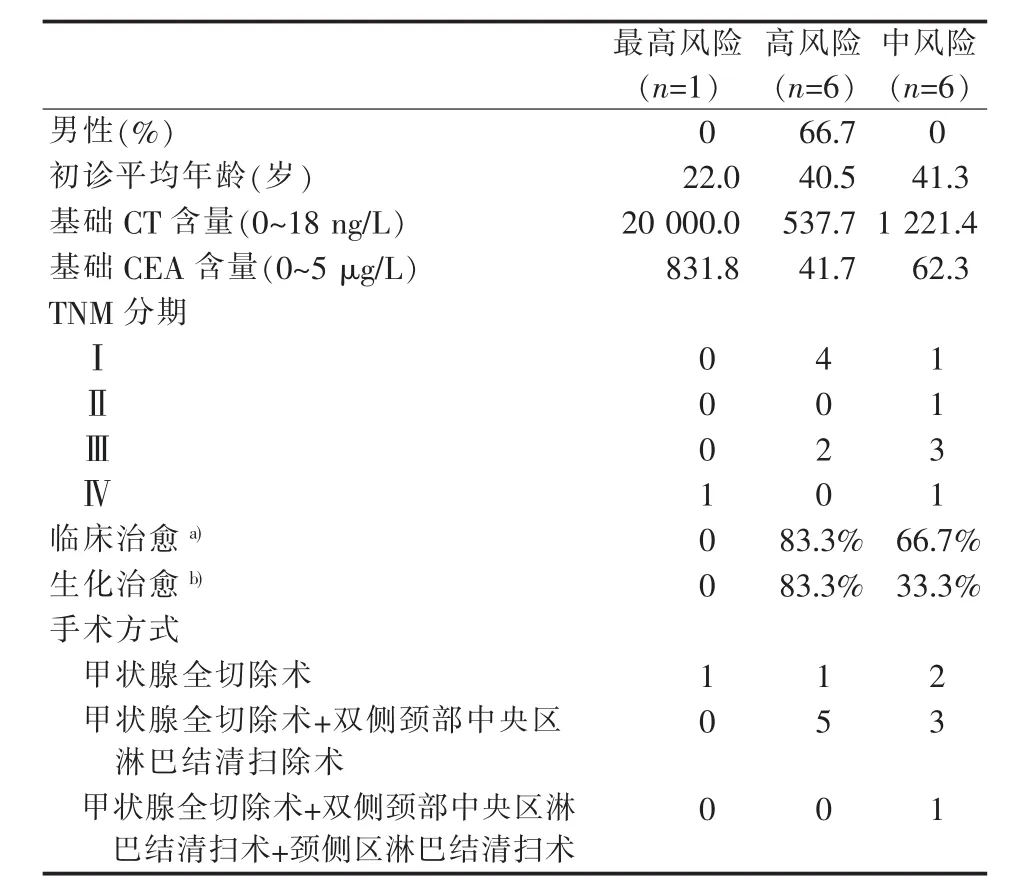
表3 基于RET基因突变的ATA风险类别病人对比分析
13例包含在10个家系中,开展家系调查,其基因表型与疾病表型汇总见表4。无诊断甲状旁腺功能亢进病人。调查时发现10个家系中另有6例,其中5例无病RET基因突变携带,1例携带RET基因突变已发病未行MTC手术。其中M918T位点突变携带1例(基因检测时7岁,目前10岁),C611Y位点突变携带 2例 (目前分别为22岁、25岁),C634Y位点突变携带1例(目前8岁),C634S位点突变携带2例(目前分别为25岁、69岁)。69岁病人携带RET C634S位点突变已行嗜铬细胞瘤手术,查血清CT含量1 019.0 ng/L,告知病情,但病人拒绝甲状腺手术治疗。其余4例应行预防性甲状腺切除术,1例应行治疗性甲状腺手术。由于病人和其监护人不同意手术治疗,目前随访中。

表4 家系调查情况汇总a)
讨 论
MEN2A病人常100%罹患MTC,50%左右肾上腺嗜铬细胞瘤,20%甲状旁腺功能亢进[7-8]。根据临床表现将MEN2A进一步分为经典型MEN2A、MEN2A合并皮肤苔藓淀粉样变、MEN2A合并先天性巨结肠、家族性非MEN性MTC[9-10]。笔者诊断的7例MEN2A病人,均罹患MTC。其中5例合并肾上腺嗜铬细胞瘤,2例合并肾上腺内支增粗,1例合并甲状旁腺增生,结合临床表现属于经典型MEN2A。
MEN2B病人有95%以上携带胚系RET M918T位点突变[11],病人均出现MTC[2],50%出现嗜铬细胞瘤[2]。大部分伴有多种额外内分泌特征,如马凡征外貌、眼部异常、骨骼畸形、黏膜神经瘤等[2,9]。研究报道,RET M918T位点胚系突变的病人仅患有MTC而未充分表现MEN2B的额外内分泌特征,作者进而根据临床表现建议修改该病人的突变等级为中风险突变[12]。有研究提到表现MEN2B的青少年并未出现马凡征外貌,进一步观察到MEN2B相关成年人和儿童的身体比例均与正常人一致[13]。笔者发现1例首诊年龄22岁的HMTC病人合并肾上腺嗜铬细胞瘤同时携带RET M918T位点胚系突变,符合MEN2B的诊断特点,但没有额外的内分泌特征。对额外的内分泌特征早期识别可提供早期诊断MEN2B的线索[2],原因之一也可能是该病人诊断年龄偏晚。
笔者发现的RET基因突变位点和临床表现的关系与报道相似。M918T突变常见于MEN2B,RET C634Y和C634S位点突变常见于MEN2A,嗜铬细胞瘤常见于C634Y和C634S位点突变,也可见于M918T 和 C611Y 位点[4,14]。
诊断MTC的病人,根据国内MTC专家共识,推荐行RET基因筛查[9]。RET基因检测结果可对MTC的生物学行为进行危险分层管理,也可对合并其他内分泌腺瘤的诊断提供早期线索[15]。进一步在家系内进行基因检测,可发现无病RET基因携带者,早期预防性甲状腺切除术可能获得100%的临床治愈[15]。HMTC比散发MTC可能有更良性的病程和更好的预后,部分原因是HMTC可通过RET分析及早发现并及早预防性手术[16]。进一步分析不同年龄、相同临床分期的散发MTC和HMTC的疾病特异生存期无差异[16]。确诊年龄低,尤其是在RET基因明确的情况下,对于指导预防性切除手术意义大。笔者在RET C634S位点突变的家系中,先证者因血压升高诊断嗜铬细胞瘤行手术治疗,术后完善RET基因筛查发现胚系C634S位点突变,进一步发现甲状腺占位,结合血清CT含量已可诊断MTC,但病人拒绝手术。进一步家系调查发现1例19岁无病RET基因携带者,门诊随访3年发现血清CT含量升高,建议病人行预防性切除术,因国内缺乏相应法律法规,后病人在美国求学期间行预防性甲状腺全切除术,回国后继续随访MTC维持临床生化治愈状态。ATA指南推荐可根据RET基因的危险分层来确定预防性切除手术时机。RET C634Y和C634S位点突变系高风险突变,建议在5岁前行预防性甲状腺全切除术[7]。国内对预防性甲状腺手术的接受率低。对无病RET基因携带者主张密切影像学检查及血清CT含量检测随访[9]。RET原癌基因测序结合术前CT含量检测有利于实施个体化的预防性甲状腺全切除,有利于MTC的早期诊治及监测随访[17]。通过家系调查发现5例无病RET基因携带者,目前采取积极随访血清CT含量和甲状腺彩超检查的策略,根据具体情况和病人意愿决定手术时机。
HMTC病人多因颈部包块就诊,常发现血清CT含量显著升高,提供诊断线索。还发现1例术前血清CT含量正常的HMTC[18]。术前也可能因血清CEA含量异常升高而无其他原因,作为临床发现MTC的首诊原因[19-20]。笔者发现1例血清测定CEA含量异常升高,提供线索后诊断的MTC[21]。笔者有2例因体检发现CEA含量异常升高就诊,进一步筛查PET-CT定位甲状腺病灶而确诊MTC。术前CEA含量>100 μg/L,可提示颈部淋巴结受累或远处转移[22]。 笔者有 4例术前 CEA 含量>100 μg/L,均发现颈部淋巴结转移。术前CEA含量≤100 μg/L时,本研究HMTC病人也有4例合并颈部淋巴结转移。嗜铬细胞瘤常因其临床症状重,而更早诊断和治疗嗜铬细胞瘤[23]。本研究7例(53.8%)诊断嗜铬细胞瘤并行手术治疗。在实施MTC病人手术时,有研究报道不同MTC手术量的术者来实施甲状腺手术方案对MTC病人的预后产生影响[24]。手术量大的术者能根据病情给予最佳治疗决策,复发风险更低[24],但病人的总生存时间无差异[24]。本研究8例由同一个手术团队完成,全部达到生化治愈和临床治愈。有经验的团队来实施HMTC病人的诊疗会更精准。HMTC的手术范围至少为甲状腺全切除术。对于术前影像学检查中央区淋巴结阴性的病人主张行中央区淋巴结预防性清扫术[9]。笔者对于术前明确诊断高度怀疑MTC的病人均采取甲状腺全切除术+双侧颈部中央区淋巴结清扫术。对于术后病理检查证实为MTC的病人,根据血清CT含量及影像学检查评估决定是否补充手术扩大范围。由于手术范围的原因,发现一过性甲状腺旁腺功能减退10例(71.2%),永久性甲状旁腺功能减退2例(15.4%),发生率高于分化型甲状腺癌甲状腺全切除甲状旁腺功能减退[25]。当然与本研究的样本量较小有关,但提示需充分关注HMTC手术中甲状旁腺功能减退的风险。随访中位时间为55个月,无死亡病例,可能与随访时间短有关。MTC术后复发可手术病人,再手术切除仍是其主要治疗方法[9],有1例复发,再手术获得临床治愈。
传统观念认为,HMTC的RET基因型与疾病的侵袭性密切相关[26],进一步显示高风险组的侵袭性显著高于中风险组。研究发现,高风险突变病人初诊时临床分期明显偏晚[26]。ATA指南根据RET基因突变的类型来判断HMTC的侵袭性风险,分为最高风险、高风险和中风险等级[7]。该分类方法不能完全反映MTC的生物学行为。高风险和中风险RET突变的病人在MTC诊断后的总生存期和疾病进展转移期相似。疾病诊治策略应考虑RET突变分类的疾病发作早期与晚期,不仅仅是RET风险等级[5]。研究显示,ATA指南关于RET突变风险分级标准不足以精准预测生化治愈率和临床治愈率,尤其是高风险组和中风险组[6]。该研究报道,在中位随访48个月后发现ATA中风险组和高风险组的临床治愈率明显高于最高风险组,差异有统计学意义(P=0.04)[6]。年龄和性别在3组间差异无统计学意义[6]。本研究不同基因型的HMTC病人中位年龄不同于国外报道[5,27],可能在不同国家地区发病年龄存在差异。RET基因突变最高风险组年龄比其他两组明显年轻,高风险组与中风险组年龄相似,但3组间差异无统计学意义。本研究发现,最高风险组的术前血清CT和CEA含量显著高于高风险组和中风险组,高风险组和中风险组的生化治愈率和临床治愈率远高于最高风险组,结果与相关研究类似[6]。高风险组的术前血清CT和CEA含量低于中风险组,相应的生化治愈率和临床治愈率高于中风险组,这与高风险组病人临床分期较早有关,也与确诊年龄年轻相关。这提示不应仅根据RET基因突变等级来确认HMTC的侵袭性,要综合考虑病人初诊的临床分期和年龄。
本研究样本量较小,限制深入分析。但从目前数据的初步分析,单凭HMTC的RET基因型不能准确预测疾病表型的生化治愈率和临床治愈率,尤其在RET基因高风险组和中风险组。分析认为,更早确诊和更早临床分期,HMTC的RET基因高风险等级突变病人可获得比中风险等级突变病人更好的生化治愈率和临床治愈率。

