用于白蚁防治的联苯菊酯微胶囊的制备及性能研究
马英剑,孙金诺,钱 坤*,徐 维,吕 培,冯建国*
(1.扬州大学园艺与植物保护学院,江苏扬州 225009;2.安徽农业大学资源与环境学院,合肥230036)
白蚁,属节肢动物门昆虫纲蜚蠊目,喜群居,生存能力强,会对人类生产和生活造成重要危害(权永兵等,2012)。白蚁蛀食多种大田作物、果树林木和花卉种苗,造成减产乃至绝产。 破坏或损坏建筑物承重点,造成房屋突然倒塌,危害人类生命财产安全。 古往今来,素有“千里之堤,溃于蚁穴”之说,雨水充沛季节,大坝承受能力因白蚁蛀蚀而大幅减弱,容易造成决堤现象,给人们带来巨大的灾难。
联苯菊酯以触杀和胃毒作用为主,是目前重要的白蚁防治药剂之一(李新, 2016)。然而,其主要加工剂型是水乳剂、悬浮剂以及微囊悬浮剂,这些剂型都属于热力学不稳定体系,生产和贮存过程中容易出现奥氏熟化、分层和沉淀等物理不稳定问题,严重影响使用效果,且持效期短(史雅丽等, 2016; 华乃震, 2019)。此外,联苯菊酯属于中等毒性杀虫剂,传统剂型难以避免药剂与人畜直接接触,容易发生中毒现象(Sapkotaetal., 2020)。
微胶囊通过壁材对活性成分进行包覆而获得均匀的粉状制剂,直接使用或者现场兑水稀释使用,可以克服水乳剂和悬浮剂等物理稳定性差的不足。此外,微胶囊能够延长持效期,减少施药量和施药次数,既可以降低防治成本,又可以避免人畜中毒,符合未来农药剂型的发展方向(Liuetal., 2016; 闫晓静等, 2019)。
本文在考察各工艺参数对微胶囊理化性能影响的基础上,获得了溶剂蒸发法制备联苯菊酯微胶囊的优化配方,并对微胶囊相关理化性能进行表征,同时测试了微胶囊的生物活性和持效性,旨在为白蚁防治提供高效、安全的防治药剂。
1 材料与方法
1.1 试剂与仪器
原药:96%联苯菊酯,扬农化工股份有限公司;乳化剂:Tween-80,壁材:乙基纤维素(粘度为40~100 mPa·s),溶剂:二氯甲烷,均为分析纯,国药集团化学试剂北京有限公司;25 g/L联苯菊酯乳油,山东百农思达生物科技有限公司;自制去离子水。
供试仪器:BSA型电子天平,赛多利斯科学仪器(北京)有限公司;BT9300R激光粒度仪,丹东百特科技有限公司;S-4800冷场发射扫描电子显微镜,日本日立有限公司;FA25高剪切分散乳化机,上海弗鲁克流体机械制造有限公司;RE-501型旋转蒸发仪,巩义市瑞德仪器设备有限公司;循环水式多用真空泵,上海大颜仪器设备有限公司。
供试试虫:台湾乳白蚁CoptotermesformosanusShiraki采自江苏扬州,在实验室内以松木板饲养(27℃±1℃, RH 65%±5%, L ∶D=0 h ∶24 h)。试验时挑取个体大小一致、活力较好的台湾乳白蚁工蚁。
1.2 微胶囊制备
1)称取0.4 g联苯菊酯原药溶于15 g二氯甲烷中,待原药完全溶解后,在该溶液中加入0.6 g乙基纤维素,搅拌至完全溶解,得到透明溶液C。
2)称取2.5 g Tween-80乳化剂溶解于去离子水,制成透明溶液D。
3)将透明溶液C和透明溶液D混合后经高剪切(12 000 r/min)得到O/W乳状液。
4)将步骤3)所得乳状液通过旋转蒸发仪去除其中的二氯甲烷,得到联苯菊酯微胶囊的悬浮液。
5)将步骤4)得到的微胶囊悬浮液进行离心(8 000 r/min, 15 min)、使用去离子水洗涤3次后进行冷冻干燥,即可获得联苯菊酯微胶囊。
1.3 粒径及跨距测定
将微胶囊分散在适量去离子水中制成悬浮液,超声处理30 s后,在激光粒度仪上进行粒径和跨距测定,重复测定3次,取其平均值。其中,跨距大小是对样品粒径大小分布宽度的一种度量,跨距数值越小表示粒径分散度越集中。
(1)
式中:D10表示样品粒径分布中占10%所对应的粒径;D50表示样品粒径分布中占50%所对应的粒径;D90表示样品粒径分布中占90%所对应的粒径。
1.4 光学显微镜(OM)观察
取旋转蒸发后的微胶囊悬浮液滴于载玻片上,盖上盖玻片后在光学显微镜下观察其外观形貌。
1.5 扫描电镜(SEM)观察
将充分干燥的联苯菊酯微胶囊样品固定在样品台上,经真空干燥、喷金等操作后,置于扫描电镜下进行扫描观察。
1.6 红外光谱测定
将联苯菊酯、乙基纤维素、乙基纤维素/联苯菊酯混合物和联苯菊酯微胶囊的样品分别与溴化钾粉末混合后压片,使用红外光谱仪进行测定。
1.7 包封率和载药量测定
通过高效液相色谱测定微胶囊的包封率和载药量。色谱条件:Agilent SB-C18色谱柱(25 mm×4.6 mm×5 μm),检测波长:203 nm;柱温:25 ℃;流动相:V(乙腈) ∶ V(水)=80 ∶ 20;流速:1.0 mL/min,进样量:1 μL。最后按照公式(2)和(3)计算联苯菊酯微胶囊包封率及载药量。

(2)

(3)
1.8 微胶囊缓释性能测定
采用透析袋法测定(Fanetal., 2014)。以乙醇和水的混合溶液(体积比为1 ∶1)作为释放介质。分别称取相同质量的联苯菊酯原药和微胶囊于盛有3 mL释放介质的透析袋中,将袋口密封后置于装有30 mL释放介质的锥形瓶中,以200 r/min的转速振荡。分别于1、2、3、4、5、6、7、8、9、10和12 h时取缓释介质1 mL;12 h后每间隔12 h取缓释介质1 mL,每次取样后立即补充1 mL缓释介质。采用高效液相色谱法测定样品中联苯菊酯含量,最后绘制其累积释放标准曲线。
1.9 生物测定
1.9.1毒力测定
采用滤纸片-药膜法测定(邹文娟和尹红, 2009; 林雁等, 2014)。分别将市售联苯菊酯乳油与制备的微胶囊用去离子水配成25、50、100、200、400、800 mg/L的药液,移取1.2 mL该药液滴加在滤纸(Ф90 mm)上,自然晾干后放入到干净培养皿(Ф90 mm)内。滴加1 mL去离子水,投入30头工蚁,持续接触。每浓度重复3次,设空白对照,观察和记录白蚁的死亡虫数(死亡是指用钝器轻触其腹部,其身体所有部位均无反应),试验在27℃±1℃、黑暗条件下进行,注意保持滤纸湿润。
以药液浓度的对数值为自变量X,以24 h的白蚁平均死亡率的机率值为因变量Y,计算毒力回归方程,求出两种制剂的LC50值。
1.9.2持效性实验
取1.2 mL 800 mg/L联苯菊酯微胶囊药液滴于滤纸(Ф90 mm)上,待自然晾干后放入干净培养皿中,滴加1 mL去离子水保持湿润,放入30头工蚁,按上述实验条件在24 h后观察工蚁的死亡情况,计算死亡率。在15 d时清理前期放入的全部试虫,重新放入30头健康工蚁,按上述方法观察24 h后的死亡情况,计算死亡率。按同样方法,调查在30 d和45 d时放入工蚁24 h后的死亡率。以市售联苯菊酯乳油为对照药剂,设置空白对照,每组实验重复3次。
2 结果与分析
溶剂蒸发法制备微胶囊过程中,影响微胶囊理化性能的因素主要包括壁材用量、乳化剂用量和剪切时间(张省委等, 2019)。本实验依据外观形貌,平均粒径、包封率和载药量等对壁材用量、乳化剂用量和剪切时间等因素进行筛选,从而获得联苯菊酯微胶囊的优化配方。
2.1 不同因素对微胶囊粒径大小和外观形貌的影响
2.1.1芯壁比的影响
芯壁比是微胶囊配方中芯材和壁材的质量比,能够显著影响溶剂蒸发法制备微胶囊的粒径大小和外观形貌(王宁等, 2017)。实验中分别以芯壁比为1 ∶1、1 ∶1.25、1 ∶1.5、1 ∶1.75、1 ∶2制备微胶囊,考察芯壁比对微胶囊性能的影响。随着芯壁比从1 ∶1降低到1 ∶2,尺寸分布(跨距)保持相对恒定,微胶囊粒径从34.4 μm增加到192.6 μm(图1-A)。光学显微照片(图1-B)也显示出相同的规律,芯壁比较大,即壁材较少时,微胶囊粒径小,成球不均一。随着壁材用量增加,微胶囊粒径分布变均匀。当壁材用量过多时,囊壁厚度明显增加,粒径增大(李宏英等, 2019),然而,由于增加了分散相粘度,使微胶囊容易发生粘连。而芯壁比为1 ∶1.5时,微胶囊大小分布较均匀,外观形貌较好,未出现破碎和粘连情况,因此,芯壁比的选择为1 ∶1.5。
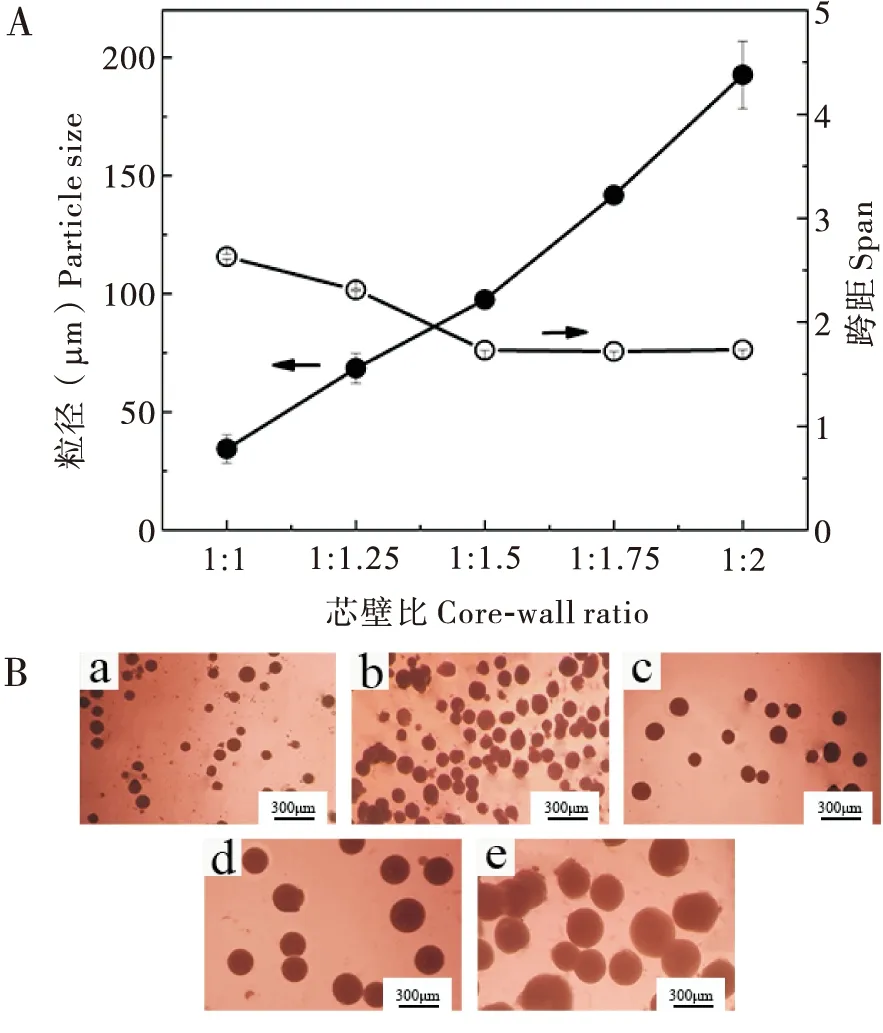
图1 芯壁比对微胶囊粒径大小(A)和外观形貌(B)的影响Fig.1 Influence of core wall ratio on microcapsule particle size (A) and appearance morphology (B)注:a,芯壁比为1 ∶1;b,芯壁比为1 ∶1.25;c,芯壁比为1 ∶1.5;d,芯壁比为1 ∶1.75;e,芯壁比为1 ∶2。Note: a, core-wall ratio of 1 ∶1; b, core-wall ratio of 1 ∶1.25; c, core-wall ratio of 1 ∶1.5; d, core-wall ratio of 1 ∶1.75; e, core-wall ratio of 1 ∶2.
2.1.2乳化剂用量的影响
乳化剂用量通过影响溶剂蒸发法中乳状液液滴大小及稳定而影响微胶囊的粒径大小及外观形貌(熊记等, 2018)。实验中以3%、5%、7%的用量制备微胶囊,通过测量粒径大小以及微胶囊外观形貌来确定乳化剂的最佳用量。随着Tween-80用量从3%增加到7%时,微胶囊平均粒径从235 μm减小到97.6 μm,跨距从1.90减小到1.73(图2-A)。图2-B结果表明,乳化剂用量较低(3%)时,微胶囊粒径较大,容易粘连,部分微胶囊出现破损,当乳化剂用量增大到7%时,微胶囊呈规则球形,表面光滑,平均粒径最小,且分布较窄,这与粒径测定结果一致。原因可能是乳化剂用量较少时,乳化剂分子无法完全覆盖液滴表面,容易出现液滴合并变大以及相互粘连的现象,而用量较多时有利于乳化剂分子在油水界面形成致密吸附,从而保证液滴均匀分散,获得粒径更小的微胶囊(王安琪等, 2018)。因此,最佳乳化剂用量为7%。
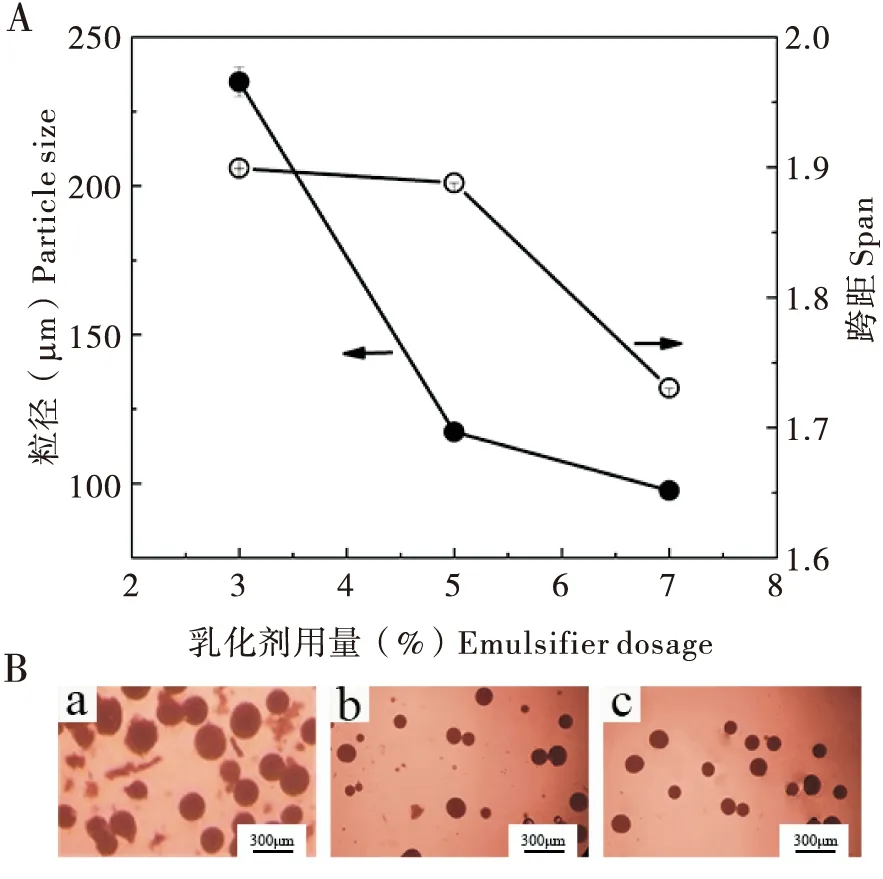
图2 乳化剂用量对微胶囊粒径大小(A)和外观形貌(B)的影响Fig.2 Influence of emulsifier dosage on microcapsule particle size (A) and appearance morphology (B)注:a,乳化剂用量为3%;b,乳化剂用量为5%;c,乳化剂用量为7%。Note: a, emulsifier dosage of 3%; b, emulsifier dosage of 5%; c, emulsifier dosage of 7%.
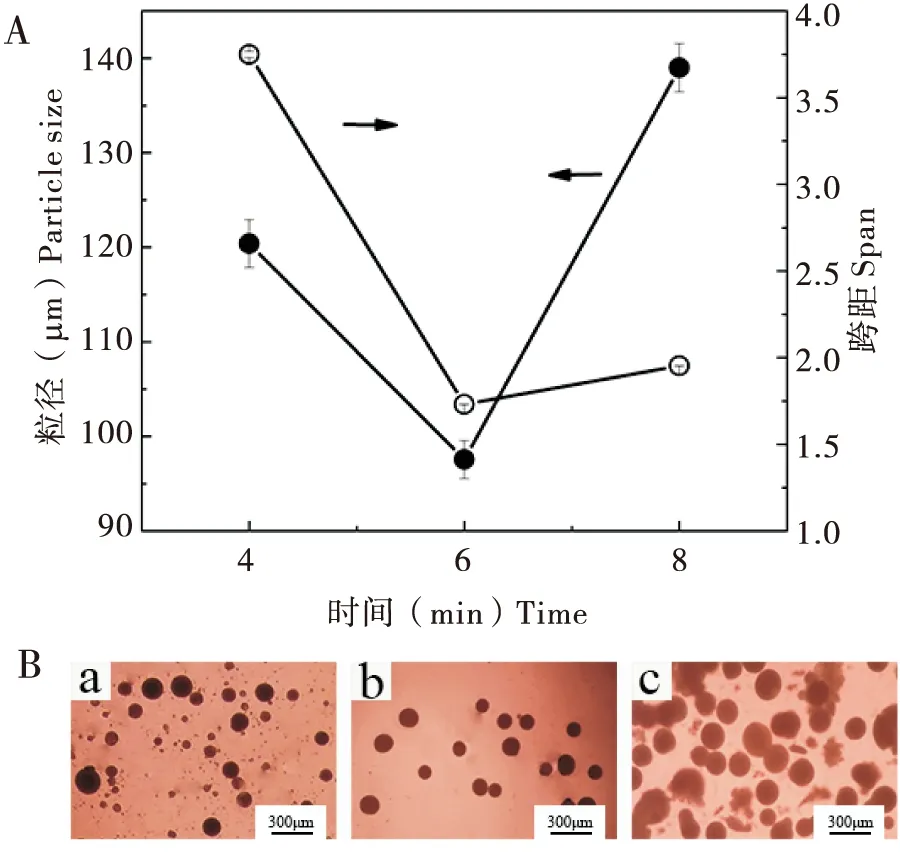
图3 剪切时间对微胶囊粒径大小(A)和外观形貌(B)的影响Fig.3 Influence of shear time on microcapsule particle size (A) and appearance morphology (B)注:a,剪切时间为4 min;b,剪切时间为6 min;c,剪切时间为8 min。Note: a, shear time of 4 min; b, shear time of 6 min; c, shear time of 8 min.
2.1.3剪切时间对微胶囊的影响
剪切时间是影响乳状液形成及稳定的重要因素,而乳状液的稳定又与微胶囊粒径大小及外观形貌密切相关(梁井瑞等, 2019)。实验中将剪切速率固定为12 000 r/min,对剪切时间进行筛选。图3-A是固定转速(12000 r/min)下,剪切时间对微胶囊粒径大小及跨距的影响。随着剪切时间增加,粒径和跨距均是先减小后增大。光学显微照片(图3-B)可以显示出,乳化时间为4 min时,形成的液滴数量少,且粒径较大;乳化时间为8 min时,微胶囊出现破裂现象。而乳化时间为6 min时,微胶囊大小均匀,外观呈规则球形,这也与粒径测定结果相吻合。刘润峰等(2016)在制备毒死蜱微胶囊发现相同的规律。原因可能是剪切时间太短,无法在剪切过程中提供足够的能量以便形成较小的液滴。相反,剪切时间过长会使溶剂过量挥发而造成表面未固化的微胶囊相互聚结变大,也会使部分微胶囊破碎而出现乙基纤维素碎片,导致微胶囊粒径增大。因此,确定剪切时间为6 min。
2.2 不同因素对包封率和载药量的影响
包封率和载药量是微胶囊性能的关键质量指标,对评价微胶囊制备方法优劣具有重要参考价值(龚圣等, 2018)。实验中分别设置了不同芯壁比(样品1~5),不同乳化剂用量(样品3、6、7)和不同剪切时间(样品3、8、9)制备微胶囊,考察以上因素对包封率和载药量的影响。表1是采用不同工艺制备的联苯菊酯微胶囊的包封率和载药量。随着芯壁比减小(样品1~5),包封率逐渐增大,载药量逐渐减少。这可能是由于芯壁比较大时,壁材少,芯材不能被完全包覆,同时芯材浓度高时,容易向水相扩散,导致包封率降低(韦佩彪等, 2020)。当乳化剂用量从3%增加到7%时(样品3、6、7),包封率和载药量均增大,这是由于乳化剂用量较低时,液滴周围界面膜强度低,溶剂挥发过程中,微胶囊容易破裂,芯材外漏,包封率和载药量降低(杨斌等, 2018)。随着乳化剂用量增大,液滴周围界面膜强度增加,避免了芯材流失,从而使微胶囊具有更高的包封率和载药量。当剪切时间不同时(样品3、8、9),微胶囊的包封率和载药量不同,随着剪切时间增加,液滴可以更好分散在介质中,同时加快二氯甲烷挥发,减少芯材向水相扩散,所以包封率和载药量增加。但当剪切时间过长(8 min)时,微胶囊容易出现破损,造成芯材流失,从而导致包封率和载药量减少(张微等, 2017)。
综合粒径大小、外观形貌以及包封率和载药量的测定结果,芯壁比为1 ∶1.5,乳化剂用量为7%,剪切时间为6 min时,获得的微胶囊形状大小均匀,无破裂粘连现象,且具有较高包封率和载药量,为最佳制备工艺。
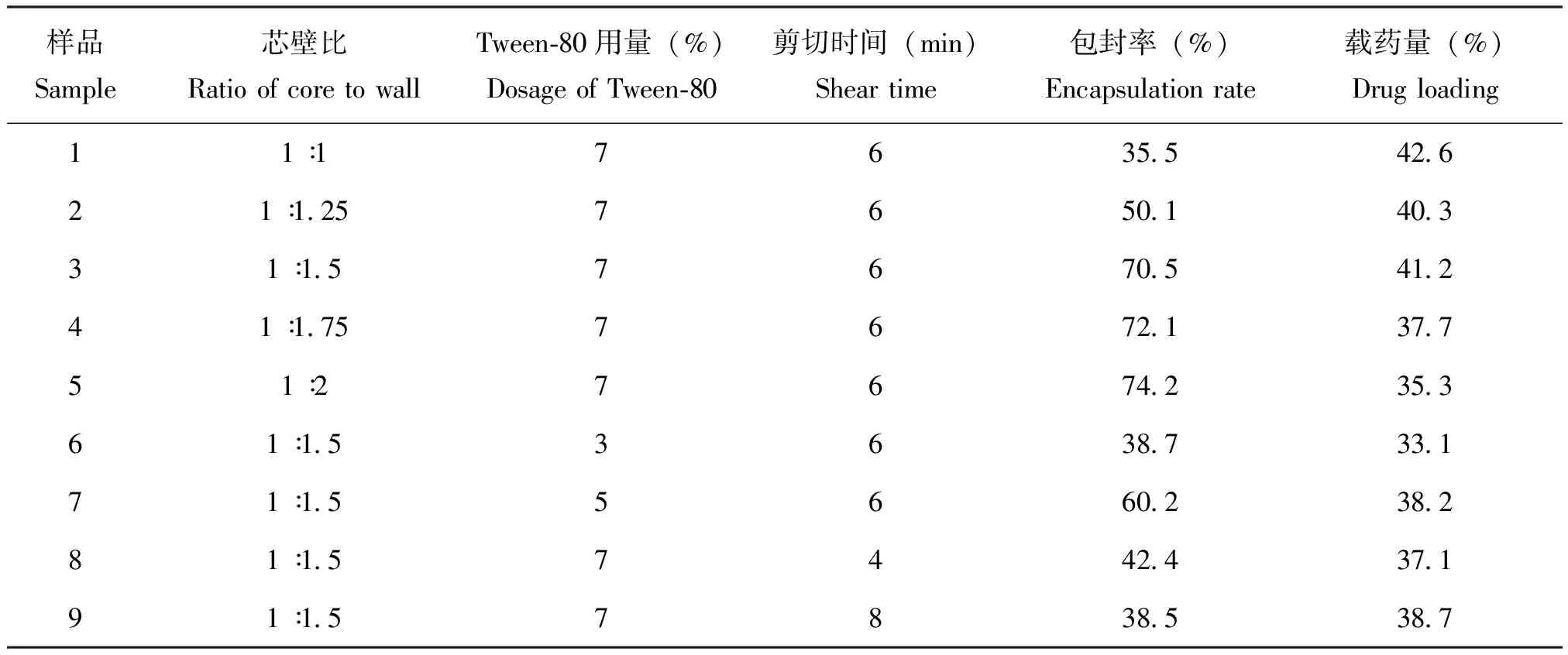
表1 不同工艺制备的联苯菊酯微胶囊的包封率和载药量
2.3 微胶囊的微观形貌
微胶囊表面的细微结构能够影响囊芯物的释放,是评价微胶囊理化性能的重要指标(冯建国等, 2011)。实验中通过SEM对最佳制备工艺获得的联苯菊酯微胶囊外观形貌进行观察,结果如图4所示。微胶囊形状规则,大小均匀,结构完整,这与光学显微镜下所观察的结果一致。进一步放大倍数观察(见图4-b),微胶囊表面无原药晶体吸附,且表面微孔较多,这有利于联苯菊酯的释放,从而获得更好的杀灭效果。
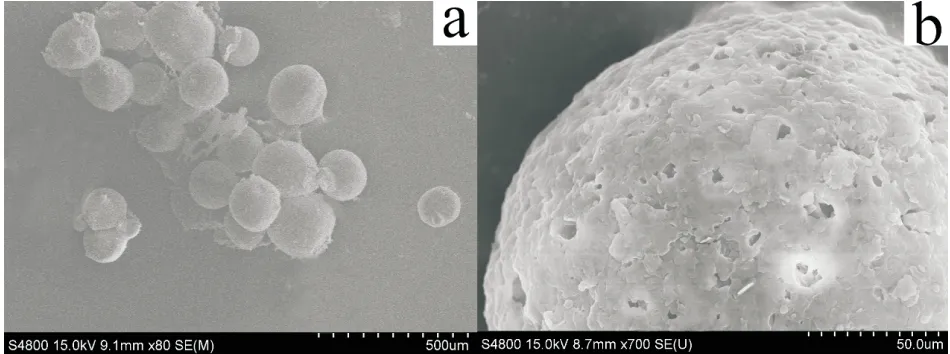
图4 联苯菊酯微胶囊的SEM照片Fig.4 SEM photographs of bifenthrin microcapsules
2.4 红外光谱分析

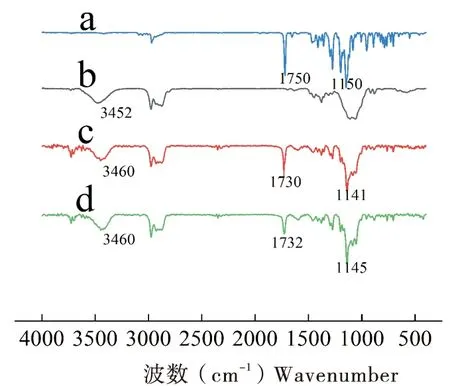
图5 样品的红外光谱图Fig.5 Infrared spectrogram of the samples注:a,联苯菊酯原药;b,乙基纤维素;c,联苯菊酯原药+乙基纤维素混合物;d,联苯菊酯微胶囊。Note: a, technical bifenthrin; b, ethyl cellulose; c, technical bifenthrin+ethyl cellulose mixture; d, microcapsule sample.
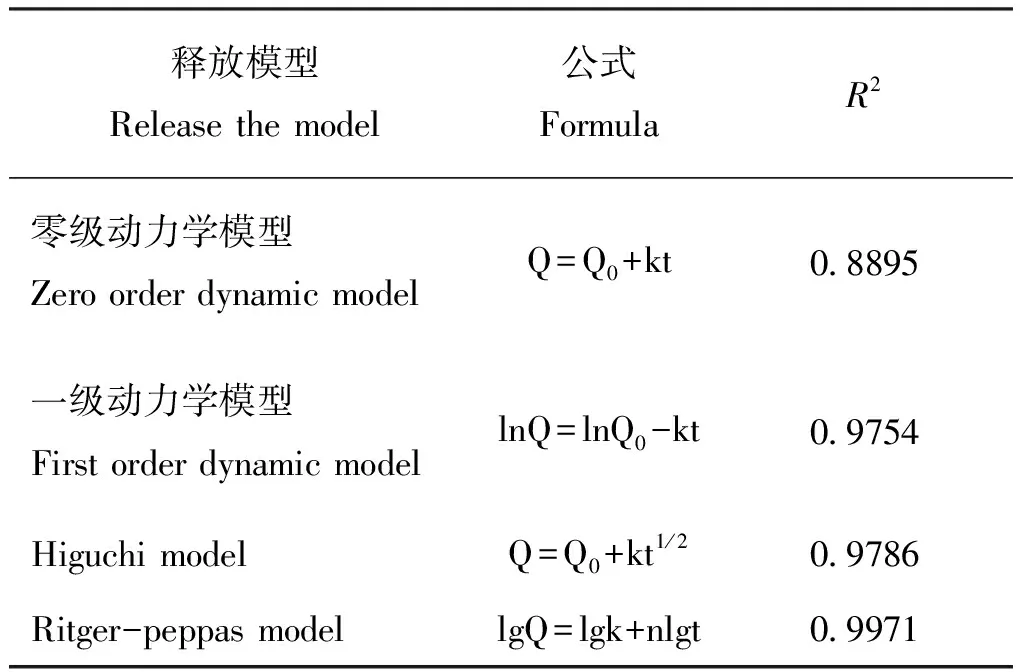
2.5 微胶囊释放性能
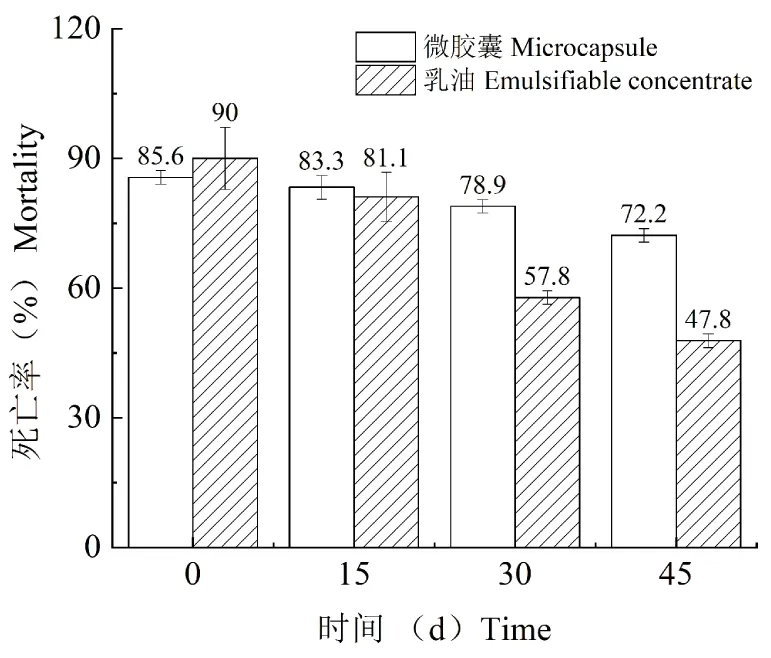
最佳制备工艺获得的联苯菊酯微胶囊和原药在释放介质(乙醇-水的体积比1 ∶1)中的累计释放曲线见图6。与原药相比,联苯菊酯微胶囊具有更好的缓释性能。进一步通过零级动力学模型、一级动力学模型、Higuchi模型和Ritger-peppas模型进行动力学模型拟合(见表2),结果表明:拟合程度最高的是Ritger-peppas模型(lgQ=lgk+nlgt),式中,Q为任意时刻药物的释放分数;k为动力学参数;t为释放时间;n为药物的扩散指数,n值大小代表药物不同的释放机制(冯建国等, 2017)。当n≤0.43时,主要为Fickian扩散;当0.43 图6 联苯菊酯微胶囊与原药在释放介质中的累积释放曲线Fig.6 Cumulative release curve of bifenthrin microcapsule and technical bifenthrin in release medium 表2 不同动力学模型拟合结果 2.6.1毒力测定 以市售的联苯菊酯乳油为对照,通过药膜法测定最佳制备工艺获得的联苯菊酯微胶囊对台湾乳白蚁的毒力。供试蚁与药膜连续接触24 h后,25 g/L联苯菊酯乳油对台湾乳白蚁的LC50为144.2 mg/L,联苯菊酯微胶囊的LC50为174.9 mg/L,两者对台湾乳白蚁的灭杀效果相当。运用LSD显著性差异分析,乳油与微胶囊无显著性差异(P>0.05)(表3)。 表3 联苯菊酯两种制剂对台湾乳白蚁触杀毒力的致死中浓度 2.6.2持效性实验 通过两种制剂对台湾乳白蚁的持效性实验结果来看(图7),施药后的0和15 d,二者的杀灭效果相差不多,但与乳油相比,微胶囊的持效期更长,施药后30 d在培养皿中重新放入白蚁,24 h后平均死亡率仍高达78.9%,显著高于对照乳油处理后的平均死亡率(57.8%)。施药后45 d后,乳油处理后的白蚁死亡率下降到50%以下,而微胶囊处理后的平均死亡率仍在70%以上。 图7 联苯菊酯两种制剂对台湾乳白蚁的持效性Fig.7 Long-lasting effect of bifenthrin formulations against Coptotermes formosanus Shiraki 白蚁是地球上最古老的社会性昆虫之一,在进化过程中获得了独特的生存和繁衍能力,几乎占领了热带、亚热带的各个角落,其危害面积约占世界陆地总面积的一半。我国也是白蚁危害严重的国家之一,其中40%陆地均有分布(林雁, 2015)。近年来,随着白蚁活动范围的不断扩大,其对人类生产和生活造成的危害明显加重。目前,白蚁防治方法主要包括物理防治、生物防治和化学防治等。综合考虑操作难度、用户体验、时间成本和防治效果等,化学防治仍是白蚁防治最有效的途径(刘晓燕和钟国华, 2019)。截止2020年8月,通过农业农村部登记的用于白蚁防治的杀虫剂品种主要包括联苯菊酯,吡虫啉,氟虫腈和毒死蜱等,其中,联苯菊酯是白蚁防治的主流药剂(张晓杰等, 2017),常规加工剂型为悬浮剂(25个),水乳剂(13个),乳油(12个),粉剂(7个)和饵剂(3个),但是在应用过程中容易出现产品物理稳定性差和持效期短等问题。此外,联苯菊酯潜在的生物富集效应对水生环境造成不可接受的风险,传统加工剂型也难以消除这些弊端。 微胶囊技术通过壁材对农药有效成分进行包覆,具有减少有效成分降解和挥发,缓慢释放,延长持续期,降低对非靶标生物毒性等优势,符合高效、低毒、持久、环保的白蚁预防理念(金占宝和赵兴华, 2012;朱艳燕, 2013)。尽管当前在白蚁防治中也有微囊悬浮剂产品登记使用,但是与常规剂型相比数量有限。此外,针对白蚁防治药剂微囊化的研究并不多,且主要集中于药效试验,缺乏微胶囊制备技术的深入研究,这在一定程度上限制了微囊化技术在白蚁防治中的推广使用。本文采用溶剂蒸发法成功制备了联苯菊酯微胶囊,与市售乳油制剂相比,两者对台湾乳白蚁的毒力相近,但微胶囊具有优异的持效性,为安全、高效防治白蚁提供了技术手段,也为农药微胶囊的制备技术提供了一定的理论参考。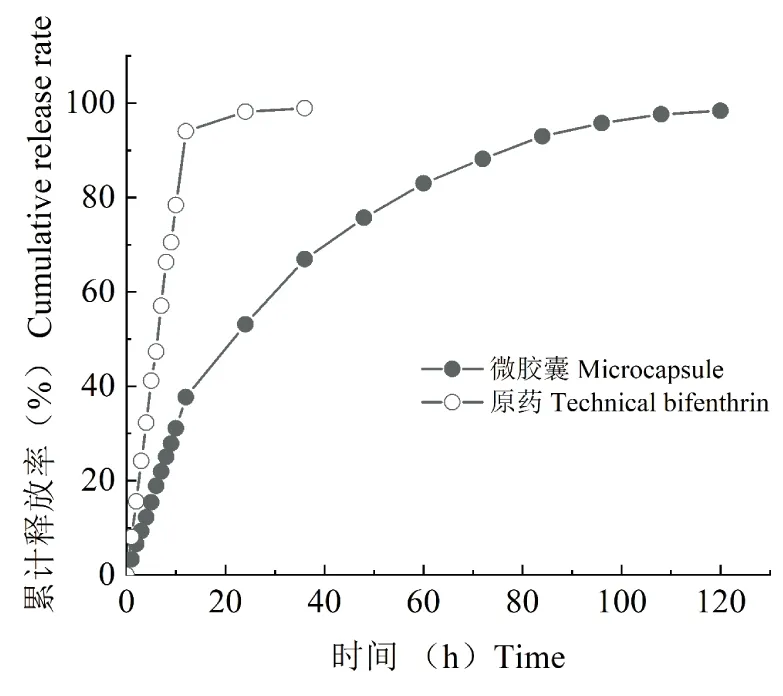
2.6 生物测定

3 结论与讨论

