代谢型谷氨酸受体5在中枢神经系统疾病中的研究进展
朱恩妮,吴超然,廖 红
(中国药科大学新药筛选中心 江苏省药效研究与评价服务中心,南京210009)
谷氨酸是大脑内重要的兴奋性氨基酸类神经递质,负责中枢神经系统近70% 的突触传递[1],其主要作用于两种受体:离子型谷氨酸受体(ionotropic GluRs,iGluRs)和代谢型谷氨酸受体(metabotropic GluRs,mGluRs)。iGluRs 是配体门控型离子通道,可快速诱发神经元兴奋;mGluRs属于C 类G 蛋白偶联受体(G protein-coupled receptors,GPCR)家族,可经由不同信号转导调控细胞生长增殖、突触可塑性、神经兴奋性等生命活动[2]。目前8 种mGluR 亚型被分为3 型,Ⅰ型mGluR(mGluR1 和mGluR5)与Gαq/11偶联,而Ⅱ型mGluR(mGluR2 和mGluR3)和Ⅲ型(mGluR4,mGluR6,mGluR7和GluR8)则与Gαi/o偶联[3]。
mGluR5作为脑内丰富表达的一种mGluRs,对于调控突触活动和维系神经网络稳定至关重要。近年来,越来越多研究者专注于探究mGluR5 与中枢神经系统疾病的联系以及针对该受体的药物在临床应用的可行性和有效性。
1 mGluR5结构与分布
mGluR5 具有典型的C 类GPCR 结构特征,以二聚体形式发挥作用,且每个单体含有一个较大的N 端胞外结构域。胞外结构域包含有能与L-谷氨酸、离子等结合的配体结合域(ligand-binding domain,LBD),形似捕蝇草叶片;LBD 由一段富含半胱氨酸的序列与7次跨膜结构域相连接[4]。C端胞内结构域可被剪切成不同末端,生成剪切体mGluR5a和mGluR5b[3]。
mGluR5 在人类和啮齿动物的大脑皮层、海马、嗅球、纹状体、丘脑等区域广泛分布[1],主要分布于突触后膜上,也存在于突触前膜、星形胶质细胞中[3]。mGluR5 与mGluR3 是星形胶质细胞主要表达的两种mGluRs,不同于mGluR3 在星形胶质细胞上的持续性表达,mGluR5 在小鼠大脑发育早期的星形胶质细胞中高表达,而在发育后期至成年阶段表达急剧下降[5]。研究发现,在癫痫、多发性硬化症等神经疾病中,反应性星形胶质细胞的mGluR5 表达会显著增加[6],这暗示星形胶质细胞mGluR5 可能也与神经系统疾病的发生发展密切相关,但其如何参与以及内在机制的相关研究迄今为止较少。
2 mGluR5功能
mGluR5优先偶联Gαq/11,通过启动经典信号通路来调控膜受体活性、基因转录、蛋白合成等细胞活动。配体与受体结合后,Gαq/11活化并激活磷脂酶C(phospholipase C,PLC),PLC 催化细胞膜上4,5- 二磷酸 磷脂 酰 肌醇(phosphatidylinositol-4,5-bisphosphate,PIP2)生成第二信使分子肌醇-1,4,5-三磷酸(inositol-1,4,5-triphosphate,IP3)和甘油二酯(1,2-diacylglycerol,DAG)。 IP3诱导 内质 网(endoplasmic reticulum,ER)Ca2+释放,增强胞内Ca2+信号,活化钙调蛋白(calmodulin,CaM)及其下游Ca2+/钙调蛋白依赖性激酶(calcium/calmodulindependent protein kinase II,CaMKII);而Ca2+与DAG协同激活蛋白激酶C(protein kinase C,PKC),PKC磷酸化下游多种靶蛋白酶[7],最终实现对细胞生命活动的调控(图1)。有研究报道,除偶联Gαq/11外,mGluR5 也可以通过招募β-arrestin 来调控突触可塑性[8]。
突触后膜上的mGluR5 可通过不同的分子机制调控iGluRα-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid receptor,AMPAR)内化,从而介导突触长时程抑制(long-term depression,LTD)[9]。突触后支架蛋白复合物Homer-Shank-GKAP-PSD95 介导mGluR5与iGluRN-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)的物理连接和相互作用[2];其中,Homer 蛋白长剪切体Homer1b/c 还将mGluR5 与ER 上的IP3受体相连,mGluR5 借此调控ER 的Ca2+释放[10]。当Homer 蛋白短剪切体Homer1a 竞争性取代Homer1b/c 连接mGluR5 时,便会阻断mGluR5 与IP3受体的相互作用,转而增强其他信号转导[11]。由Homer 介导,mGluR5 还参与调控下游磷脂酰肌醇3-激酶(phosphoinositide-3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycinm,TOR)信号转导、细胞外信号调节激酶(extracellular signal-regulated kinases,ERK1/2)激活等[12](图1)。
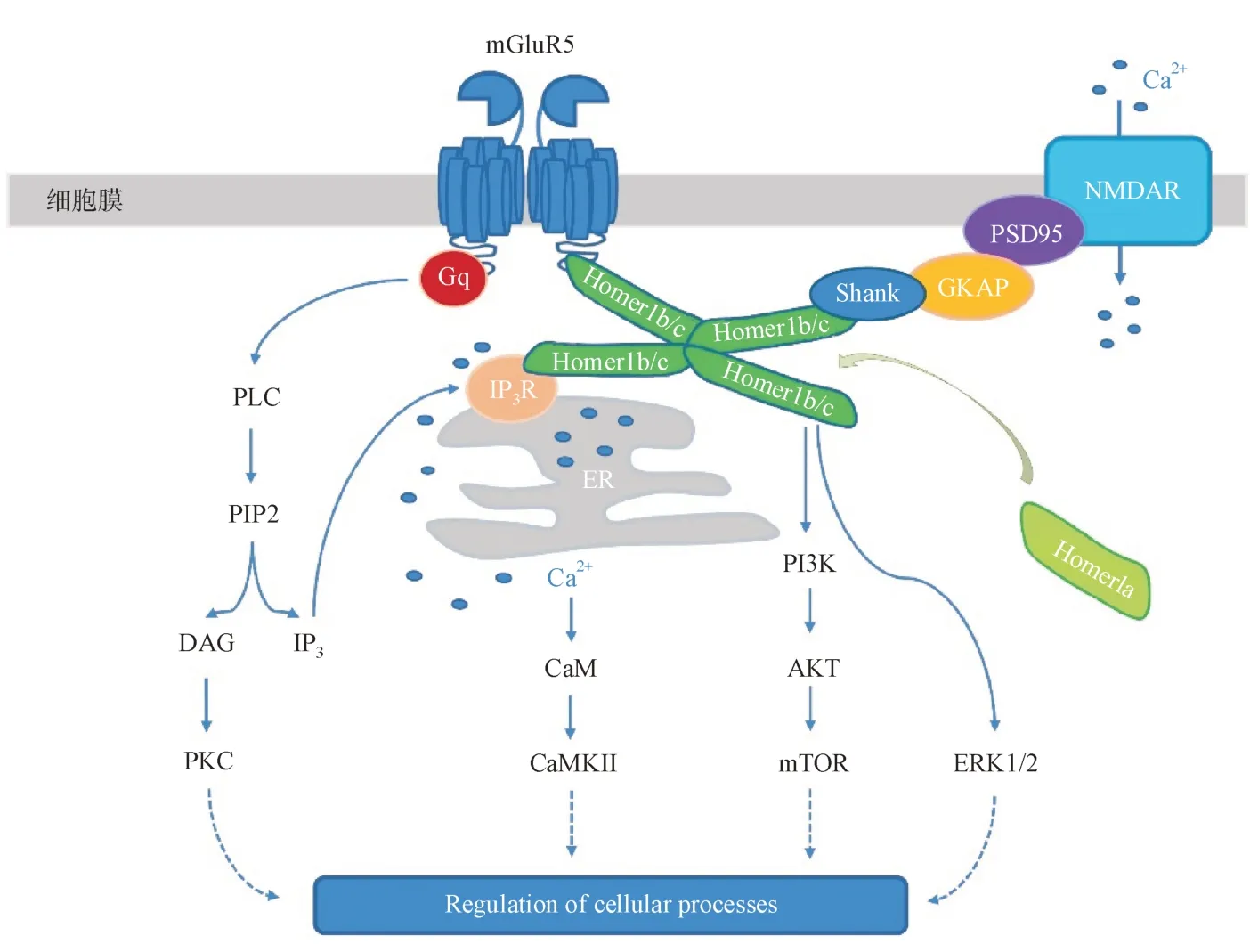
图1 mGluR5信号转导通路示意图mGluR5 偶联Gαq/11,启动下游经典双信号通路PLC/DAG/PKC 和PLC/IP3/Ca2+。mGluR5 与NMDAR 通过突触后支架蛋白复合物Homer-Shank-GKAP-PSD95 相连接;由Homer 介导,mGluR5 参与调控ER 的Ca2+ 释放、PI3K/AKT/mTOR 信号转导和ERK1/2 激活等。PLC:磷脂酶C; PIP2:4,5-二磷酸磷脂酰肌醇; DAG:甘油二酯; IP3:肌醇1,4,5-三磷酸; IP3R: IP3受体;PKC:蛋白激酶C; CaM:钙调蛋白; CaMKII:Ca2+/钙调蛋白依赖性激酶;PI3K: 磷脂酰肌醇3-激酶; AKT:蛋白激酶B; mTOR:哺乳动物雷帕霉素靶蛋白;ERK1/2: 细胞外信号调节激酶;ER:内质网
3 mGluR5与中枢神经系统疾病
中枢谷氨酸能系统失调是神经和精神疾病的常见病理机制之一。近年来,越来越多实验表明,mGluR5 及其调控的信号通路与神经发育障碍[13]、神经退行性疾病[12]、精神类疾病[14]、神经疼痛[15]、药物成瘾[1]等疾病的发生发展密切相关,多项研究支持mGluR5 可作为下列几种中枢神经系统疾病的潜在治疗靶标。
3.1 脆性X综合征(fragile X syndrome,FXS)
FXS 是一种X 染色体上脆性X 智力低下基因(fragile X mentalretardation gene 1,FMR1)启动子区域CCG 三核苷酸重复扩增引起FMR1沉默,导致其编码的脆性X 智力低下蛋白(fragile X mental retardation protein,FMRP)缺失的神经发育障碍疾病[16]。FMRP 作为一种RNA 结合蛋白,密切参与调控与神经元发育和突触功能相关的mRNA 的运输、稳定和局部翻译,也包括负调控mGluR5 介导的下 游翻 译过 程[17]。 FMRP 缺失 导致 的相 关mRNA 过度翻译被认为是FXS 中出现树突棘形态异常、突触功能损伤和认知障碍的主要原因[13]。最初是Huber 等[18]在Fmr1敲除(Fmr1knockout,Fmr1KO)小鼠上证实,mGluR5介导的蛋白过度合成导致了海马CA1 区突触LTD 异常增强。这一开创性发现奠基了FXS 中mGluR 信号通路过度活化的理论,使mGluR5 成为FXS 治疗中备受关注的药理靶标。
随着研究深入,PI3K 增强子(PI3K enhancer,PIKE)参与调控的mGluR5 下游PI3K/AKT/mTOR信号通路过度激活被确认在介导Fmr1KO 小鼠海马LTD 异常增强中发挥关键作用[19]。此外,有文献报道,当Fmr1KO 小鼠海马神经元上mGluR5-Homer 连接被破坏时,mGluR5 易在突触后膜上扩散,且间接影响NMDAR 功能,从而引起Fmr1KO小鼠认知功能障碍[20];选择性阻断mGluR5-Homer连接则会导致正常小鼠出现类似FXS 的表型[21]。而在星形胶质细胞中,FMRP 被发现可积极调控mGluR5 的表达和功能[22]。Men 等[23]的实验表明,FMRP 缺失会使人类和小鼠星形胶质细胞中微小RNA(microRNA,miRNA)miR-128-3p 水平升高,miR-128-3p 以转录后调节机制抑制发育时期星形胶质细胞mGluR5 的表达和功能,该研究为FMRP对mGluR5的调节方式提供了新视角。
尽管临床前实验结果显示,抑制mGluR5 功能或mGluR5基因缺失能改善Fmr1KO 小鼠的部分病理情况和行为障碍,但是针对mGluR5 的药物在FXS临床转化中尚未成功[16],这可能与FXS发病机制的复杂性和动物模型与人体间的差异性相关,未来仍有待进一步探索。
3.2 神经退行性疾病
阿尔兹海默病(Alzheimer′s disease,AD)是一种以胞外β-淀粉样蛋白(amyloid β-protein,Aβ)异常沉积形成斑块、胞内tau 蛋白过度磷酸化导致神经纤维纠缠、神经元进行性萎缩死亡为主要病理特征的神经退行性疾病。Aβ是由淀粉样前体蛋白(amyloid precursor protein,APP)水解得来,APP 在发育大脑的突触形成中起重要作用[24],而可溶性Aβ 寡聚体(Aβ oligomers,Aβo)是导致AD 中突触功能障碍和树突棘丢失的主要致病因素[25]。
一方面,FMRP 可以负调控突触中APP 的翻译,mGluR5 信号通路激活可以解除FMRP 对APP合成的抑制[26],因此mGluR5 信号过度激活可能导致APP 大量合成,为Aβ 的产生提供原料。另一方面,有研究发现mGluR5 和细胞型朊蛋白(cellular prion protein,PrPc)参与Aβ 介导的大鼠突触LTD增强[27];可溶性Aβo 易与神经细胞表面的PrPc 结合形成复合物,Aβo/PrPc/mGluR5 复合物可激活非受体酪氨酸激酶Fyn,Fyn 磷酸化突触NMDAR,从而影响突触功能和引起树突棘丢失[25]。由此可见,mGluR5 与AD 中突触功能障碍的病理机制密切相关。
研究发现,抑制mGluR5可以逆转AD模型APPswe/PS1ΔE9 小鼠和3xTg-AD 雄性小鼠的认知障碍,减少脑内Aβ 斑块沉积[28];Abd-Elrahman 等[29]的实验表明,抑制mGluR5 后下游糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)/ZBTB16/ATG14L和Akt /mTOR/p70S6K1信号通路激活所介导的自噬是AD 小鼠脑内Aβ 沉积减少的潜在分子机制。
除AD 外,mGluR5 也被报道具有作为治疗其他神经退行性疾病的药理靶标的潜能。临床前研究发现,激动或抑制mGluR5 可能通过不同分子机制改善亨廷顿病(Huntington disease,HD)小鼠模型的病理学特征[30-31]。在啮齿类和非人灵长类的帕金森病(Parkinson's disease,PD)相关动物模型中,抑制mGluR5 能减轻多巴胺神经元变性情况或改善左旋多巴(levodopa,L-DOPA)诱导的运动障碍(L-DOPA-induced-dyskinesia,LID)[32]。 而 在 肌萎缩性侧索硬化症(amyotrophic lateral sclerosis,ALS)SOD1G93A转基因小鼠模型中,敲除mGluR5基因能使SOD1G93A小鼠疾病延迟发作、生存期延长和运动功能改善[33]。综上,多项研究发现mGluR5 在各类神经退行性疾病中扮演重要角色,针对mGluR5 的调控可为神经退行性疾病的临床治疗提供新思路。
3.3 重度抑郁障碍(major depressive disorder,MDD)
MDD 是一种以显著而持续的情绪低落为主要特征的精神障碍,其高致残率、高自杀率的特点给患者家属和社会带来痛苦与负担。基于抑郁障碍中谷氨酸能系统亢进的假说,抑制mGluRs 可能是治疗MDD 的潜在方法[34]。临床前研究证实,抑制mGluR5 能改善慢性应激诱导的小鼠抑郁样行为[35],但针对mGluR5 的药物在MDD 临床试验中的疗效并不理想[36]。
临床尸检报告表明,MDD 患者前额叶皮层的mGluR5 蛋白表达量比正常人低[37];而一项正电子发射断层扫描(positron emission tomography,PET)人体成像结果却显示,MDD 患者和正常人脑内的mGluR5 与放射性示踪剂的结合率相比没有显著差异[38];另有动物实验表明,敲除mGluR5基因会诱导小鼠出现抑郁样行为[39]。不一致的研究结果提示了mGluR5 参与介导MDD 病理机制的复杂性。
临床上,睡眠剥夺是一种能快速缓解抑郁症状的物理方法。相关研究报道,抑郁患者进行33 h睡眠剥夺治疗后,通过PET 成像发现患者脑内结合放射性示踪剂的mGluR5 增加[40],提示睡眠剥夺的抗抑郁机制与mGluR5 功能增强有关。 Holz等[11]在小鼠抑郁模型中发现,神经元mGluR5/Homer1a/mTOR 信号通路激活所介导的AMPAR 表达增加和功能增强是睡眠剥夺治疗起快速抗抑郁作用的关键分子机制;而在mGluR5基因敲除小鼠中,睡眠剥夺治疗未能起到抗抑郁作用。氯胺酮是一种能快速、持久有效发挥抗抑郁作用的药物;基于临床前实验数据,Esterlis 等[36]认为氯胺酮的抗抑郁机制与mGluR5 调控的下游信号通路有潜在关联;但一项PET 结果显示,MDD 患者在给予氯胺酮治疗后,脑内mGluR5 表达降低[41],作者认为这可能是抑郁障碍中谷氨酸增加导致的代偿性mGluR5 表达下调,因此氯胺酮如何借由mGluR5发挥抗抑郁作用仍未可知。综上,确认mGluR5 在抗抑郁中扮演的角色,以及其能否成为抗抑郁的有效靶标还有待更深入的研究。
3.4 精神分裂症
精神分裂症是一种严重的精神疾病,其发生发展由遗传因素和大脑发育成熟过程中的环境因素共同决定。其临床症状主要分为3类:以幻觉和妄想为主要特征的阳性症状、以社交互动缺乏和抑郁情绪为主要表现的阴性症状和以学习记忆功能受损的认知功能障碍[42]。
目前普遍认为NMDAR 功能减退与精神分裂症的病理机制密切相关。NMDAR 被外源性或内源性配体拮抗时均可能诱导精神分裂症的发生[43];而增强NMDAR 功能则可以改善精神分裂症状[44]。研究表明,精神分裂的病理机制涉及NMDAR 亚基NR2A 和NR2B 的失衡[45];体外实验发现,mGluR5 在小鼠发育期的海马和视觉皮层中介导NR2A 和NR2B 的转换[46],提示了mGluR5 与NMDAR 相互作用参与精神分裂病理机制的可能性。另外,精神分裂症与前额叶皮层和海马区的小清蛋白阳性神经元异常有关;而有研究报道,发育期小清蛋白阳性神经元的mGluR5 敲除是导致小鼠精神分裂表型出现的病理机制之一[47]。
Wang 等[48]通过尸检发现,相比正常对照人群,精神分裂患者的前额叶皮层中的mGluR5 信号转导显著降低,具体表现为Gαq/11与PI3K 和Homer的结合减少,mGluR5与NMDAR亚基NR1和NR2A的连接同样减少。 由此,作者认为mGluR5 和NMDAR 功能异常减退影响着精神分裂症的发生发展。与之一致,临床前实验表明敲除mGluR5基因会诱导小鼠出现类似精神分裂症表型[49]。
由于临床上应用NMDAR 激动剂易诱发兴奋性神经毒性、癫痫发作等不良反应,靶向mGluR5从而间接调节NMDAR 功能可能是一种有希望的治疗策略。有相关研究报道,在NMDAR 抑制剂苯环己哌啶诱导和丝氨酸消旋酶基因敲除的精神分裂小鼠模型中,激动mGluR5 可改善小鼠认知记忆缺陷[50-51]。因此,临床前实验数据积极支持了mGluR5作为治疗精神分裂症的潜在靶标。
4 mGluR5药物研发
传统药物研发策略是基于已知的内源性配体结合位点来寻找正构激活或抑制受体的药物分子。(R,S)-3,5-二羟基苯基甘氨酸[(R,S)-3,5-dihydroxyphenylglycine,DHPG]是最 早 发 现 的I 型mGluR 选择性正构位点激动剂。DHPG 与mGluR5的亲和力比mGluR5选择性正构位点激动剂2-氯-5羟苯基甘氨酸[(R,S)-2-chloro-5-hydroxyphenylglycine,CHPG]与mGluR5 的亲和力高,所以DHPG 是体外药理实验中更为常用的mGluR5激动剂[7]。
通过正构位点完全激活或抑制受体容易影响细胞的正常生理活动,为避免副作用产生,研究者倾向寻找能结合受体其他位点的高选择性药物分子。作为GPCR,mGluR5的7次跨膜结构存在多个潜在变构结合位点[52],为变构调节剂的研发提供可能。近年来,在存在或不存在激动剂的条件下激活mGluR5 的正向变构调节剂(positive allosteric modulator,PAM)和抑制mGluR5 活化的负向变构调节剂(negative allosteric modulator,NAM)已经成为药物研发的热点之一[53]。目前报道的进入相关中枢神经系统疾病临床研究的mGluR5 NAM 有Mavoglurant、Basimglurant 、Dipraglurant、AZD2066、Fenobam 和STX107(表1),这些药物的临床实验结果大多未达预期;其中,Dipraglurant 在治疗帕金森患者LID 的Ⅱa 期临床实验中展现出初步疗效[32],所以Dipraglurant 用于治疗LID 的Ⅱb/Ⅲ期临床研究(NCT04857359)计划于2021年启动。而mGluR5 PAM 目前仍处于临床前动物实验阶段[54]。
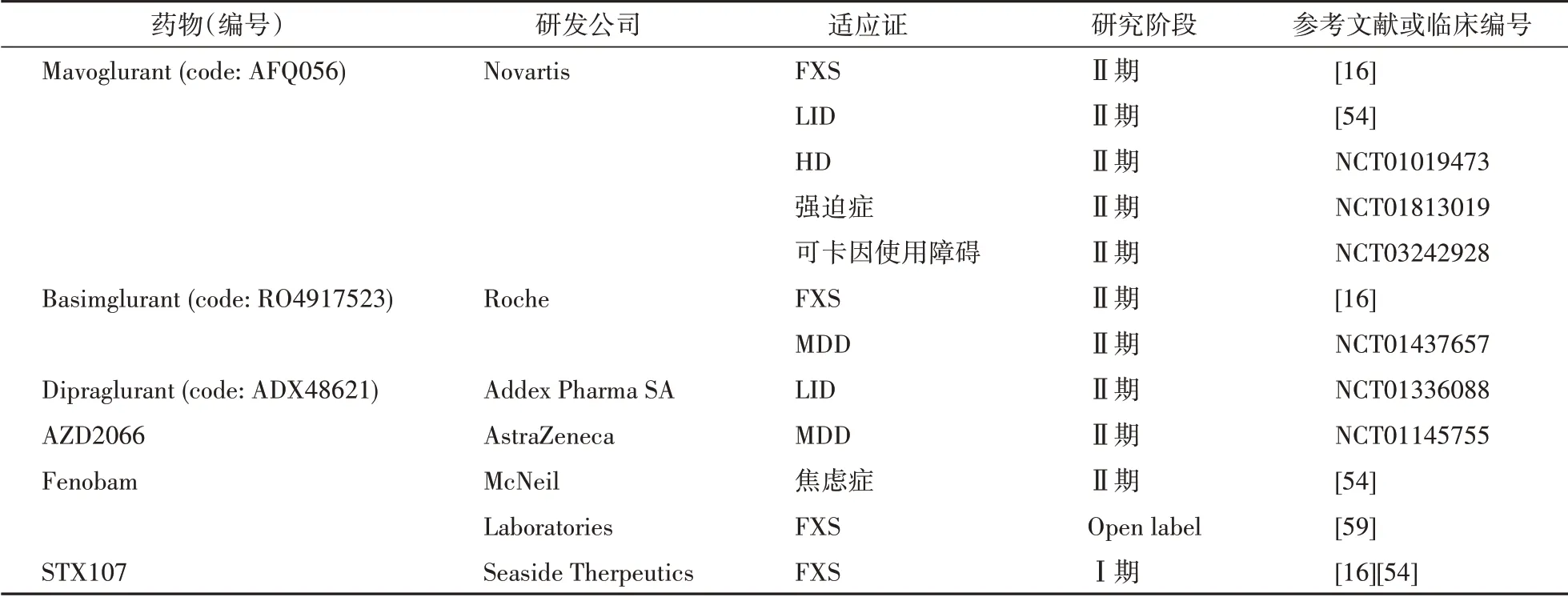
表1 处于中枢神经系统疾病临床研究阶段的mGluR5负向变构调节剂
在mGluR5 药物研发中,PET 技术发挥了积极作用。PET作为一种先进的体内成像技术,借助放射性示踪剂来定量活体组织中的受体、转运蛋白或酶的表达水平,从而反应分子水平的生理、病理、代谢等变化[55]。PET 现在已经广泛应用于可视化人类和动物体内的mGluR5 表达分布。这项技术不仅有助于观察不同神经精神疾病患者脑内的mGluR5 表达变化[38,56-57],还可用于评估mGluR5变构调节剂的药理效用、洞察药物剂量与药物受体占有率之间的关系[58]等。目前应用于临床的mGluR5 放射性示踪剂有[18F]FPEB,[11C]ABP688和[18F]SP203;大多数放射性示踪剂是mGluR5 NAM 2- 甲 基-6-(苯 乙 炔)吡 啶[2-methyl-6-(2-phenylethynyl)-pyridine,MPEP]的结构类似物[55],后续它们也可能发展成为临床上抑制mGluR5 的治疗药物。
5 结 语
作为谷氨酸能系统的重要组成部分,mGluR5在维系大脑神经网络稳定中发挥不可或缺的作用。mGluR5 介导突触可塑性的功能使其与FXS、AD、精神分裂症等疾病中的突触功能损伤和认知障碍发生密切联系。借助先进的临床影像技术,许多研究发现mGluR5 在不同疾病动物模型和患者脑内的表达变化,提示mGluR5 在多种中枢神经系统疾病中的潜在作用;探究mGluR5 在不同中枢神经疾病中所扮演的角色,可以为中枢神经系统疾病的临床治疗提供新策略。
虽然目前mGluR5 与不同神经和精神疾病的研究已经取得了一些进展,但是其在特定疾病中介导的具体机制仍未清楚,还有待后续更深入地研究。此外,如何将临床前实验中疗效良好的mGluR5 NAM 和PAM 成功应用至临床依旧是一大难题。未来需要更好地将基础研究和临床实际结合,研发针对mGluR5 的高选择性药物,并提高药物从动物模型到临床应用转化的成功率。

