山东省EGFR-TKI致不良反应报告分析
刘宝生 周秀丽 宫凯凯




中圖分类号 R969.3 文献标志码 A 文章编号 1001-0408(2021)24-3019-06
DOI 10.6039/j.issn.1001-0408.2021.24.13
摘 要 目的:分析表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)致不良反应(ADR)的临床表现和特点,为临床安全用药提供参考。方法:汇总2018年1月-2020年12月山东省ADR监测中心自发呈报系统收集到的EGFR-TKI致ADR报告的相关数据,对报告涉及的患者年龄、性别、药物品种、ADR分类、用法用量、ADR发生时间、累及器官/系统及主要临床表现、转归情况等进行统计、分析。结果与结论:共纳入EGFR-TKI致ADR报告120份,涉及患者120例。120例患者中,女性(60.83%)多于男性(39.17%),年龄以50~79岁(79.16%)为主。共涉及吉非替尼、奥希替尼、阿法替尼、埃克替尼和厄洛替尼等5种药物,分别有72、11、15、6、16例使用上述药品的患者发生了ADR;ADR以一般的(70.83%)为主,其次为严重的(22.50%)、新的一般的(5.00%)和新的严重的(1.67%)。所有患者均为口服给药,有2例使用埃克替尼的患者存在超说明书用药情况,其余均符合药品说明书用药要求。有61例(50.83%)患者的ADR发生在用药后1个月内,34例(28.33%)发生在用药后1~3个月,25例(20.83%)发生在用药后4~12个月,用药12个月以后未有ADR发生。ADR累及器官/系统以皮肤及其附件损害、胃肠系统损害和肝胆系统损害为主,主要临床表现为皮疹、腹泻和肝功能异常;此外,有患者出现间质性肺炎、骨髓抑制、舌肿胀和脑梗死等严重的或新的严重的ADR。102例患者经停药或对症处理后痊愈或好转,12例转归情况不详,6例未好转。建议临床应加强对患者用药后 1个月内的药学监护,警惕新的、严重的ADR的发生,保障患者临床用药安全。
关键词 表皮生长因子受体酪氨酸激酶抑制剂;药品不良反应;报告分析;用药安全;山东省
Analysis of the Reports of Adverse Dug Reaction Induced by EGFR-TKI in Shandong Province
LIU Baosheng1,ZHOU Xiuli2,GONG Kaikai3(1. Dept. of Clinical Pharmacy, Weifang Hospital of TCM, Shandong Weifang 261000, China; 2. Dept. of Pharmacy, Sunshine Union Hospital, Shandong Weifang 261000, China; 3. Cancer Research Laboratory, Binzhou Medical University Hospital, Shandong Binzhou 256603, China)
ABSTRACT OBJECTIVE: To analyze the clinical manifestations and characteristics of adverse drug reactions (ADR) induced by EGFR-TKI, and to provide reference for safe use of drugs in clinic. METHODS: The relevant data of EGFR-TKI-induced ADR reports which were reported to Shandong ADR Monitoring Center from January 2018 to December 2020 were summarized, and analyzed statistically in respects of age, gender, drug variety, ADR classification, usage and dosage, occurrence time, involved organs/systems, clinical manifestations and prognosis of patients. RESULTS & CONCLUSIONS: A total of 120 ADR reports induced by EGFR-TKI were included, involving 120 patients. Among 120 patients, the female (60.83%) was more than the male (39.17%), and the age was mainly 50-79 years old (79.16%). A total of 5 drugs including gefitinib, ositinib, afatinib, ektinib and erlotinib were involved. ADR occurred in 72, 11, 15, 6 and 16 patients using the above drugs respectively; the main ADR was general ADR (70.83%), followed by severe ADR (22.50%), new general ADR (5.00%) and new severe ADR (1.67%). All patients were given drugs orally, off-label use was found in 2 patients who used ektinib, and the rest met the medication requirements of the drug instructions. ADR occurred in 61 patients (50.83%) within 1 month after medication, 34 patients (28.33%) within 1-3 months after medication, 25 patients (20.83%) within 4-12 months after medication, and no ADR occurred after 12 months. ADR of organs/systems involved were mainly the lesion of skin and its appendant injury, gastrointestinal system injury and hepatobiliary system injury. The main clinical manifestations were rash, diarrhea and abnormal liver function; in addition, some patients developed severe or new severe ADR such as interstitial pneumonia, bone marrow suppression, tongue swelling and cerebral infarction. Totally 102 patients recovered or improved after drug withdrawal or symptomatic treatment, 12 patients had unknown outcome, and 6 patients did not improve. It is suggested that pharmaceutical care should be strengthened within 1 month after EGFR-TKI administration, so as to guard against the occurrence of new and serve ADR and ensure the safety of clinical medication.
KEYWORDS EGFR-TKI; ADR; Report analysis; Safety of drug use; Shandong province
基金项目:国家自然科学基金资助项目(No.81903537)
主管药师,硕士。研究方向:药事管理与临床药学。电话:0536-8060676。E-mail:1057080284@qq.com
通信作者:主管药师,硕士。研究方向:药事管理与临床药学。电话:0536-6960663。E-mail:xiulizhou1990@163.com
肺癌是我国发病率和病死率均较高的恶性肿瘤之一[1],按组织病理学特征可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌,其中NSCLC占80%~85%,多数患者在确诊时已为晚期,且预后较差,5 年生存率仅为 16.6%,伴有远处转移的患者的5年生存率仅为3.9%[2]。近年来,NSCLC 的治疗取得了重大突破,已由传统的手术、化疗和放疗发展为精准分子靶向治疗和免疫治疗。在NSCLC精准分子靶向治疗的研究领域中,以表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)的研究较多,该类制剂已被广泛应用于EGFR突变患者[3]。有研究指出,不同EGFR-TKI的药理作用机制略有不同,其中第一代EGFR-TKI可与表皮生长因子受体(EGFR)可逆性结合;第二代EGFR-TKI为多靶点小分子药物,能与EGFR酪氨酸残基以共价键连接,形成不可逆性结合,同时对酪氨酸激酶受体(ErbB)家族其他成员(如ErbB-2、ErbB-4)具有抑制活性[4];第三代EGFR-TKI为高度选择性T790M突变小分子抑制剂[5]。有研究发现,针对EGFR突变的NSCLC患者,EGFR-TKI的疗效和安全性均优于标准化疗方案[6-8]。
目前,我国国家药品监督管理局共批准了7种EGFR-TKI上市,包括第一代药物吉非替尼、厄洛替尼和埃克替尼,第二代药物阿法替尼和达可替尼,以及第三代药物奥希替尼和阿美替尼。EGFR-TKI的药品说明书中记载其常见的不良反应(adverse drug reactions,ADR)主要为皮疹、甲沟炎、腹泻等。由于该类药物上市时间较短,有关的ADR报道仅为个案报道和文献分析,尚缺乏基于真实世界数据的药品上市后安全性评价,加之ADR的发生可能会影响患者的用药依从性,若预防或处理不当可能会影响药物的疗效。基于此,本研究对山东省EGFR-TKI致ADR报告进行汇总分析,旨在评价EGFR-TKI致ADR的发生特点,以期为临床合理用药提供参考。
1 资料与方法
1.1 资料来源
汇总2018年1月-2020年12月山东省ADR监测中心自发呈报系统收集到的EGFR-TKI致ADR报告的相关数据,筛选ADR关联性评价为“肯定”“很可能”“可能”的ADR报告。
1.2 方法
参照《药品不良反应报告和监测管理办法》对ADR进行分类,分为一般的、新的一般的、新的严重的和严重的等4类,其中新的ADR指药品说明书中未载明的ADR或药品说明书中已有描述,但ADR发生的性质、程度、后果、频率与药品说明书描述不一致或者更严重的;一般的ADR指严重程度为轻、中度的ADR;严重的ADR指可引起以下损害之一的ADR,包括(1)死亡,(2)危及生命,(3)致癌、致畸、致出生缺陷,(4)导致严重的或者永久的人体伤残或器官损害,(5)导致住院或者住院时间延长,(6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的ADR[9]。
提取所纳ADR报告的相关信息,主要包括患者的年龄、性别、药物品种、ADR分类、用法用量、ADR发生时间、累及器官/系统及临床表现、转归情况等。采用Excel 2010软件进行统计、分析。
2 结果
2.1 患者的年龄与性别分布
本研究共纳入EGFR-TKI致ADR报告120份,涉及患者120例。120例患者中,女性73例(60.83%)高于男性47例(39.17%);年龄为25~92岁,平均年龄为(63.32±12.04)岁;以50~79岁(79.16%)的患者居多。患者年龄与性别分布见表1。
2.2 EGFR-TKI品种及ADR分类
120份ADR报告中,共涉及5种EGFR-TKI,分别为吉非替尼、奥希替尼、阿法替尼、埃克替尼和厄洛替尼,各有72、11、15、6、16例用药者发生了ADR。ADR分类以一般的为主(85/120,70.83%),其次为严重的(27/120,22.50%)、新的一般的(6/120,5.00%)和新的严重的(2/120,1.67%)。EGFR-TKI致ADR分类见表2。
2.3 用法用量
120例患者均为口服给药。有72例患者使用吉非替尼,用量为每天1次,每次250 mg,均符合药品說明书用药要求。有11例患者使用奥希替尼,用量为每天1次,每次80 mg,均符合药品说明书用药要求。有15例患者使用阿法替尼,用量为每天1次,每次40 mg,若无法耐受则减量至每次30 mg,均符合药品说明书用药要求。有16例患者使用厄洛替尼,用量为每天1次,每次150 mg,均符合药品说明书用药要求。有6例患者使用埃克替尼,其中4例用量为每天3次,每次125 mg,均符合药品说明书用药要求;2例为超说明书用药,包括1例每天3次、每次250 mg,1例每天1次、每次125 mg。
2.4 ADR发生时间
120例患者中,有61例(50.83%)的ADR发生在用药后1个月内,其中有3例(2.50%)发生在用药后10 min内;34例(28.33%)的ADR发生在用药后1~3个月;25例(20.83%)的ADR发生在用药后4~12个月;用药12个月以后未有患者发生ADR。EGFR-TKI致ADR的发生时间分布见表3。
2.5 ADR累及器官/系统及主要临床表现
吉非替尼累及器官/系统主要为皮肤及其附件损害、胃肠系统损害、肝胆系统损害、呼吸系统损害、全身性损害等,临床主要表现为皮疹、瘙痒、甲沟炎、腹泻、口腔溃疡、恶心、肝功能异常、肝损伤、间质性肺炎、舌肿胀、血压升高、血小板升高等。奥希替尼累及器官/系统主要为血液系统损害、皮肤及其附件损害、肝胆系统损害等,临床主要表现为骨髓抑制、皮疹、血小板减少、甲沟炎、肝功能异常。阿法替尼累及器官/系统主要为胃肠系统损害、皮肤及其附件损害、呼吸系统损害、血液系统损害等,临床主要表现为腹泻、口腔溃疡、甲沟炎、皮疹、间质性肺炎、白细胞减少等。埃克替尼累及器官/系统主要为肝胆系统损害、皮肤及其附件损害、血液系统损害、胃肠系统损害等,临床主要表现为转氨酶升高、皮疹、银屑病、骨髓抑制、恶心等。厄洛替尼累及器官/系统主要为皮肤及其附件损害、胃肠系统损害、肝胆系统损害等,临床主要表现为皮疹、皮肤感染、脓疱疹、腹泻、肝损伤等。EGFR-TKI致ADR的主要临床表现见表4(当同一报告涉及多种临床表现时只统计其主要临床表现)。
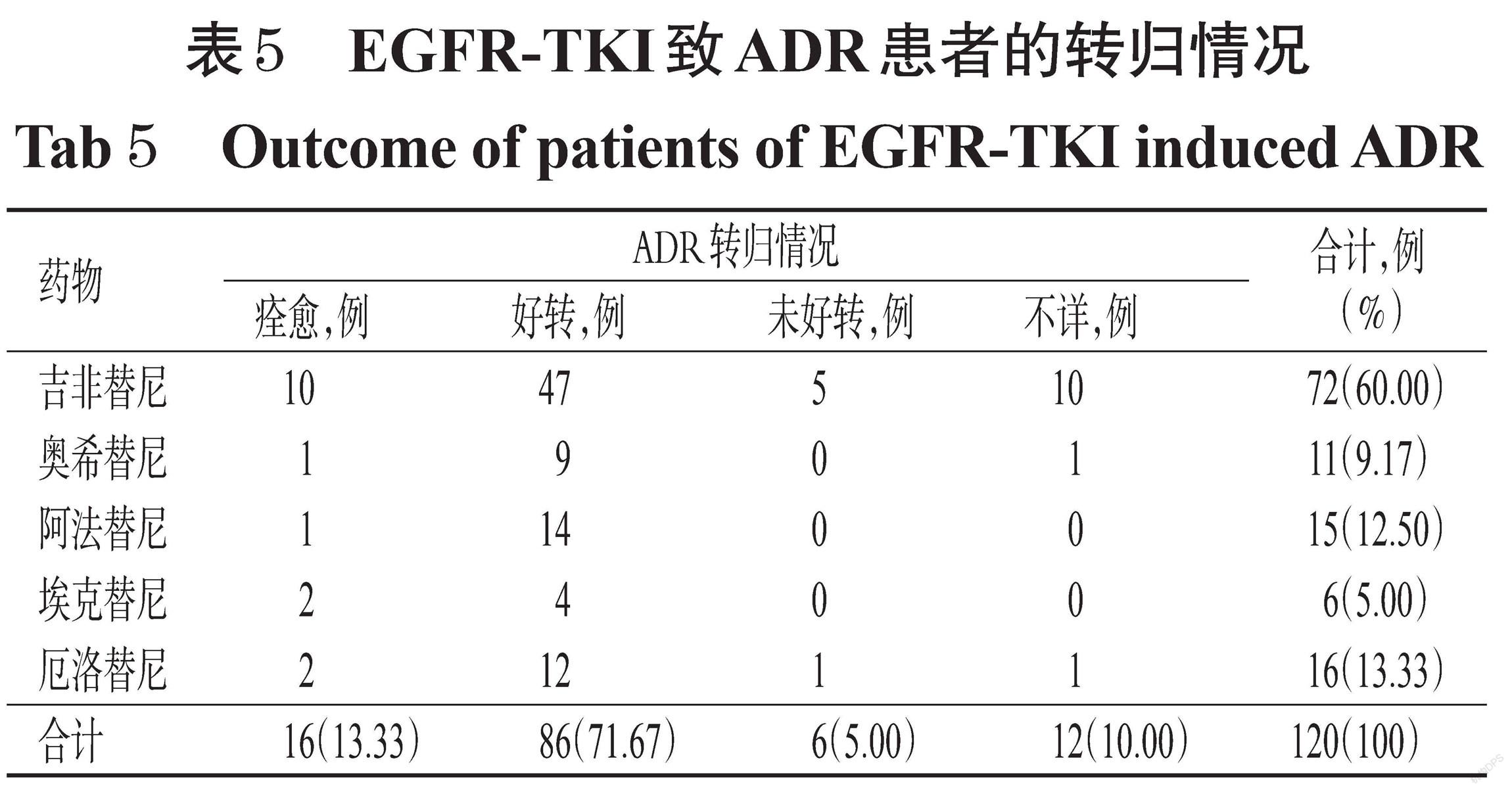
2.6 转归情况
120例患者中,102例(85.00%)经停药或对症处理后痊愈或好转;12例(10.00%)因出院后随访失联,具体转归情况不详;6例(5.00%)因ADR情況较为严重,经对症处理后未见好转。EGFR-TKI致ADR患者的转归情况见表5。
3 讨论
3.1 患者基本情况分析
120例患者的年龄为25~92岁,均符合EGFR-TKI药品说明书对用药人群年龄(≥18岁)的要求。其中,50~79岁患者(占79.16%)为ADR高发人群,这可能与该年龄段人群罹患EGFR突变的局部晚期或转移性NSCLC的比例较高有关[10];女性发生ADR的占比高于男性,这可能与我国女性EGFR突变率高于男性有关[11]。本研究纳入的ADR报告所涉及的吉非替尼、厄洛替尼、埃克替尼、阿法替尼和奥希替尼等5种药物,均被我国国家药品监督管理局批准用于EGFR突变的晚期或转移性NSCLC患者的一线治疗,其中奥希替尼还被批准用于EGFR T790M突变阳性晚期NSCLC患者的二线治疗,这5种药物的临床应用较为广泛,可能是其引发ADR较多的主要原因。在120例患者中,有2例使用埃克替尼的患者存在超说明书用药情况,其中1例为减少给药频次,这可能与患者无法耐受ADR有关(ADR无法耐受者应暂停用药直至症状缓解);1例为增加单次给药剂量,其药品说明书记载,根据该药的Ⅰ期临床试验结果,患者ADR的发生率和严重程度可随剂量的增加而增加,故不推荐调整剂量。因此,建议医师应严格把握用药人群、用药适应证及用药品种,按照药品说明书要求规范用药,以保障临床用药的安全性。
3.2 ADR发生时间
在纳入的ADR报告中,ADR的发生时间主要为用药后3个月内,以用药后1个月内的占比(50.83%)较高,而用药12个月以后未见ADR发生;此外,有3例患者在用药后10 min内发生了ADR。因此,建议临床应从患者用药开始密切监测其ADR的发生情况,尤其应加强用药后3个月内的药学监护以及用药后12个月内的随访工作,而对于长期使用EGFR-TKI发生 ADR 的情况尚需进一步的临床观察予以确认。
3.3 ADR累及器官/系统及主要临床表现
3.3.1 皮肤及其附件损害 EGFR-TKI药品说明书中记载皮肤相关ADR为其常见的ADR。本研究结果显示,吉非替尼、奥希替尼、阿法替尼、埃克替尼和厄洛替尼均会引起皮肤及其附件损害,尤以吉非替尼和厄洛替尼所致的皮肤及其附件损害ADR较多;皮肤相关ADR以一般的ADR为主,主要临床表现为皮疹、瘙痒、甲沟炎等。此外,厄洛替尼导致了2例严重的ADR,表现为脓疱疹和口唇肿胀,与以往研究报道的该药可导致严重的皮肤相关ADR一致[12-13]。EGFR 对上皮细胞的增殖和分化具有重要作用,包括刺激表皮细胞生长并抑制其分化、保护皮肤免受紫外线伤害、抑制炎症反应并加速伤口愈合等[14]。若EGFR的活性被抑制,就会导致皮肤滤泡和滤泡间质细胞的表皮生长因子信号通路受到干扰,从而诱导角质形成细胞凋亡,并对其增殖和分化产生抑制作用,激活炎症反应,最终引起皮肤相关ADR[15]。由于所有正常上皮和部分间叶来源的细胞均存在EGFR,因此EGFR-TKI对皮肤及其附件具有特殊的毒副反应[16]。EGFR-TKI所致皮肤相关ADR与药物的品种和治疗时间有关,同时也与患者自身因素(如免疫状态、吸烟、遗传变异等)相关[17]。此外,导致EGFR-TKI致皮肤及其附件损害加重的因素较多,如患者年龄≥65岁、同期进行放射治疗、阳光暴晒、皮肤保湿不充分、曾接受细胞毒性药物治疗而导致皮肤屏障改变等[16]。因此在使用EGFR-TKI时,医护人员要加强对患者的宣教,指导其采取正确的预防措施,比如使用防晒霜,保持皮肤的清洁与湿润,治疗过程中穿着宽松、透气的衣服、鞋子等[15]。
3.3.2 胃肠系统损害 有研究指出,EGFR-TKI导致胃肠系统损害的发生率较高,主要临床表现为腹泻、口腔溃疡,其中腹泻发生率约为55%[18]。本研究结果显示,吉非替尼、阿法替尼、埃克替尼和厄洛替尼均会引起胃肠系统损害,其中以吉非替尼和阿法替尼所致的胃肠系统损害较多,主要临床表现为腹泻、恶心和口腔溃疡等。有文献报道,阿法替尼致胃肠系统损害的发生率较第一代EGFR-TKI更高[19],这与本研究结果基本一致。奥希替尼说明书中记载其常见ADR包含腹泻、恶心等,而本研究未发现该药致胃肠系统损害的相关报告,可能与所收集的奥希替尼致ADR报告数较少有关。EGFR-TKI导致腹泻的机制尚不明确,有研究认为可能与氯离子的过度分泌有关[20]。在本研究中,腹泻以一般的ADR为主,但也要警惕严重的腹泻的发生,如各有1例使用阿法替尼和吉非替尼的患者发生严重腹泻,表现为稀便、水样便,同时还出现口渴、皮肤黏膜弹性变差等脱水症状,并伴有烦躁、嗜睡、面色苍白、精神萎靡等症状。因此,医护人员应加强对患者用药后可能出现腹泻的相关教育,收集患者的用药信息,对可能导致胃肠系统损害的药物进行评估,并在治疗期间给予低脂低纤维饮食,忌用含有咖啡因、酒精的食物/饮料以及辛辣食物等,禁用泻药(除在医师指导下使用)等。口腔溃疡是累及胃肠系统的常见ADR,好发于唇、舌、口底、软腭等部位,临床以疼痛、吞咽困难、味觉异常为主要症状[21]。本研究结果显示,吉非替尼和阿法替尼所致口腔溃疡均为一般的ADR。有研究发现,厄洛替尼致口腔溃疡的发生率约为8%~13%[22],奥希替尼致口腔溃疡的发生率约为15%~29%[23]。在本研究中,未有厄洛替尼和奥希替尼致口腔溃疡的报告,可能与纳入的样本量较小有关。因此,应加强对患者的预防教育,指导其日常口腔卫生的维护,若发现ADR应及时干预[24],同时还应加强患者的随访工作。
3.3.3 肝胆系统损害 EGFR-TKI导致肝胆系统损害的临床表现主要为肝功能异常。本研究结果显示,吉非替尼、奥希替尼、厄洛替尼和埃克替尼均导致患者出现肝功能異常,以严重的ADR为主,仅使用吉非替尼的患者出现一般的ADR,该结果与相关研究结果一致[25]。除阿法替尼外,其他EGFR-TKI主要通过肝脏细胞色素P450(CYP450)酶系代谢,其代谢产物可能会导致肝毒性[26];也有研究认为,EGFR-TKI诱导的自身免疫性损伤是导致肝毒性的另一种机制[27]。由于肝功能损伤的潜伏期差异较大,可短至数日或长达数月,因此药物和肝损伤的相关性难以判断;加之肿瘤患者除需服用EGFR-TKI外,可能还会服用其他抗肿瘤药、中药、镇痛药等,这些药物也可能会导致肝功能损伤,因此应注意鉴别肝功能损伤是否与EGFR-TKI直接相关。由于本研究纳入了严重的肝功能异常,故临床需特别注意肝损伤的预防工作,严格遵循药品说明书和临床指南用药,用药后应定期监测患者的肝功能,联合应用CYP3A4抑制剂或诱导剂时需及时调整EGFR-TKI的剂量,同时加强对患者的用药教育。
3.3.4 其他 本研究结果显示,在使用吉非替尼的患者中,有2例出现严重的间质性肺炎,分别有1例出现新的严重的舌肿胀、新的一般的排尿困难、新的一般的血小板升高、新的一般的血压升高。在使用厄洛替尼的患者中,有1例出现新的严重的脑梗死。EGFR-TKI所致新的ADR的发生率虽然较低,但一旦发生若处理不当可能会危及患者的生命,因此临床需加强用药后的药学监护。EGFR-TKI导致的间质性肺炎是一种发生率很低但严重的ADR,其发生机制可能为肺泡Ⅱ型上皮细胞表达EGFR,EGFR参与肺泡壁的修复,而EGFR-TKI在抑制肿瘤生长的同时,也抑制了气管上皮细胞的生长和损伤修复,从而加重肺损害[28]。因此,临床在EGFR-TKI使用前和使用时都要做好间质性肺炎的预防工作,用药前评估患者的间质性肺炎危险因素,用药时避免与胸部放疗同步进行,避免与免疫检查点抑制剂同时使用,加强对患者相关指标的监测和随访,若出现新发呼吸道症状或发热时应及时行胸部影像学检查。
综上所述,随着EGFR-TKI的广泛应用,其ADR也逐渐显现,临床应用时需注意监测患者皮肤及其附件损害、胃肠系统损害、肝胆系统损害等,同时还要警惕新的ADR的发生。多数EGFR-TKI所致ADR是可预防、控制的,经停药或对症处理后大多患者均可痊愈或好转,因此加强患者宣教、尽早识别和有效干预治疗,可提高患者治疗依从性和用药安全性,从而提高临床疗效。
参考文献
[ 1 ] CHEN W Q,ZHENG R S,BAADE P D,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[ 2 ] DOMINGUES D,TURNER A,SILVA M D,et al. Immunotherapy and lung cancer:current developments and novel targeted therapies[J]. Immunotherapy,2014,6(11):1221- 1235.
[ 3 ] 刘华丽,许斌,韩光,等. EGFR-TKI 在非小细胞肺癌中的研究进展[J].中国肿瘤,2018,27(4):285-294.
[ 4 ] SOLCA F,DAHL G,ZOEPHEL A,et al. Target binding properties and cellular activity of afatinib:BIBW 2992,an irreversible ErbB family blocker[J]. J Pharmacol Exp Ther,2012,343(2):342-350.
[ 5 ] AKKERMANS R. Third-generation EGFR-TKIs:a new hope for NSCLC[J]. Lancet Respir Med,2014,2(7):520.
[ 6 ] FUKUOKA M,WU Y L,THONGPRASERT S,et al. Biomarker analyses and final overall survival results from a phase Ⅲ,randomized,open-label,first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia:IPASS[J]. J Clin Oncol,2011,29(21):2866-2874.
[ 7 ] MILLER V A,HIRSH V,CADRANEL J,et al. Afatinib versus placebo for patients with advanced,metastatic non-small-cell lung cancer after failure of erlotinib,gefitinib,or both,and one or two lines of chemotherapy(LUX-lung 1):a phase 2b/3 randomised trial[J]. Lancet Oncol,2012,13(5):528-538.
[ 8 ] SEQUIST L V,YANG J C H,YAMAMOTO N,et al. Phase Ⅲ study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations[J]. J Clin Oncol,2013,31(27):3327-3334.
[ 9 ] 卫生部.药品不良反应报告和监测管理办法:卫生部令第81号[S/OL].(2011-05-04)[2021-07-20]. http://www.gov.cn/gongbao/ con-tent/2011/content_2004739.htm.
[10] TANAKA T,MATSUOKA M,SUTANI A,et al. Fre- quency of and variables associated with the EGFR mutation and its subtypes[J]. Int Cancer,2010,126(3):651- 655.
[11] WU Y L,ZHONG W Z,LI L Y,et al. Epidermal growth factor receptor mutations and their correlation with gefitinib therapy in patients with non-small cell lung cancer:a meta-analysis based on updated individual patient data from six medical centers in mainland China[J]. J Thorac Oncol,2007,2(5):430-439.
[12] 童莹慧,方罗,丁海樱,等.表皮生长因子受体抑制剂相关性皮肤毒性的研究进展[J].中国现代应用药学,2018,35(2):293-301.
[13] 戴丹丹,王增,刘孟娟,等. 133例厄洛替尼单药治疗非小细胞肺癌的不良反应分析[J].海峡药学,2015,27(7):226-228.
[14] SEGAERT S,VAN CUTSEM E. Clinical signs,pathophysiology and management of skin toxicity during the- rapy with epidermal growth factor receptor inhibitors[J]. Ann Oncol,2005,16(9):1425-1433.
[15] CALIFANO R,TARIQ N,COMPTON S,et al. Expert consensus on the management of adverse events from EGFR tyrosine kinase inhibitors in the UK[J]. Drugs,2015,75(12):1335-1348.
[16] 周暉,王芳,唐旭华,等. EGFRIs抗肿瘤靶向药物相关皮肤不良反应及治疗进展[J].皮肤性病诊疗学杂志,2015,22(4):328-331.
[17] GUTZMER R,WOLLENBERG A,UGUREL S,et al. Cutaneous side effects of new antitumor drugs:clinical features and management[J]. Dtsch Arztebl Int,2012,109(8):133-140.
[18] YANG J C H,REGUART N,BARINOFF J,et al. Diarrhea associated with afatinib:an oral ErbB family blo- cker[J]. Expert Rev Anticancer Ther,2013,13(6):729-736.
[19] LACOUTURE M E,SCHADENDORF D,CHU C Y,et al. Dermatologic adverse events associated with afatinib:an oral ErbB family blocker[J]. Expert Rev Anticancer Ther,2013,13(6):721-728.
[20] MITSUDOMI T,MORITA S,YATABE Y,et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small- cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405):an open label,randomised phase 3 trial[J]. Lancet Oncol,2010,11(2):121- 128.
[21] PASSARO A,DI MAIO M,DEL SIGNORE E,et al. Ma- nagement of nonhematologic toxicities associated with dif- ferent EGFR-TKIs in advanced NSCLC:a comparison analysis[J]. Clin Lung Cancer,2014,15(4):307-312.
[22] ROSELL R,CARCERENY E,GERVAIS R,et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre,open-label,randomised phase 3 trial[J]. Lancet Oncol,2012,13(3):239-246.
[23] SHI Y K,WANG L,HAN B H,et al. First-line icotinib versus cisplatin/pemetrexed plus pemetrexed maintenance therapy for patients with advanced EGFR mutation-positive lung adenocarcinoma(CONVINCE):a phase 3,open-label,randomized study[J]. Ann Oncol,2017,28(10):2443-2450.
[24] TRUCCI V M,VEECK E B,MOROSOLLI A. Current strategies for the management of oral mucositis induced by radiotherapy or chemotherapy[J]. Revista Odonto Ciencia,2009,24(3):309-314.
[25] MAEMONDO M,INOUE A,KOBAYASHI K,et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med,2010,362(25):2380- 2388.
[26] WIND S,SCHNELL D,EBNER T,et al. Clinical pharmacokinetics and pharmacodynamics of afatinib[J]. Clin Pharmacokinet,2017,56(3):235-250.
[27] SPRAGGS C F,BUDDE L R,BRILEY L P,et al. HLA-DQA1*02:01 is a major risk factor for lapatinib-induced hepatotoxicity in women with advanced breast cancer[J]. J Clin Oncol,2011,29(6):667-673.
[28] MATSUNO O. Drug-induced interstitial lung disease:mechanisms and best diagnostic approaches[J]. Respir Res,2012,13(1):39.
(收稿日期:2021-08-11 修回日期:2021-11-08)

