基于数字PCR的质粒核酸标准物质合作定值研究
牛春艳,张永卓,杨佳怡,董莲华,傅博强,王 晶
(中国计量科学研究院,北京100029)
1 引 言
标准物质是具有足够均匀和稳定的特定特性的物质,其特性被证实适用于测量中或标称特性检查中的预期用途。有证标准物质则是附有权威机构发布的文件,提供使用有效程序获得的具有不确定度和溯源性的一个或多个特性量值的标准物质[1]。有证标准物质是量值溯源和传递过程中的计量标准,用于仪器设备校准、检测方法评价、产品质量控制等方面。
猪繁殖与综合症是一种对养猪产业造成严重经济损失的高度传染性疾病。猪繁殖与综合症病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的核酸检测技术目前被广泛应用于猪繁殖与综合症的诊断和预防控制、流行病学研究等过程中[2~5]。研制猪繁殖与综合症病毒核酸标准物质,将为不同检测产品质量控制和评价、不同实验室间检测结果比对提供标尺。
数字PCR方法是一种不依赖于外标对核酸分子进行核酸定量的技术,通过直接计数再根据泊松分布计算样本原始核酸拷贝数,可以实现对核酸绝对定量[6~8]。按照独立单元的实现方式,数字PCR可分为基于芯片式微流控的微阵列芯片式数字PCR和基于液滴微流控的微滴数字PCR[9]。
质粒DNA标准物质是含有外源基因的线性或环状质粒分子,易于保存与运输,使用方便。中国计量科学研究院研制了多种转基因定量检测用质粒分子标准物质[10],并对质粒DNA与基因组DNA的可替代性做了比较研究,验证了质粒分子的适用性。本研究针对制备的猪繁殖与综合症病毒质粒核酸标准物质候选物,建立数字PCR定量方法,联合多家实验室利用数字PCR方法对标准物质进行合作定值研究,并评定了标准物质不确定度,获得了猪繁殖与综合症病毒美洲经典株(PRRSV CH-1a)及美洲变异株(PRRSV HuN4)两种质粒核酸标准物质。
2 实验部分
2.1 仪器及试剂
微滴数字PCR系统(QX200,美国伯乐公司);普通PCR仪(Veriti,美国Applied Biosystems公司);芯片数字PCR系统(Bio-Mark,美国富鲁达公司)。
Tagman基因表达预混液(美国Applied Biosystems公司);37k集成微流体芯片(Sample loading reagent,美国富鲁达公司);微滴式数字PCR反应液(SuperMix for Probes,美国伯乐公司):微滴发生专用油、微滴分析专用油。
实验中猪繁殖与呼吸综合症病毒美洲经典株(PRRSV CH-1a)与猪繁殖与呼吸综合症病毒株美洲变异株(PRRSV HuN4)为中国农业科学院哈尔滨兽医研究所提供。
2.2 标准物质候选物制备
选择PRRSV HuN4及CH-1a两种毒株,将基因组cDNA中包含M基因及N基因的一段保守序列克隆至质粒中,经过EcoRⅠ单酶切线性化,得到线性化质粒标准物质候选物,模拟病毒基因组cDNA。克隆用扩增引物由生工生物工程(上海)股份有限公司合成。引物序列为:
PRRSV-C-F:
(5′-CGGGATCCAAGGTGCTTTTGGCGTT-3′)
PRRSV-C-R:
(5′-AACTGCAGCGCATGGTTCTCGCCAAT-3′)。
2.3 微滴式数字PCR
微滴式数字PCR反应体系为:SuperMix for Probes 10 μL,上、下游引物各0.8 μL(终浓度400 nmol/L),探针0.8 μL(终浓度240 nmol/L),cDNA模板4 μL,加ddH2O补足终体积至20 μL。实验扩增条件为:95 ℃预变性10 min;95 ℃变性30 s,54 ℃退火 1 min,40个循环;98 ℃变性10 min。
反应引物及探针序列:
上游引物:5′-CTAGGCCGCAAGTACATTCT-3′
下游引物:5′-GACGACAAATGCGTGGTTATC-3′
探针:
5′-FAM-ATTTGCCGCAATCGGATGAAAGCC-BHQ1-3′
引物及探针由生工生物工程(上海)股份有限公司合成。
2.4 芯片式数字PCR
芯片式数字PCR反应体系为:Tagman基因表达预混液2 μL,Sample loading reagent 0.2 μL,上、下游引物各0.16 μL(终浓度200 nmol/L),探针0.16 μL(终浓度400 nmol/L),模板0.8 μL,加ddH2O补足终体积至4 μL。实验扩增条件为:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火1 min,45个循环。反应引物及探针序列与微滴式数字PCR相同。
2.5 合作定值过程
选择在核酸检测领域具备较强能力的实验室,最终选择8家实验室参加两种标准物质的定值。将参加定值的实验室(包括组织单位)编号为A,B,C,D,E,F,G,H,I,其中CH-1a由8家单位(A,B,C,D,E,F,G,H)定值,HuN4由8家单位(A,B,C,D,E,F,G,I)定值。每个实验室测定4管样品,每管样品重复测量3次。
2.6 定值数据统计
根据JJF 1343-2012《标准物质定值的通用原则及统计学原理》,对原始数据进行统计分析与处理。利用夏皮罗-威尔克法检验定值数据的正态性,利用狄克逊法及格拉布斯法两种方法分别检验实验室测量结果的可疑值,利用科克伦法检验各组数据是否等精度,用各组平均值表示定值结果。
3 结果与讨论
3.1 微滴式数字PCR方法
前期通过参数优化建立了微滴式数字PCR方法[11],首先对引物及探针浓度进行了梯度设置,选择的体系为引物浓度400 nmol/L,探针浓度240 nmol/L;其次对退火温度进行了优化,根据阴性扩增信号与阳性扩增信号差异最大的原则,选择54 ℃作为退火条件。利用建立的方法检测质粒核酸标准物质。以线性化质粒为模板,进行梯度稀释,检验方法线性关系及重复性, 结果见图1。图1中X为稀释系数;Y为核酸拷贝数浓度,copy/μL。可以看出所建立的微滴式数字PCR方法检测质粒线性关系良好(R2为0.999 8),最小相对标准偏差为1.53%。
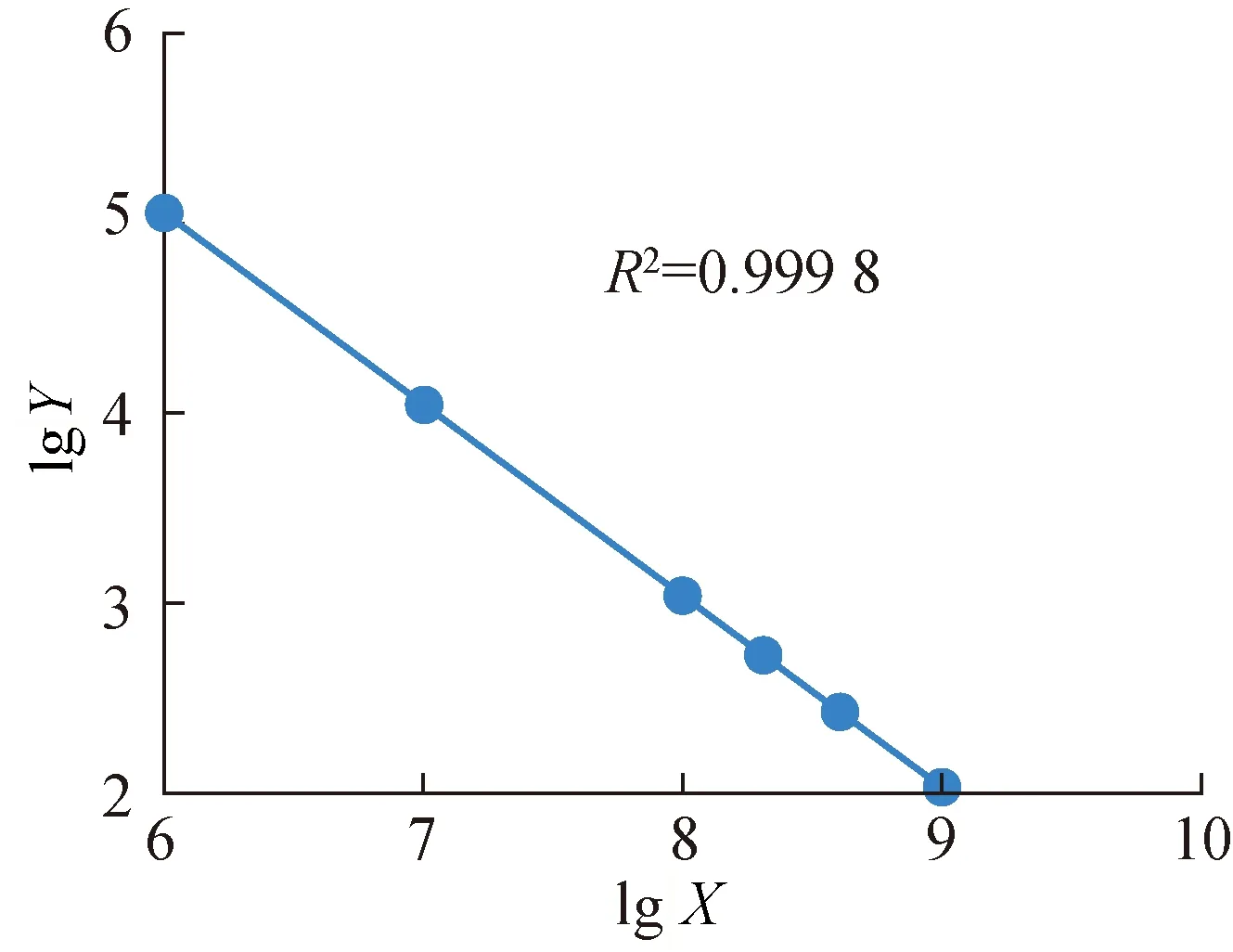
图1 微滴式数字PCR反应线性关系Fig.1 Linearity of ddPCR
3.2 芯片式数字PCR方法
优化建立了芯片式数字PCR方法。由于37 k芯片反应室个数为770,实验时需将阳性反应count个数控制在200~700,因此未进行芯片式数字PCR反应线性关系比较,而是以两个不同浓度的线性化质粒为模板(4倍稀释),检验了方法的重复性。如表1所示。
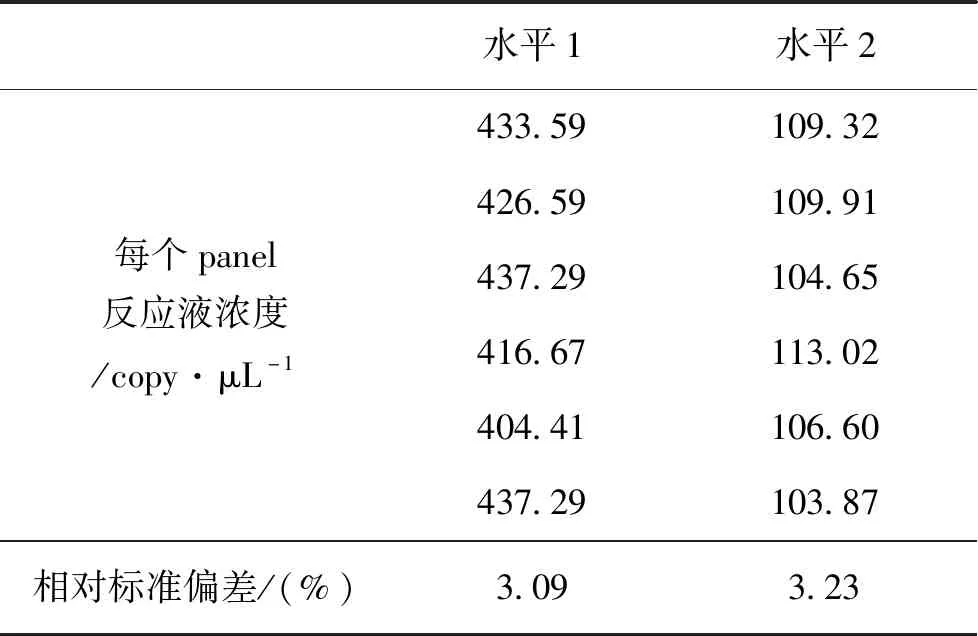
表1 芯片式数字PCR方法的重复性Tab.1 Repeatability of cdPCR
在浓度水平1相对标准偏差为3.09%,在浓度水平2相对标准偏差为3.23%,表明在两个浓度下,方法的重复性良好。对利用两种不同浓度模板进行扩增得到的原始样品的定量结果进行了统计性检验,结果表明在两个不同浓度下,方法的定量结果无显著差异(p=0.49)。因此可选择在此浓度范围内对模板进行定量检测。
3.3 两种不同平台定量结果比较
本研究利用两种数字PCR平台建立了微滴式数字PCR及芯片式数字PCR的方法,对方法的特异性、线性及重复性进行了检验,并进一步对这两种不同平台对线性化质粒模板的定量结果进行统计学检验,验证了不同平台数字PCR方法之间的一致性。
以HuN4,CH-1a两种线性化质粒为模板,分别利用微滴式数字PCR(ddPCR)及芯片式数字PCR(cdPCR)两个不同平台的方法进行定量,将定量结果进行t检验,如图2所示,结果表明两种模板不同方法间p>0.05,表明无显著差异,两种方法定量结果一致性良好。

图2 两种不同平台定量结果比较Fig.2 Comparison of two dPCR methods
3.4 合作定值结果
两种标准物质的合作实验室检测结果见表2及表3。利用夏皮罗-威尔克法检验定值数据的正态性,结果表明CH-1a及HuN4两种样品的8组数据均符合正态分布。
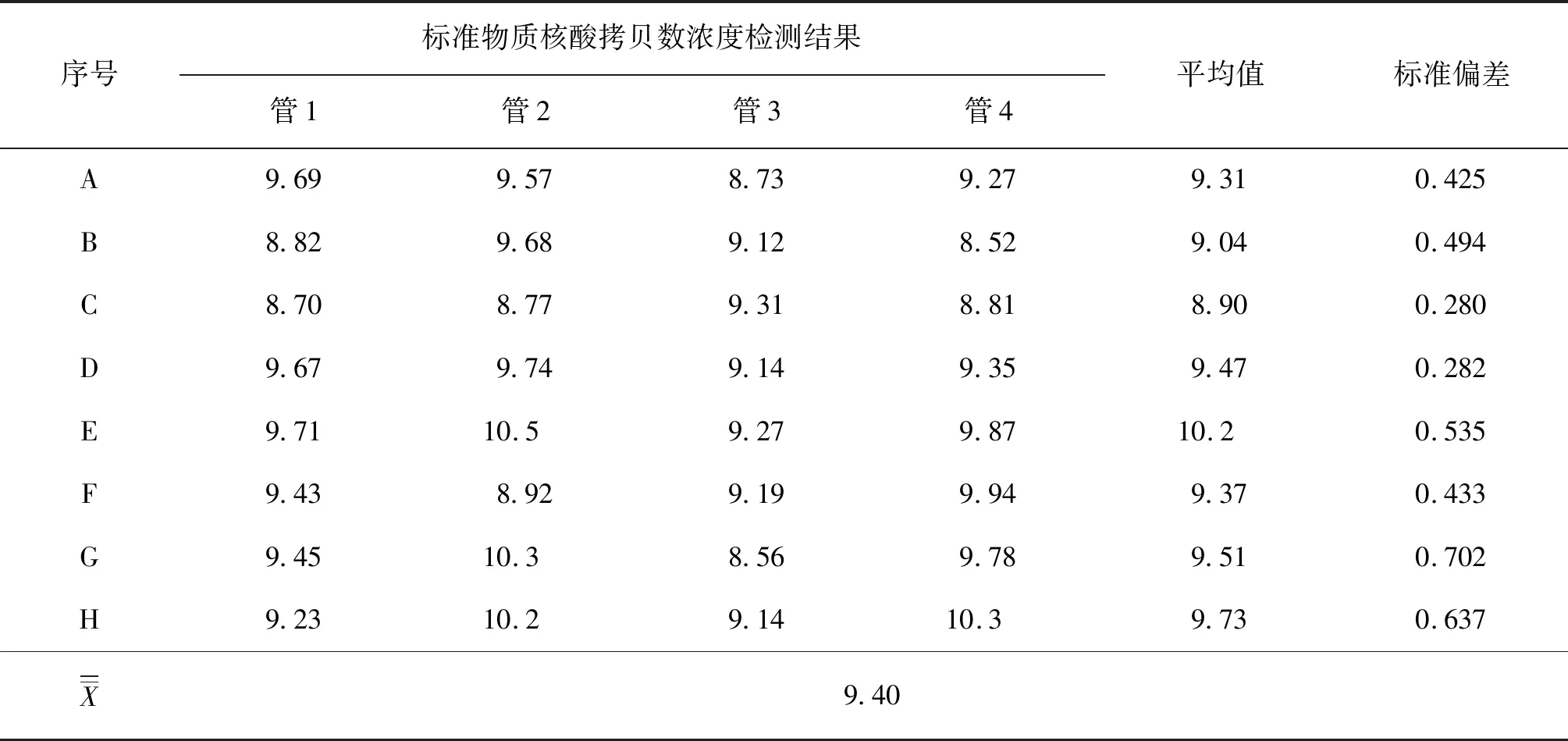
表2 CH-1a实验室定值结果统计分析Tab.2 Aanalysis of the results of collaborative labs for CH-1a 108 copy·μL-1

表3 HuN4实验室定值结果统计分析Tab.3 Analysis of the results of collaborative labs for HuN4 108 copy·μL-1
用狄克逊法及格拉布斯法两种方法分别检验8家实验室测量结果的可疑值。经狄克逊检验,查得f(0.05,8)=0.608。对于CH-1a,r1=0.168,rn=0.150;对于HuN4,r1=0.042,rn=0.325。r1值和rn值均小于f(α,n),因此所有数据保留。经格拉布斯法检验,查得λ(0.05,8)=2.126。对于CH-1a,标准偏差s=3.18×107;对于HuN4,标准偏差s=2.98×107。经计算,所有残差均小于λ(0.05,8)·s,因此所有数据均保留。
用科克伦法检验,m=8,n=4,α=0.01,查得临界值C(0.01,8,4)=0.520 9,经计算得CCH-1a=0.264 1,CHuN4=0.519 8,因此,CCH-1a CH-1a及HuN4的测试结果均以8组数据的算术平均值表示。 标准物质的不确定度uCRM来源由3个部分组成:第1部分是标准物质合作定值引入的不确定度uchar;第2部分是标准物质均匀性引入的不确定度ubb;第3部分是标准物质稳定性引入的不确定度ustab。 其中合作定值引入的不确定度考虑了重复性引入的不确定度,反应室体积引入的不确定度[12]以及稀释过程引入的不确定度。 重复性引入的不确定度采用A类评定,按如下公式计算: CH-1a重复性引入不确定度为: uA=1.12×107copy/μL,urel(A)=0.012 HuN4重复性引入不确定度为: uA=1.05×107copy/μL,urel(A)=0.014 单反应室体积引入的不确定度采用文献[12]的结果0.8%。 稀释过程引入的不确定度包括移液器引入的不确定度以及温度变化引入的不确定度。移液器引入的不确定度根据移液器校准证书上给出的校准点容量相对误差计算,温度变化引入的不确定度根据水的膨胀系数2.1×10-4℃-1,按均匀分布来计算。稀释过程的相对合成标准不确定CH-1a为0.020,HuN4为0.022。 定值过程的相对合成标准不确定度CH-1a为0.025,HuN4为0.027。 根据以下公式计算标准物质的合成标准不确定度: 在置信概率95%条件下,计算扩展不确定度U=kuCRM(k=2)。结果如表4所示。 表4 两种标准物质不确定度Tab.4 Uncertainty of the two reference materials 本研究得到的两种标准物质结果表达如下:猪繁殖与呼吸综合症病毒美洲经典株(PRRSV CH-1a)质粒核酸标准物质标准值为 9.40×108copy/μL,扩展不确定度U(k=2)为 0.9×108copy/μL;猪繁殖与呼吸综合征病毒美洲变异株(PRRSV HuN4)质粒核酸标准物质标准值为7.78×108copy/μL,扩展不确定度U(k=2)为1.0×108copy/μL。 本研究选择将猪繁殖与呼吸综合症病毒基因组cDNA中保守序列克隆至质粒中,经过单酶切线性化,模拟病毒基因组cDNA,以数字PCR作为定值方法为其准确定值,制备了线性化质粒标准物质。优化建立了质粒核酸的数字PCR方法,并对微滴式数字PCR及芯片式PCR方法的检测结果一致性进行了检验。多家实验室采用一种或多种准确性确认的方法进行合作定值是保证标准物质量值准确性的定值方式之一[13~15]。 利用建立的数字PCR方法组织8家实验室对制备的两种猪繁殖与呼吸综合症病毒质粒核酸标准物质进行了合作定值。在合作定值过程中发现,高浓度样本在进行数字PCR检测时,需要将样本提前进行稀释,而稀释过程的控制对结果的准确性保证至关重要,包括移液器的计量校准,稀释用耗材的性能评价,稀释的方法等方面。另外,由于生物样本的特殊性,在经过稀释处理后的样本应尽快进行检测,防止样品发生变化。 本项目研制的猪繁殖与综合症病毒质粒标准物质可直接用于方法建立、产品研发中标准曲线的绘制,也可用于工作标准的赋值、方法评价、产品质量控制等诸多方面。可为商品化病毒核酸检测试剂盒中质控品或校准品提供质量控制和量值溯源标准,保证检测结果的准确、可比。

3.5 不确定度评定
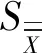

3.6 标准物质定值结果表达
4 结 论

