2型糖尿病患者循环CD4+T细胞亚群与肾脏损伤的相关性研究
程 亮,徐 永
(1.徐州医科大学附属淮安医院内分泌科,江苏 淮安 223002;2.徐州医科大学附属淮安医院肾内科,江苏 淮安 223002)
糖尿病肾脏病(diabetic kidney disease,DKD)是2型糖尿病(type 2 diabetes milletus,T2DM)最常见的慢性并发症,也是导致T2DM患者病死率增加的主要原因之一。DKD早期表现为肾小球滤过率(glomerular filtration rate,GFR)增加,特征是肾小球肥大,肾小球系膜细胞增生和细胞外基质增加;随着病情的发展,患者GFR水平逐渐下降,表现为肾小球基底膜弥漫性增厚,系膜基质增生,甚至肾小管萎缩,并最终进展为终末期肾脏病(end stage renal disease,EASD)[1]。传统观点认为,代谢紊乱和血流动力学异常是DKD的主要致病因素[2]。然而,随着慢性低级别炎症状态与T2DM之间的关系被揭示,免疫与炎症机制在DKD发展过程中作用受到了广泛关注,T细胞激活、单核-巨噬细胞募集、以及释放炎症细胞因子被认为参与了DKD的发生发展[3]。基于此,本研究通过检测T2DM患者外周血CD4+T细胞亚群,并分析其与肾功能变化之间的关系,旨在探讨CD4+T细胞在DKD发生发展过程中的作用。
1 资料与方法
1.1一般资料 本研究在徐州医科大学附属淮安医院开展研究受试者招募工作,招募日期为2019年1月—2020年12月。T2DM诊断符合1999年世界卫生组织(World Health Organization,WHO)公布的糖尿病诊断标准。排除标准:①严重肝、肾功能不全的患者;②合并糖尿病急性并发症、感染性疾病、自身免疫性疾病或肿瘤的患者;③近期有创伤或手术病史的患者;④近3个月曾接受过全身糖皮质激素或其他可能影响免疫系统药物治疗的患者。共有113例T2DM患者纳入研究。依据是否合并DKD,入组T2DM患者被分为两组,T2DM组和DKD组。DKD诊断参照《糖尿病肾脏病诊治专家共识》,即微量白蛋白尿[尿白蛋白/肌酐比值(urinary albumin to creatinine ratio,ACR)30~<300 mg/g)]或大量白蛋白尿(ACR≥300 mg/g)或估算肾小球滤过率(estimate the glomerular filtration rate,eGFR)下降[eGFR<60 mL·min-1·1.73 m-2][4]。T2DM患者中,T2DM组63例,男性25例,女性28例,年龄44~74岁,平均(59.6±12.8)岁;DKD组50例,男性20例,女性30例,年龄46~77岁,平均(60.9±11.9)岁。另外选取30例于2019年1月—2020年12月在徐州医科大学附属淮安医院体检的健康志愿者作为对照组(NC组),要求血糖在正常范围内、无T2DM家族史、且无临床确诊疾病。正常对照组30例,男性13例,女性17例,年龄46~72岁,平均(58.2±10.0)岁。三组性别和年龄比较差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准,所有受试者均已签署了书面知情同意书。
1.2研究方法 收集受试者的性别、年龄、身高、体重、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)等人口统计数据,并计算体重指数(body mass index,BMI)。禁食8 h后,留取空腹静脉血,检测空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)。血糖和血脂采用全自动生化分析仪检测(HITACHI-7180,日本),HbA1c采用高效液相色谱分析法检测(BIO-RAD D-10TM,美国)。eGFR计算公式为:186×血清肌酐(serum creatinine,SCr)-1.154×(年龄)-0.203×0.742(女性)。BMI计算公式为:体重(kg)/身高2(m2)。
1.3流式细胞术分析 肝素抗凝管采集受试者外周肘静脉血约5 mL,Ficoll密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)。采用FITC-anti-CD4、PE-anti-CD25和APC-anti-FOXP3标记,流式细胞仪检测Treg(CD4+CD25+Foxp3+)细胞占CD4+T淋巴细胞的比例;采用PerCP-Cy5.5-anti-CD3、FITC-anti-CD8和PE-anti-IFN-γ标记,流式细胞仪检测Th1(CD3+CD8-IFN-γ+)占CD3+T细胞比例;采用PerCP-Cy5.5-anti-CD3、FITC-anti-CD8和PE-anti-IL-4标记,流式细胞仪检测Th2(CD3+CD8-IL-4+)占CD3+T细胞比例。
1.4统计学方法 应用SPSS 22.0软件进行统计学分析。计量资料的多组间比较采用单因素方差分析检验,在组间比较时,方差齐性选择LSD-t检验,方差不齐选择LSD-t′检验。CD4+T细胞亚群与临床参数之间的相关性采用Spearman相关性分析,并采用多元线性回归分析确定CD4+T细胞亚群的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1两组临床指标及T细胞亚群的比较 与对照组比较,T2DM组和DKD组的SBP、FPG、HbA1c和TC水平明显升高(P<0.05);且与T2DM组相比,DKD组SBP、HbA1c、SCr和ACR水平明显升高(P<0.05),eGFR水平明显下降(P<0.05)。通过流式细胞仪检测发现,与对照组相比,T2DM组和DKD组的外周血Th1细胞比例和Th1/Th2比值明显升高(P<0.05),但Tregs细胞比例却显著降低(P<0.05)。而且,与T2DM患者相比,DKD组的外周血Th1细胞比例和Th1/Th2比值升高(P<0.05),Tregs细胞比例下降(P<0.05)。见表1。
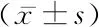
表1 受试者的基本临床特征比较
2.2T2DM患者eGFR与外周血CD4+T细胞亚群的相关性分析 T2DM患者外周血Th1/Th2比值与eGFR呈负相关关系(r=-0.211,P=0.025);Tregs细胞比例与eGFR呈正相关关系(r=0.276,P=0.003)。
2.3多元线性回归分析T2DM患者肾功能变化的影响因素 为了明确T2DM患者肾功能变化的影响因素,采用多元逐步回归分析,以eGFR为因变量,年龄、性别、BMI、SBP、DBP、FPG、HbA1c、TC、TG、LDL-C、HDL-C、Th1、Th2、Th1/Th2比值、以及Tregs为自变量进行分析。结果发现,SBP、Tregs、Th1/Th2比值和TC是T2DM患者eGFR变化的影响因素,回归方程为eGFR=131.842-0.479×SBP+10.654×Tregs-0.623×Th1/Th2比值+3.169×TC。见表2。
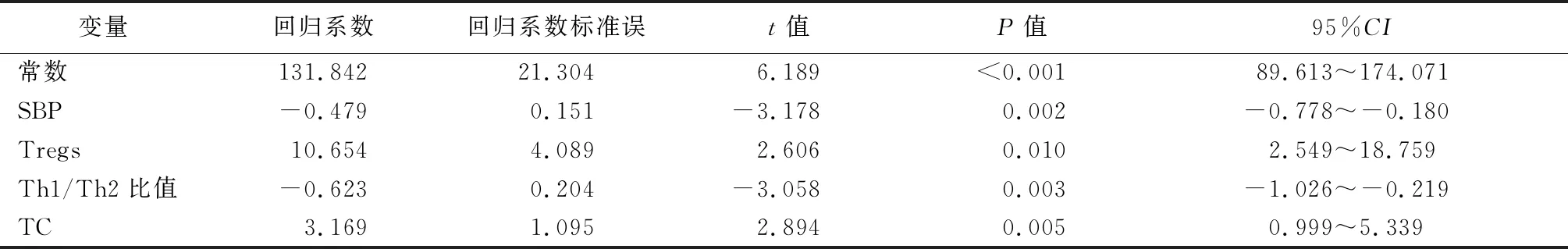
表2 多元逐步回归分析新诊断T2DM患者eGFR的影响因素
3 讨 论
DKD是一种由多种因素共同作用导致的慢性肾脏疾病(chronic kidney disease,CKD),特征为持续性蛋白尿和肾功能进行性下降。在此过程中,肾素血管紧张素醛固酮系统(renin angiotensin aldosterone system,RAAS)激活导致肾脏血流动力学异常被认为是DKD的主要致病因素[5]。然而,近年来的研究发现,肾脏组织中单核巨噬细胞募集和T淋巴细胞激活,并释放炎症细胞因子参与了DKD的发病过程[6]。一方面,长期高血糖可以导致糖基化终末产物(advanced glycation end products,AGEs)蓄积,并与淋巴细胞发生交联反应,促进淋巴细胞激活和释放炎症介质[7]。另一方面,RAAS激活和内皮细胞损伤是淋巴细胞活化增殖和炎症反应发生的重要环节[8]。
T淋巴细胞可以被分为CD4+辅助性T细胞和CD8+细胞毒性T细胞,分别识别主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类和Ⅰ类分子递呈的肽类分子。根据功能与细胞因子分泌情况,CD4+T细胞可被分为促炎的Th1和Th17,以及抗炎的Th2和Tregs。一旦被激活,Th1和Th2可以表现出多种炎症迹象,包括释放大量的细胞因子。Th1能够分泌干扰素γ(interferon-γ,INF-γ)、白细胞介素(interleukin,IL)2和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),并触发细胞免疫和吞噬细胞依赖性炎症反应;Th2分泌IL-4、IL-5、IL-6、IL-9、IL-10和IL-13,主要调节抗体反应。相比之下,Tregs是一类主要发挥免疫抑制功能的T细胞亚群,通过细胞接触抑制效应T细胞增殖,并表达IL-10、转化生长因子β等细胞因子抑制Th1、Th2和Th17等细胞的免疫应答反应,减轻炎症反应[9]。本研究中,与对照组相比,T2DM患者外周血Th1细胞比例升高,Tregs细胞比例下降,且Th1/Th2细胞比值明显升高。这些结果与既往研究结果相符,提示T2DM患者体内Tregs细胞免疫抑制功能下降,Th1、Th2等效应T细胞被激活并参与免疫应答,促进慢性炎症反应的发生。将T2DM患者进一步分为T2DM组和DKD组后,与T2DM患者相比,DKD组的外周血Th1细胞比例和Th1/Th2比值进一步升高升高,Tregs细胞比例进一步下降。而且,Spearman相关性分析发现,T2DM患者外周血Th1/Th2比值与eGFR呈负相关关系; Tregs细胞比例与eGFR呈正相关关系。多元逐步回归分析提示Tregs和Th1/Th2是T2DM患者eGFR变化的影响因素。这些研究结果提示,T2DM患者体内存在CD4+T稳态失衡,CD4+T细胞亚群向促炎方向极化,并与T2DM患者肾功能下降密切相关。
既往研究显示,DKD患者肾活检标本中存在CD4+T细胞浸润,并与肾功能下降密切相关,提示CD4+T细胞浸润与T2DM患者肾脏损伤和DKD进展有关[10]。活化的T细胞可以通过细胞毒作用直接损伤肾脏组织,并可以刺激系膜细胞分泌集落刺激因子1(colony stimulating factor,CSF-1)和单核细胞趋化因子1(monocyte chemotactic protein-1,MCP-1)间接导致肾损伤[11]。T细胞表达AGEs受体,与AGEs结合后被激活,IFN-γ合成和分泌增加,加重肾脏组织的免疫炎症损伤[12]。T2DM患者体内Th1细胞在肾小球归巢与细胞间黏附分子1(intercellular adhesion molecule-1,ICMA-1)、巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)和P选择素水平升高有关,这些细胞因子可以引起进一步的肾损伤[13]。而且,动物实验中,CKD大鼠血清中Th1细胞比例升高,Tregs比例下降,且肾组织中IFN-γ、TNF-α mRNA和蛋白表达水平明显下降[14]。临床研究发现,Th1细胞相关炎症因子在CKD患者肾脏组织损伤中发挥重要作用,包括IFN-γ和IL-2等[15]。
综上所述,DKD患者体内存在CD4+T细胞稳态失衡,表现为CD4+T细胞亚群向促炎方向极化,外周血促炎Th1表达升高,抗炎Tregs表达下降。而且,T2DM患者外周血CD4+T细胞异常与eGFR水平下降密切相关,提示CD4+T细胞稳态失衡或参与了DKD发生发展。

