ANGPTL2 基因甲基化及临床指标与冠心病病变程度的关联性研究
陈丽,周建庆,廉姜芳
血管生成素样蛋白2(ANGPTL2)基因位于人类基因的9 号染色体,作为一种在心脏等器官丰富表达的分泌型糖蛋白,ANGPTL2 蛋白与心血管疾病之间存在密切的联系[1-2]。但ANGPTL2 在冠心病中的具体机制尚不清楚。笔者前期研究证实了ANGPTL2 基因启动子区的低甲基化水平与冠心病的发病风险存在关联[3]。本实验进一步探索ANGPTL2启动子位置甲基化水平与冠心病严重程度的关系,同时探讨临床常见指标与冠脉病变程度的相关性,报道如下。
1 资料与方法
1.1 一般资料 选取宁波市医疗中心李惠利医院2018 年1 月至2019 年1 月期间行冠脉造影的134 例患者,排除:(1)左室射血分数(LVEF)<35%的重度心功能不全;(2)先天性心脏病;(3)感染性发热;(4)糖耐量异常;(5)严重肾脏、肝脏功能异常;(6)癌症;(7)有器质性心脏病;(8)患有风湿免疫系统疾病。其中冠心病组94 例,正常冠脉组40 例。入选的所有患者都了解研究目的并知情同意,且签署同意书。
1.2 方法
1.2.1 临床资料收集 收集患者基本资料,包括年龄、性别、是否抽烟、是否患有高血压、以及生化指标{总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDLC)、高密度脂蛋白(HDL-C)、载脂蛋白A(ApoA)、载脂蛋白B(ApoB)、载脂蛋白E(ApoE)、脂蛋白a[Lp(a)]、C反应蛋白(CRP)、白蛋白(ALB)、球蛋白(GLB)}。
1.2.2 评定标准[4]所有患者均行冠状动脉造影手术。依据冠脉造影结果和病变累及范围将病变组分为单支、双支和多支病变组。对不同患病组的参与者分别进行Gensini 评分。
1.2.3 检测指标 采集参与者静脉血8ml,使用基因组抽提试剂盒提取外周血标本的基因组DNA。得到的基因组DNA 使用亚硫酸氢盐方法处理,对甲基化的DNA 碱基进行转化修饰,然后纯化回收,通过PCR 扩增DNA 序列。由Pyro-Mark Assay Design 2.0 设计引物序列(表1),最后应用焦磷酸测序分析不同CpG位置的甲基化程度(图1)。
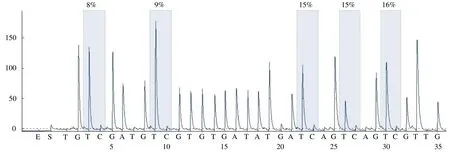
图1 ANGPTL2 基因某一样本的焦磷酸测序结果
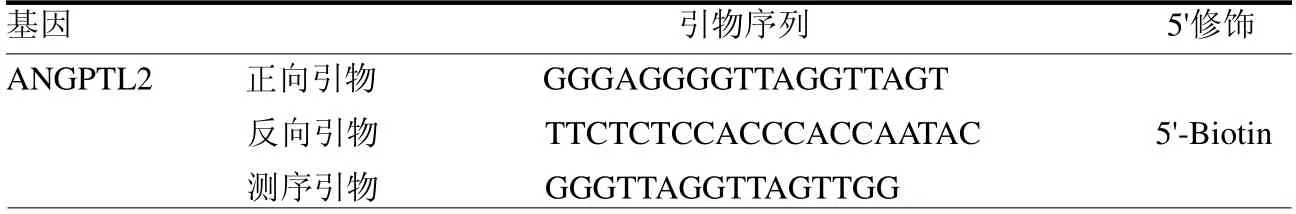
表1 ANGPTL2 基因引物
1.3 统计方法 采用SPSS 21.0 统计软件进行处理。正态分布计量资料以均数±标准差表示,两组比较独立样本t 检验,多组比较采用单因素方差分析;非正态分布计量资料以M(P25,P75)表示,多组比较运用Cruskal-Wallis H 检验,两组比较运用Mann-Whitney U 检验;计数资料用2检验;相关性分析采用Pearson相关分析或Spearman 相关分析。P <0.05为差异有统计学意义。
2 结果
2.1 不同冠脉病变支数的冠脉造影Gensini 评分比较 不同冠脉病变支数组Gensini 评分差异有统计学意义(P <0.05),其中多支冠脉病变组Gensini 评分大于双支病变组和单支病变组的评分(均P <0.05),双支组和单支组的评分差异无统计学意义(P >0.05)。见表2。2.24 组临床特征分析 与正常冠脉组比,多支冠脉病变组中男性明显多于女性(P <0.05),高血压和吸烟人数更多(均P <0.05)。4 组Lp(a)、CRP 水平差异均有统计学意义(均P <0.05)。见表3。
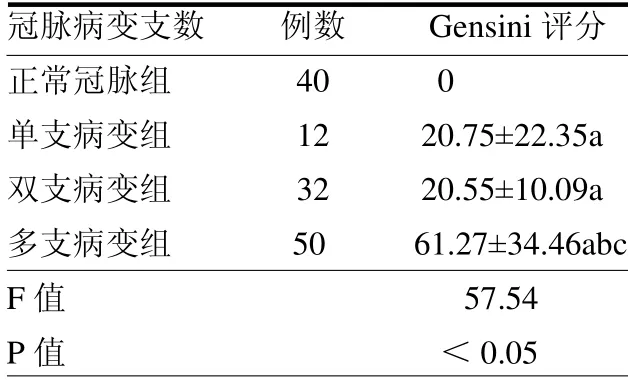
表2 同冠脉病变支数的冠脉造影Gensini 评分比较 分
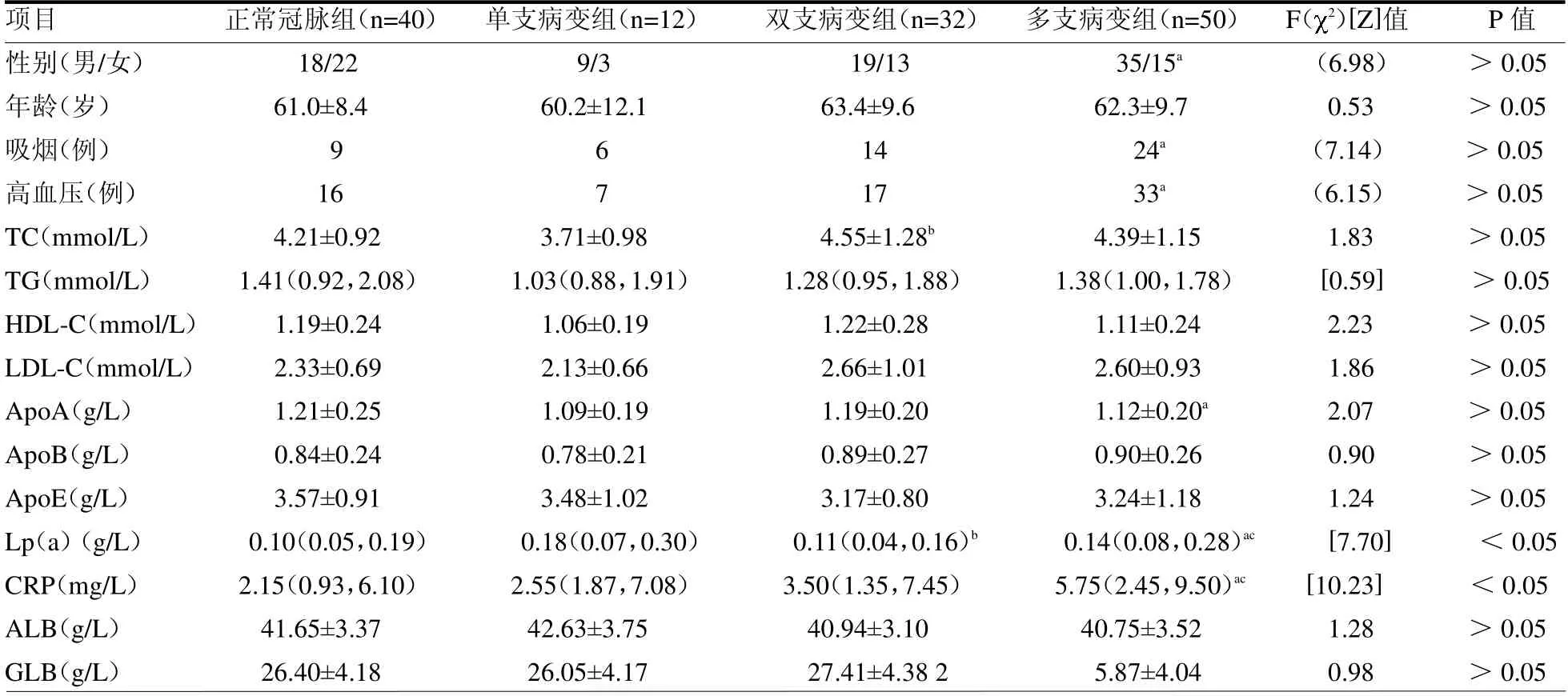
表3 4 组临床特征比较
2.3 ANGPTL2 甲基化程度与冠脉病变支数的相关性 CpG4 位点与其他位点之间r <0.8,相关性不大。其余四个位点(CpG1、CpG2、CpG3、CpG5)两两之间r >0.8,存在较高相关性。因此本研究只分析这4 个位点平均甲基化水平和CpG4 单个位点的甲基化水平。4 组CpG1、CpG2、CpG3、CpG5 的甲基化均值和CpG4 甲基化值差异均有统计学意义(均P <0.05),正常冠脉组的CpG1、CpG2、CpG3、CpG5 甲基化水平高于冠脉病变各组,而多支病变组低于单支和双支组(均P <0.05);多支病变组的CpG4 甲基化水平低于其他组(均P <0.05),而单支和双支病变组与正常冠脉组相近。见表4。Gensini评分与CpG1235位点以及CpG4 位点的甲基化水平密切相关(r=-0.415、-0.205,均P<0.05)。

表4 4 组ANGPTL2 基因启动子区甲基化程度比较
3 讨论
ANGPTL2 作为一种血管内皮生长因子,可以通过多种调控途径在生理及病理生理上起到重要作用。此外,其也可以通过激活内皮细胞内的炎症信号促进血管的炎症反应,从而导致动脉粥样硬化的生成与发展[5]。脂肪组织在分泌促炎细胞因子的同时还分泌脂联素等抗炎因子,两者间存在一种动态平衡,这种平衡发生紊乱,就会导致慢性炎症状态。ANGPTL2 也是一种脂肪因子,因此它在血管壁慢性炎症中也发挥着重要作用[2,6]。有研究报道ANGPTL2 可以阻遏血小板的聚集和活化[7],这提示ANGPTL2 一方面能够促进血管的炎症反应,而另一方面又起到了防止血栓形成的作用。
有研究证实ANGPTL2 蛋白与冠脉病变严重程度存在密切联系[8]。本研究显示不同冠脉病变支数组Gensini评分、Lp(a)及CRP水平差异均有统计学意义(均P <0.05)。本研究进一步探究了ANGPTL2基因启动区5 个位点(CpG1、CpG2、CpG3、CpG4、CpG5)的甲基化水平与冠脉病变严重程度的相关性。实验证实ANGPTL2 基因启动子区域的CpG位点甲基化水平与Gensini评分呈负相关性。单支、双支和多支病变组的CpG1、CpG2、CpG3、CpG5 位点的甲基化水平低于正常冠脉组,其中多支病变组所有CpG位点甲基化程度均低于正常冠脉组、单支病变组和双支病变组,但是本研究未发现单支与双支病变组间各个位点甲基化水平存在显著差异,这可能需要扩大样本量后进一步研究。有研究证实基因启动子区的甲基化能够有效降低转录因子与启动子的结合能力,从而影响下游基因的转录[9],因此推测ANGPTL2 的CpG 位点甲基化水平越低,外周血中ANGPTL2 蛋白表达越高,冠脉狭窄越严重。这可能是由于ANGPTL2 蛋白促进冠状动脉血管壁炎症、巨噬细胞的浸润以及血栓形成,进而导致动脉粥样硬化发生。
本研究初步揭示了ANGPTL2 基因启动子区甲基化水平与冠脉病变严重程度呈负相关,为后续研究ANGPTL2 与冠状动脉疾病的具体联系提供了相关临床数据,将有助于冠心病的临床治疗。但本实验并未证实ANGPTL2 基因甲基化与冠心病之间的因果关系,需要进一步队列研究。同时本研究检测了相关临床指标与冠心病之间的相关性,明确冠心病危险因素和保护因素,为冠心病的预防和治疗提供理论依据。

