马氏珠母贝肉提取物对小鼠急性酒精性肝损伤的影响
王利霞,章超桦,2,高加龙,2,郑惠娜,2,曹文红,2,秦小明,2,陈建平,2
马氏珠母贝肉提取物对小鼠急性酒精性肝损伤的影响
王利霞1,章超桦1,2,高加龙1,2,郑惠娜1,2,曹文红1,2,秦小明1,2,陈建平1,2
(1. 广东海洋大学食品科技学院 // 国家贝类加工技术研发分中心(湛江)// 广东省水产品加工与安全重点实验室 // 广东省海洋生物制品工程实验室 // 水产品深加工广东普通高等学校重点实验室,广东 湛江 524088;2. 大连工业大学海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
【】探讨马氏珠母贝()肉提取物对小鼠急性酒精性肝损伤(alcoholic liver disease,ALD)的解酒护肝作用。采用碱溶酸沉法提取贝肉蛋白质,酶解超滤后制备截留分子质量为< 3 ku(F-Ⅰ)、3 ~ 8 ku(F-Ⅱ)、> 8 ku(F-Ⅲ)的超滤组分,同时采用水提法制备马氏珠母贝肉全脏器水提物。以急性酒精性肝损伤小鼠为模型,以小鼠血清生化指标(谷丙转氨酶ALT、谷草转氨酶AST)、肝脏生化指标(超氧化物歧化酶SOD、谷胱甘肽GSH、甘油三酯TG、丙二醛MDA、乙醇脱氢酶ADH和乙醛脱氢酶ALDH)和肝脏病理切片为指标评价各提取物对急性酒精性肝损伤的改善作用,并对抗肝损伤活性较高组分进行氨基酸含量测定及质谱结构鉴定。与模型组相比,贝肉蛋白酶解超滤组分和水提物组均能极显著降低小鼠血清中ALT和AST活性(< 0.01),降低肝脏中MDA、TG含量(< 0.05),显著提高小鼠肝脏中SOD、GSH含量(< 0.05)、ADH、ALDH活性(< 0.01),改善肝脏组织的病理状况,缓解细胞坏死、炎症等病理状态。氨基酸检测结果显示,F-Ⅰ组分及水提物中氨基酸组成全面,水提物中牛磺酸含量是F-Ⅰ组分的2倍左右。质谱结果表明F-Ⅰ组分、水提物分别包含15、20种主要肽片段。马氏珠母贝肉蛋白酶解超滤组分和水提物对急性ALD具备保护作用,其中F-Ⅰ组分、水提物效果更佳,其改善机制与增强机体抗氧化能力、促进乙醇代谢能力有关。
马氏珠母贝;酶解液;水提物;急性酒精性肝损伤
酒精性肝损伤(alcoholic liver disease,ALD)是一种由于长期滥用酒精而造成的肝损伤疾病。当机体短时间过量饮酒时,会导致急性酒精性肝损伤,大量的酒精使得血液酒精含量增高,并常导致氧化应激、线粒体功能障碍以及乙醛等代谢物的生成等多种不良反应[1]。因此加速酒精在机体中的分解可减少有害物质在血液中的保留,对预防肝脏疾病和由酒精摄入引起的机体损害非常重要[2]。目前从陆生植物、动物和水产品中提取护肝活性物质均已有报道[3-5],其中对贝类解酒护肝活性物质的研究越来越多,如三角帆蚌()[6]、企鹅珍珠贝()[7]、河蚬()[8]、牡蛎(Oyster)[9]和马氏珠母贝()[10]等均被证明能显著降低血液中乙醇浓度或改善酒精性脂肪肝。
马氏珠母贝在我国主要分布于广东、海南和广西等南海海域[11],是重要的经济贝类。马氏珠母贝肉含有丰富的蛋白质、糖原、氨基酸、肽类、维生素及Se、Zn等微量元素。现代研究表明马氏珠母贝多具有抗氧化、增强免疫[12]、促进皮肤创伤愈合[13]、抗肿瘤、解酒护肝[10,14-15]等活性功效。
高加龙[14]报道,马氏珠母贝肉全脏器酶解产物及牛磺酸具有解酒和抗急性酒精性肝损伤作用。韩丽娜等[10]证明,除牛磺酸外马氏珠母贝肉中糖原也具有醒酒活性。钟佳佳等[15]制备马氏珠母贝肉全脏器酶解产物并进行超滤分级,动物试验结果表明,分子质量< 3 ku超滤组分具有较好的抗ALD活性,推测小分子肽起重要作用。贝肉全脏器酶解产物含有多肽、多糖、氨基酸等多种活性物质,除糖原、牛磺酸外,目前尚未见马氏珠母贝中其他成分具有护肝活性的研究报道。基于此,本研究分离贝肉蛋白并制备蛋白酶解超滤组分,与贝肉全脏器水提物对照,以急性酒精性肝损伤小鼠为动物模型,探究各组分的护肝活性,并对护肝活性较强的组分进行氨基酸组成、牛磺酸含量测定及多肽结构分析,为进一步明确醒酒护肝有效成分结构和开发马氏珠母贝肉抗酒精性肝损伤功能性食品提供研发基础。
1 材料与方法
1.1 材料
1.1.1 材料与实验动物 马氏珠母贝采于广东省雷州市流沙养殖场;壳长10 cm,开壳取全脏器,每500 g分装于−80 ℃冰箱备用。
SPF级雄性健康KM小鼠,5周龄,购于广州迪恩基因技术有限公司,实验动物使用许可证号SCXK(京)20200004。小鼠饲养环境:广东海洋大学SPF级动物房,温度(24±2)℃,湿度50% ~ 60%,昼夜12 h/12 h交替,自由摄水进食。
1.1.2 试剂与设备 56°二锅头白酒,北京红星股份有限公司,市售;中性蛋白酶(2×105U/g)、木瓜蛋白酶(2×105U/g)购于广西南宁庞博生物科技有限公司;水飞蓟素购于上海源叶生物科技有限公司;乙醇脱氢酶(ADH)、乙醛脱氢酶(ALDH)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)、丙二醛(MDA)、还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)试剂盒均购于南京建成生物工程研究所。
DU-1100型真空冷冻干燥机(日本东京理化器械株式会社);Varioskan Flash型全自动酶标仪(赛默飞世尔科技中国有限公司);L-8900全自动凯氏定氮仪(德国格哈特分析仪器有限公司);Thermo Lynx-6000型高速落地离心机(赛默飞世尔科技中国有限公司);R-1005型旋转蒸发仪(郑州长城科工贸有限公司);Q-EXACTIVE质谱仪(Thermo Fisher Scientific,San Jose,CA)。
1.2 方法
1.2.1 马氏珠母贝肉蛋白质酶解超滤组分的制备
取马氏珠母贝肉全脏器,解冻后按料液质量(g)体积(mL)比1∶3加入蒸馏水匀浆,将匀浆液用1 mol/L NaOH调pH至12,4 ℃下匀速搅拌3 h,在10 000 r/min、4 ℃下离心15 min,取上清液,用1 mol/L盐酸调节pH至4.5,4 ℃静置1 h,10 000 r/min、4 ℃下离心15 min得马氏珠母贝肉蛋白[16]。参照韩丽娜等[10]方法酶解制备马氏珠母贝肉蛋白酶解液,将所得的酶解液依次通过截留分子质量为8、3 ku的超滤膜,得到分子质量> 8 ku(F-Ⅲ)、3 ~ 8 ku(F-Ⅱ)、< 3 ku(F-Ⅰ)的超滤组分,经蒸发浓缩、冷冻干燥后贮存备用。
1.2.2 马氏珠母贝肉水提物的制备 参照谢晓霞[17]方法并稍加修改制备马氏珠母贝肉水提物。将马氏珠母贝肉全脏器按料液质量(g)体积(mL)比1∶3加入水匀浆后置于沸水中煮沸30 min,迅速冷却后以8 000 r/min离心15 min,收集上清液,经蒸发浓缩、冷冻干燥后贮存备用。
1.2.3 体内急性酒精性肝损伤小鼠模型建立 将49只5周龄KM小鼠适应性喂养7 d后,随机分成空白对照组、酒精模型组、水飞蓟素组、水提物组、F-Ⅰ组、F-Ⅱ组、F-Ⅲ组,每组7只。其中水提物组、F-Ⅰ组、F-Ⅱ组、F-Ⅲ组每天按小鼠体质量200 mg/kg的剂量[18]分别灌胃马氏珠母贝肉水提物、F-Ⅰ组分、F-Ⅱ组分、F-Ⅲ组分,水飞蓟素组以体质量50 mg/kg标准灌胃水飞蓟素,空白对照组、酒精模型组则灌胃等体积生理盐水。30 min后,各组小鼠分别按体质量12 mL/kg剂量灌胃56°红星二锅头,空白对照组给予等量生理盐水,连续灌胃8 d[8]。每次灌胃前监测小鼠体质量。
1.2.4 小鼠肝脏指数及血清生化指标测定 8 d灌胃完成后,禁食不禁水16 h,摘眼球取血并全血静置15 min后,以3 000 r/min、4 ℃条件离心10 min取上清液,分装贮于-80 ℃保存备用。对小鼠脱颈处死,迅速摘取肝脏组织,记录肝脏的体质量(精确值0.01 g),肝脏指数(%)计算如下:
肝脏指数= 肝脏质量 / 小鼠最终体质量。
取每只小鼠肝脏相同部位约0.2 g,置于质量分数为4%多聚甲醛中固定,其余部分-80 ℃保存备用。按照试剂盒说明书测定血清中谷丙转氨酶ALT、谷草转氨酶AST的水平。
1.2.5 肝脏生化指标测定 向肝脏组织中加入一定体积预冷的生理盐水,匀浆制成质量分数10%组织匀浆液,以3 000 r/min、4 ℃条件离心10 min,取上清液进行分装,按照试剂盒说明书测定肝脏上清液的蛋白浓度、ADH、ALDH、SOD、MDA、TG、GSH。
1.2.6 病理学检查 将固定于质量分数为4%多聚甲醛溶液中的小鼠肝脏取出,经常规清除及脱水后,石蜡包埋,通过苏木精-伊红染色,于显微镜下进行病理学观察。
1.2.7 氨基酸含量测定 将贝肉提取物中活性较好组分进行氨基酸组成测定,方法参照食品安全国家标准GB 5009.124-2016[19]。
牛磺酸含量测定方法参照GB 5009.169-2016《食品安全国家标准食品中牛磺酸的测定》[20]。
1.2.8 ESI MS/MS质谱鉴定 样品上机于串联ESI质谱仪。一级质谱分辨率设置为70 000(质荷比/半峰宽)。用碰撞能量为27的HCD(Higher Energy Collisional Dissociation)模式对肽段进行筛选,二级碎片在Orbitrap中检测,分辨率为17 500。每个峰强度超过20 000的一级母离子打15个二级谱图,一级扫描和二级扫描交替进行。动态排除设定为:15 s相同的母离子打二级不会超过2次。离子源电压设置为1.6 kV。AGC(Automatic gain control)通过Orbitrap来实现,其设置为:对Orbitrap内控制聚集量在1e5到3e6之间的离子进行二级扫描鉴定。扫描的质荷比(m/z)范围为350 ~ 2 000。用Mascot search engine进行肽段和蛋白的鉴定,并在数据库搜索设置为:容错率为一级20×10-6,二级0.1 u。
1.3 数据分析
每组数据平行测定3次,数据结果表示为平均值±标准偏差,使用SPSS 20.0进行单因素均值比较(ANOVA),选用LSD法进行组间显著性分析。#代表与空白组相比,有显著差异(< 0.05),##代表与空白组相比,有极显著差异(< 0.01),*代表与模型组相比,有显著差异(< 0.05),**代表与模型组相比,有极显著差异(< 0.01)。
2 结果与分析
2.1 马氏珠母贝各提取物对小鼠肝脏指数的影响
酒精的急剧摄入会导致肝脏受损、肿大,因此,肝脏指数常作为肝脏受损与否的观测指标之一。表1小鼠肝脏指数显示,相较于空白组,模型组小鼠肝脏系数有显著上升(< 0.05),增长了11.48%,给予样品干预后,水飞蓟素组、F-Ⅰ组小鼠的肝脏系数均显著降低(< 0.05),其余各组虽有下降趋势,但并无显著差异(> 0.05),表明马氏珠母贝肉提取物各组分能不同程度的缓解酒精造成的肝脏肿大问题。
2.2 马氏珠母贝各提取物对小鼠血清谷丙转氨酶AST、谷草转氨酶ALT活性的影响
由表2可知,与空白组相比较,模型组小鼠血清中ALT、AST的活性极显著上升(< 0.01),说明造模成功。而与模型组相比,F-Ⅰ、F-Ⅱ、F-Ⅲ及水提物组均能极显著降低ALT、AST的生成(< 0.01),结果表明,马氏珠母贝肉提取物对酒精性肝损伤有一定的保护作用。
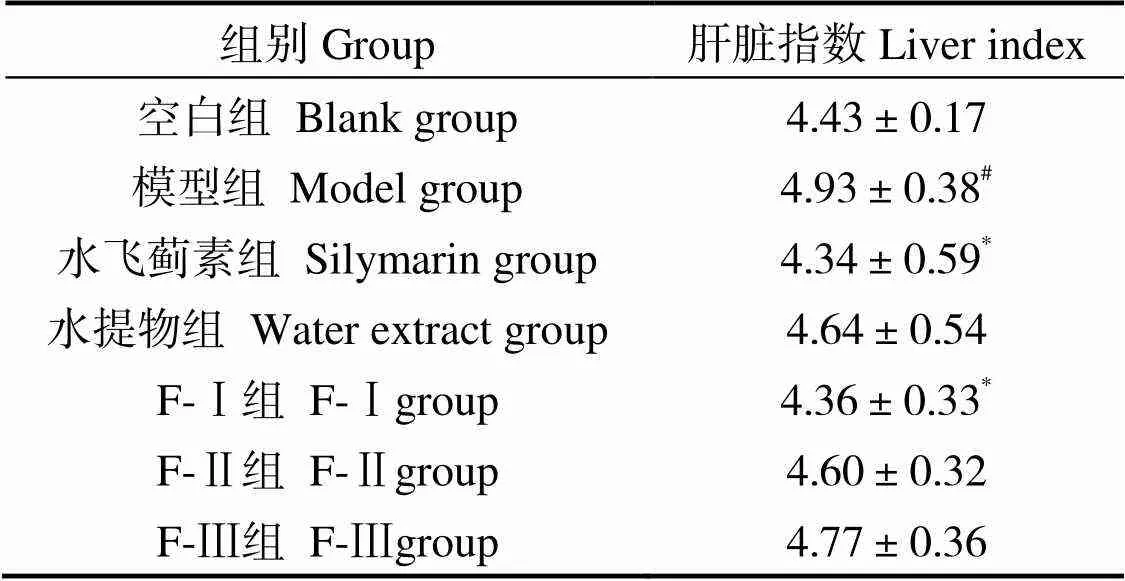
表1 马氏珠母贝肉蛋白酶解物超滤组分和全脏器水提物对各组小鼠肝脏指数的影响
注:与空白组相比,#表示< 0.05;与模型组相比,*表示< 0.05;未标标识表示差异不显著(> 0.05);= 7
Notes:Compared to blank group, # means< 0.05; Compared to model group, * means< 0.05; The difference between the unmarked marks is not significant(> 0.05);= 7
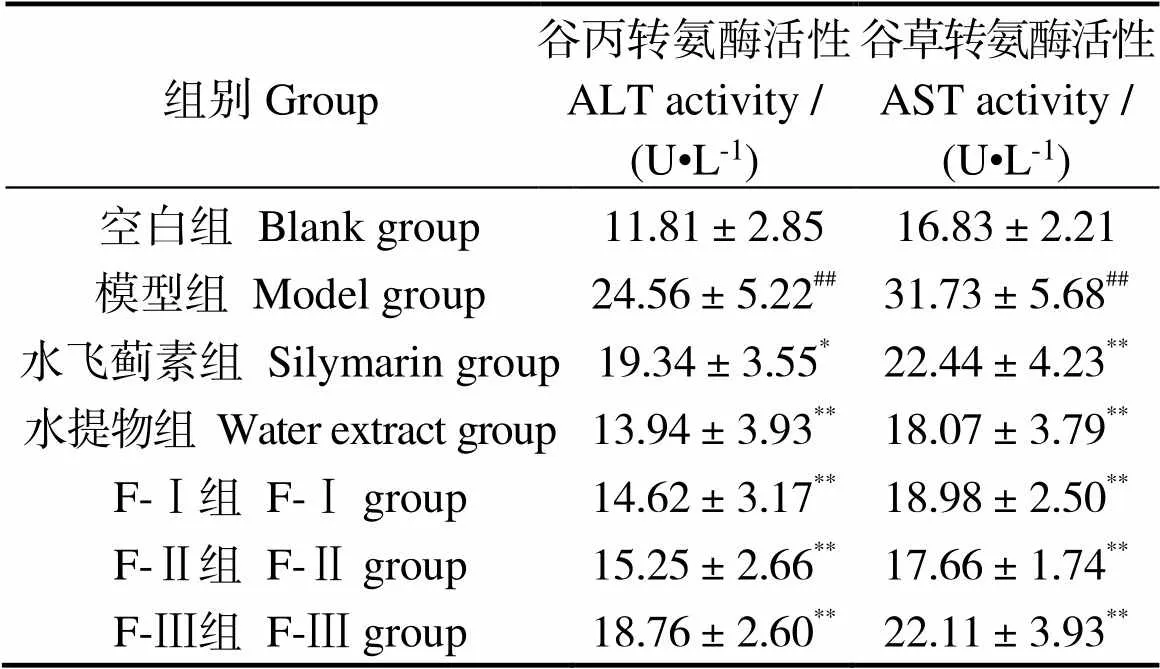
表2 马氏珠母贝肉蛋白酶解物超滤组分和全脏器水提物对各组小鼠血清谷丙转氨酶、谷草转氨酶活性的影响
注:与空白组相比,##表示0.01;与模型组相比,*表示< 0.05, **表示< 0.01;= 7
Notes: Compared to blank group, ##,< 0.01; compared to model group, * means< 0.05, and ** means< 0.01;= 7
2.3 马氏珠母贝各提取物对小鼠酒精代谢酶学指标的影响
表3结果显示,与空白组相比,模型组中ADH、ALDH活性均有略微下降;与模型组相比,阳性对照水飞蓟素组有显著提升(< 0.01),马氏珠母贝肉水提物、组分F-Ⅰ、F-Ⅱ、F-Ⅲ中ADH、ALDH活性均显著上升(< 0.01),说明马氏珠母贝肉提取物能够提升乙醇代谢酶活性,促进乙醇在肝脏中的代谢效率,缓解乙醇及其代谢产物产生的损伤。
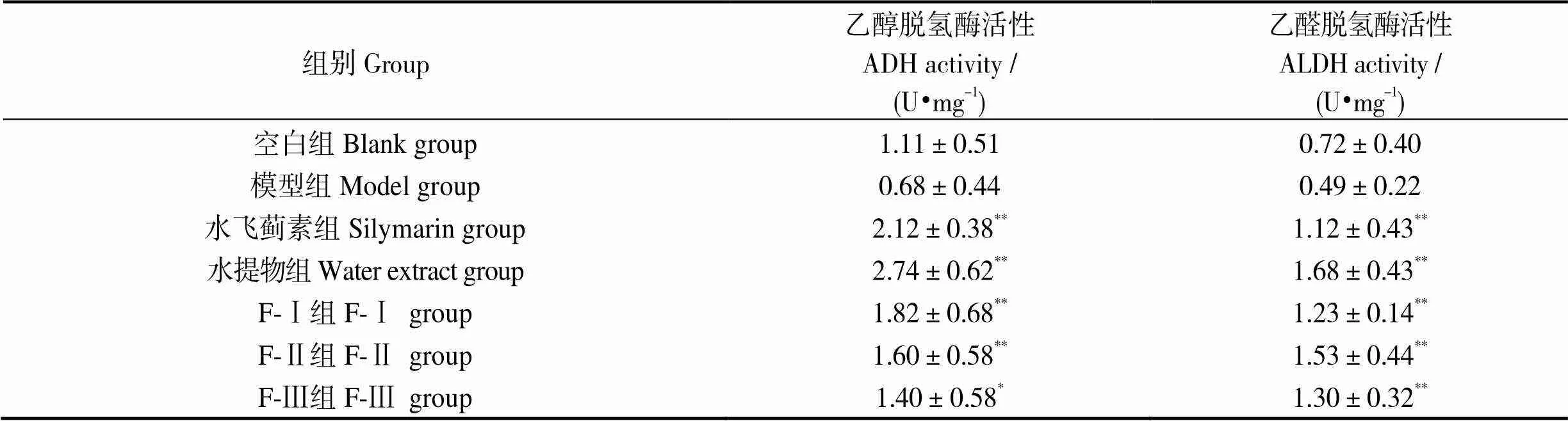
表3 马氏珠母贝肉蛋白酶解物超滤组分和全脏器水提物对各组小鼠肝脏乙醇脱氢酶、乙醛脱氢酶活性的影响
注:与模型组相比,*表示< 0.05,**表示< 0.01;未标标识表示差异不显著(> 0.05);= 7
Notes: Compared to model group, *,< 0.05, **,< 0.01; the difference between the unmarked marks is not significant(> 0.05);= 7
2.4 马氏珠母贝各提取物对小鼠肝脏中氧化应激相关指标的影响
由表4可知,与空白组相比,模型组小鼠肝脏中SOD水平、GSH水平极显著下降(< 0.01),而MDA、TG含量极显著上升(< 0.01),小鼠各项指标水平的显著变化表明造模达成。与模型组相比,水飞蓟素组、水提物组、F-Ⅰ组能极显著提高SOD、GSH的水平(< 0.01),F-Ⅱ组能显著提升SOD水平(< 0.05),对于GSH水平无显著改变(> 0.05),F-Ⅲ组中SOD、GSH水平无显著变化(> 0.05);而水飞蓟素组、F-Ⅰ组、水提物、能显著降低MDA(< 0.05)、TG(< 0.01)的含量,F-Ⅱ组能显著降低MDA、TG含量(< 0.05),F-Ⅲ组对MDA含量无显著变化(> 0.05),但能显著降低TG含量(< 0.05)。上述结果表明,酒精导致小鼠的氧化应激和肝氧化损伤,而经马氏珠母贝肉提取物干预后,各症状均明显改善。
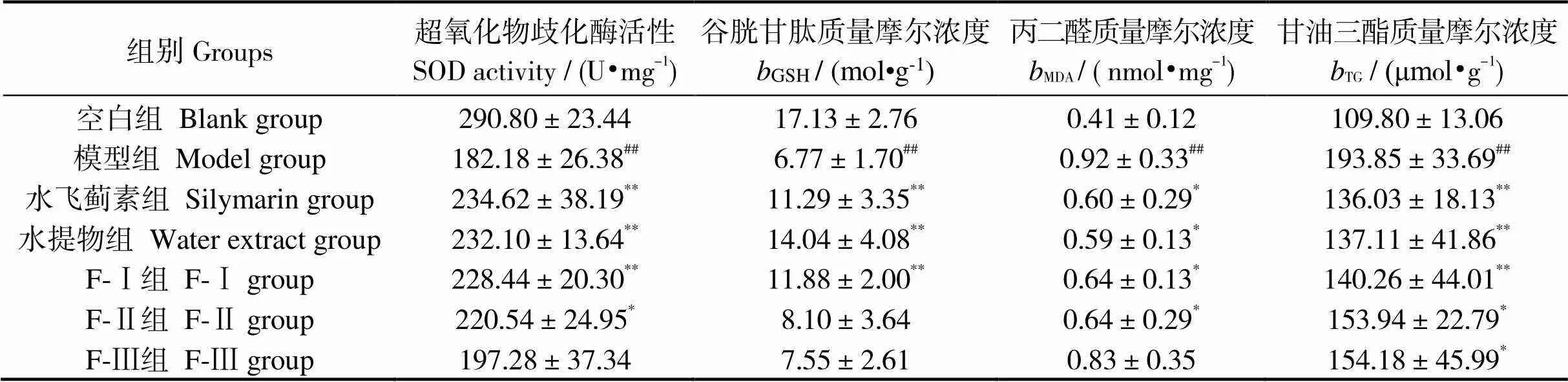
表4 马氏珠母贝肉蛋白酶解物超滤组分和全脏器水提物对各组小鼠肝脏超氧化物歧化酶活性,谷胱甘肽、丙二醛、甘油三酯含量的影响
注:与空白组相比,##表示< 0.01;与模型组相比,*表示< 0.05,**表示< 0.01;未标标识表示差异不显著(> 0.05);= 7
Notes: Compared to blank group, ##,< 0.01; compared to model group, *,< 0.05, **,< 0.01; the difference between the unmarked marks is not significant(> 0.05);= 7
2.5 马氏珠母贝肉蛋白酶解物超滤组分和全脏器水提物组织病理学分析
图1显示,空白组肝索结构清晰,肝细胞排列紧密,胞浆内无脂滴,组织未见坏死、炎症等其他病理改变;模型组肝细胞广泛肿胀,有局部肝细胞灶性坏死,胞核溶解,胞浆嗜酸性增强,伴较多炎性细胞浸润现象。与模型组相比,水飞蓟素组,及马氏珠母贝肉各提取物组肝组织细胞症状有所改善,其中水飞蓟素组肝组织肝索结构清晰,细胞轻度肿胀,组织未见明显脂肪变性;F-Ⅰ组肝细胞排列紧密,细胞少量轻微肿胀,组织未见其他明显异常;F-Ⅱ组肝细胞排列紧密,肝细胞广泛肿胀,小叶偶见肝细胞点状坏死;F-Ⅲ组肝组织肝索结构清晰,胞浆疏松淡染,小叶偶见几处炎性细胞小灶性浸染,未见其他明显异常;而水提物组肝索结构清晰,肝细胞排列紧密,细胞广泛肿胀,未见其他明显异常。组织病理学观察结果表明,各样品提取物组肝细胞坏死有所减少,且细胞的界限完整,细胞形态有改善变好现象,F-Ⅰ组、水提物组更为明显,可能是马氏珠母贝肉超滤组分、水提物中和了肝损伤产生的自由基,增强了肝脏的抗氧化和抗炎能力,从而降低了乙醇引起的肝损伤[21]。
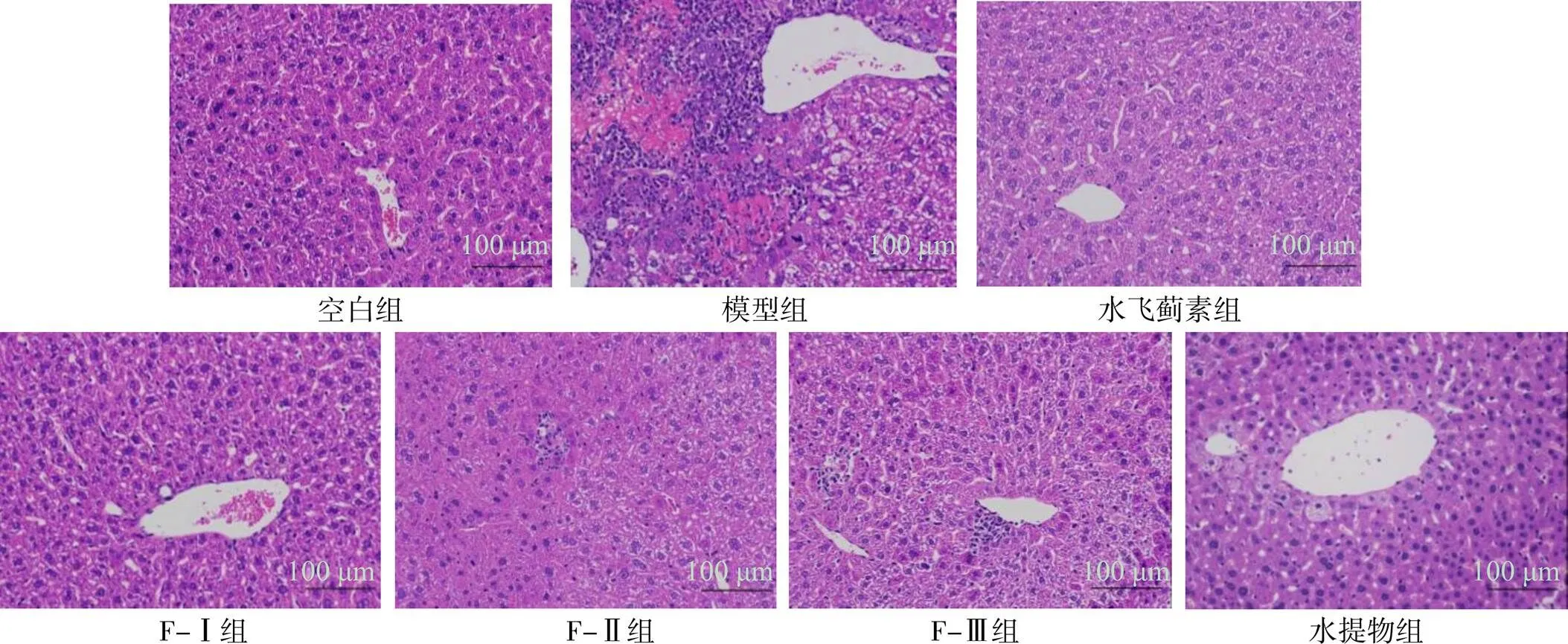
图1 马氏珠母贝肉蛋白酶解物超滤组分和全脏器水提物对各组小鼠肝脏HE染色的影响(n = 7)
2.6 马氏朱母贝超滤组分F-Ⅰ及水提物氨基酸质量分数结果分析
选择急性酒精性肝损伤小鼠指标中活性较优组分F-Ⅰ组及水提物组进行氨基酸组成分析,结果见表5。在F-Ⅰ组、水提物组中的16种氨基酸中,F-Ⅰ组分天冬氨酸(10.22%)、谷氨酸(14.51%)、亮氨酸(8.86%)、赖氨酸(9.09%)质量分数较高,游离氨基酸中,亮氨酸(10.80%)、酪氨酸(7.51%)、苯丙氨酸(30.30%)、精氨酸(11.74%)质量分数较高,而水提物组分中,天冬氨酸(9.92%)、谷氨酸(17.70%)、甘氨酸(14.03%)、丙氨酸(8.81%)质量分数较高,游离氨基酸中,谷氨酸(16.85%)、甘氨酸(33.84%)、丙氨酸(15.21%)、精氨酸(11.78%)比例较高。同时,在水解氨基酸中,F-Ⅰ组分及水提物组分中必需氨基酸含量分别占总氨基酸含量的41.06%和29.16%,支链氨基酸占比分别为19.38%、13.81%,疏水性氨基酸占比分别为36.40%、31.47%。F-Ⅰ组分中牛磺酸质量分数为2.71%,水提物中牛磺酸质量分数为5.38%。
2.7 马氏朱母贝超滤组分F-Ⅰ及水提物ESI-MS/ MS鉴定
经ESI-MS/MS鉴定,F-Ⅰ组分中得分较高的蛋白质,分别为putative actin 00526、putative paramyosin-3、myosin essential light chain,从其中挑选出15条多肽得分较高的多肽序列,结果见表6;水提物组分中得分较高的蛋白质主要是tropomyosin-1 tropomyosin-2、putative actin 00526,从中挑选出20条得分较高的主要多肽序列。F-Ⅰ的多肽一级结构多由6 ~ 14个氨基酸组成,水提物多肽由9 ~ 16个氨基酸组成。
注:*,必需氨基酸;#,疏水性氨基酸;-,未检出
Note: *, Essential amino acids; #, Hydrophobic amino acids; -, Not detected
3 讨论
ALT、AST是肝脏中两种主要的转氨酶,ALT主要存在于肝细胞浆中,80%的AST存在于肝细胞线粒体中。机体将乙醇代谢为乙醛的过程中,常伴有自由基和致癌物质的产生,从而会刺激炎症反应,肝脏受到损伤[22],肝细胞通透性增加,造成细胞质中ALT酶活升高,渗透于血液中,若肝细胞出现更严重的坏死现象,其主要存在于线粒体中的AST酶也会释放[22-23]。因此,ALT、AST酶含量的变化可反映肝脏中细胞的损伤及细胞膜功能完整性的丧失的程度[24]。本研究表明,模型组小鼠血清ALT、AST极显著升高,病理组织切片呈现出局部肝细胞灶性坏死且伴较多炎性细胞浸润的现象,而马氏珠母贝肉各提取物组能显著降低ALT、AST的水平,且肝细胞坏死有所减少,细胞形态有改善变好现象。
酒精代谢主要包含三条途径,其中最主要的是细胞质基质上的乙醇脱氢酶系代谢途径,80% ~ 90%的酒精都经此途径[25]。此过程中主要由两种酶(ADH、ALDH)发挥作用,乙醇先通过ADH被催化生成乙醛,后被ALDH催化成为乙酸,乙酸在三羧酸循环中氧化成为二氧化碳和水[26]。本研究结果显示,相比于空白组,模型组小鼠肝脏ADH、ALDH活性下降,与模型组比较,马氏珠母贝肉各提取物组能显著提升ADH、ALDH活性,酒精代谢增快。
乙醇代谢常常会伴有机体氧化应激反应,体内抗氧化防御机制将有所降低,ROS生成的速率超过肝脏天然酶和非酶抗氧化剂中和它们的能力[27],而过度的氧化损伤会引起脂质过氧化,导致脂质代谢受到损害,损伤肝细胞。对于这种危害,机体内酶促和非酶促的抗氧化反应是防止氧化损伤主要手段之一,所以内源性酶促抗氧化剂SOD及非酶抗氧化剂GSH常作为评价氧化应激的指标[28-29],而TG、MDA是肝脏脂肪变性,脂质过氧化的产物,能够破坏抗氧化防御系统,引起肝细胞变性,常用于评估脂质代谢。在本研究中,模型组小鼠能显著降低SOD、GSH水平,增加MDA、TG含量,而各提取物干预后,除F-Ⅲ组外,其余各组能明显提升肝脏SOD、GSH活性,降低MDA、TG含量。该结果表明,马氏珠母贝水提物和F-Ⅰ、F-Ⅱ超滤组分可通过提升抗氧化能力,抑制脂质过氧化减轻酒精产生的肝损伤。这一结论符合《保健食品检验与评价规范》中判定物质是否具有肝损伤辅助保护功能的要求,即肝脏MDA、GSH、TG三指标中任意二指标和病理组织学检验为阳性才可判定受试样品具有辅助保护功能[30]。
Xiao等[18]研究发现,包括Ala、Pro在内的疏水性氨基酸和短肽的吸收可能导致细胞质疏水性增加,激活ADH,促进乙醇的代谢,而Leu、Ala、Arg等有助于NAD+的生成,增强酒精代谢能力。本实验结果显示,水提物组中游离氨基酸占总氨基酸含量的比例为21.14%,明显高于F-Ⅰ组比例7.43%,其中水提物组Pro(5.89%)、Ala(15.21%)含量高于F-Ⅰ组Pro(0%)、Ala(6.34%)的含量。牛磺酸测定结果显示,水提物中牛磺酸的含量是F-Ⅰ超滤组分的2倍左右,王文杰等[31]发现,牛磺酸在一定程度上抑制小鼠酒精性肝损伤的发生。本研究中F-Ⅰ超滤组分和水提物均能够显著改善小鼠酒精性肝损伤症状,但二者并无显著差异,说明马氏珠母贝提取物中除牛磺酸外还含有其他护肝活性物质。质谱结果显示,F-Ⅰ、水提物中肽段均至少包含一个疏水性氨基酸(Leu、Ala、Ile),其中F-Ⅰ80%的肽段序列中疏水性氨基酸的比例超过30%,而水提物中较高,有88%的序列超过。Zhao等[32]研究发现,人工合成疏水性肽经验证具有激活ADH活性的能力,因此,F-Ⅰ组、水提物组中这些肽段可能具有较好的活性,活性大小与其肽分子质量、肽链中疏水性氨基酸数目位置以及其构型有关,但对于马氏珠母贝护肝肽的具体结构和作用机理仍需进一步阐明。
4 结论
马氏珠母贝肉水提物、蛋白酶解超滤组分具有较好的抗ALD活性,能从加快乙醇代谢,减轻乙醇及其代谢产物对机体产生的氧化应激危害等方面进行抗ALD干预,对酒精性肝损伤具有一定的保护作用,可提高酒精代谢酶ADH、ALDH的活性,提高SOD、GSH的抗氧化指标水平,降低血清代谢酶AST、ALT活性及脂质代谢中MDA、TG的含量,改善肝脏组织病变,保持细胞的界限完整性及细胞形态。其中马氏珠母贝肉水提物、蛋白酶解超滤组分F-Ⅰ(分子质量< 3 ku)具有较显著的保护作用,根据质谱鉴定结果,分别从F-Ⅰ组、水提物分中挑选出15条以及20条主要的肽段,具备一定的活性潜能。
[1] REN J Y, SHA W Q, SHANG S M, et al. Hepatoprotective peptides purified fromand its effect against ethanol-induced LO2 cells injury[J]. International Journal of Food Science & Technology, 2021, 56(1): 352-361.
[2] HSIEH P S, CHEN C W, KUO Y W, et al.spp. reduces ethanol-induced liver oxidative stress and inflammation in a mouse model of alcoholic steatohepatitis[J]. Experimental and Therapeutic Medicine, 2021, 21(3): 188.
[3] LI R, LIANG T, HE Q L, et al. Puerarin, isolated from Kudzu root (Willd), attenuates hepatocellular cytotoxicity and regulates the GSK-3β/NF-κB pathway for exerting the hepatoprotection against chronic alcohol-induced liver injury in rats[J]. International Immunopharmacology, 2013, 17(1): 71-78.
[4] 胡滨, 李康林, 吴桥, 等. 猪血蛋白酶解物对小鼠急性酒精性肝损伤的保护作用[J]. 食品科学, 2018, 39(11): 185-190.
[5] 陈頔, 殷继永, 黄建. 鱼皮低聚肽对小鼠急性酒精性肝损伤的保护作用[J]. 中国食物与营养, 2021, 27(5): 47-52.
[6] 钟佳佳, 章超桦, 高加龙, 等. 三角帆蚌肉酶解产物响应面优化制备及醒酒活性[J]. 广东海洋大学学报, 2020, 40(3): 103-111.
[7] 左光扬, 章超桦, 高加龙, 等. 企鹅珍珠贝肉酶解产物的制备及其醒酒作用的初步研究[J]. 食品工业科技, 2012, 33(15): 145-148.
[8] 张帅, 章超桦, 高加龙, 等. 河蚬肉酶解产物解酒护肝功效[J]. 食品与机械, 2019, 35(3): 166-171.
[9] BYUN J H, CHOI Y J, CHOUNG S Y. Protective effect ofhydrolysate peptide in alcohol induced alcoholic fatty liver in SD-rats[J]. Planta Medica, 2016, 81(S1): S1-S381.
[10] 韩丽娜, 秦小明, 林华娟, 等. 马氏珠母贝肉的醒酒作用机理初探[J]. 食品科技, 2010, 35(10): 180-183.
[11] 王爱民, 阎冰, 叶力, 等. 马氏珠母贝不同地理种群内自繁和种群间杂交子一代主要性状的比较[J]. 水产学报, 2003, 27(3): 200-206.
[12] 邓志程, 张迪, 吉宏武, 等. 马氏珠母贝免疫活性肽的纯化与鉴定[J]. 广东海洋大学学报, 2017, 37(4): 78-86.
[13] YANG F M, QIN X M, ZHANG T, et al. Effect of oral administration of active peptides ofon the repair of skin wounds[J]. Marine Drugs, 2019, 17(12): 697.
[14] 高加龙. 马氏珠母贝肉中牛磺酸的提取及其抗急性酒精中毒作用的初步研究[D]. 湛江: 广东海洋大学, 2007.
[15] 钟佳佳, 章超桦, 高加龙, 等. 马氏珠母贝肉酶解产物的抗酒精性肝损伤作用[J]. 南方水产科学, 2020, 16(2): 107-114.
[16] 郑惠娜, 张晶晶, 周春霞, 等. pH调节法提取牡蛎蛋白及氨基酸、蛋白组成分析[J]. 中国食品学报, 2014, 14(7): 230-235.
[17] 谢晓霞. 文蛤与蓝蛤鲜味肽的呈味特性及其与鲜味受体T1R1/T1R3的分子作用研究[D]. 锦州: 渤海大学, 2019.
[18] XIAO C Q, ZHOU F B, ZHAO M M, et al. Chicken breast muscle hydrolysates ameliorate acute alcohol-induced liver injury in mice through alcohol dehydrogenase (ADH) activation and oxidative stress reduction [J]. Food & Funcion, 2018, 9(2): 774-784.
[19] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中氨基酸的测定: GB 5009.124—2016[S]. 北京: 中国标准出版社, 2017.
[20] 中华人民共和国卫生部, 中国国家标准化管理委员会. 食品中牛磺酸的测定: GB/T 5009.169—2003[S]. 北京: 中国标准出版社, 2004.
[21] LI J Y, LIU C, GUO Y H, et al. Determination of the effects of torularhodin against alcoholic liver diseases by transcriptome analysis[J]. Free Radical Biology and Medicine, 2019, 143: 47-54.
[22] LI F Y, DUAN K M, WANG C L, et al. Probiotics and alcoholic liver disease: treatment and potential mechanisms[J]. Gastroenterology Research and Practice, 2016, 2016: 1-11.
[23] GUO R, REN J. Alcohol and acetaldehyde in public health: from marvel to menace[J]. International Journal of Environmental Research and Public Health, 2010, 7(4): 1285-1301.
[24] TUMA D J, CASEY C A. Dangerous byproducts of alcohol breakdown: focus on adducts[J]. Alcohol Research & Health, 2003, 27(4): 285-290.
[25] 李静, 张朝辉, 段筱杉, 等. 大叶藻黄酮对酒精性肝损伤的保护作用[J]. 水产学报, 2016, 40(5): 799-806.
[26] MIR S M, SAHU B D, KONERU M, et al. Supplementation of oat (Avena sativa L) extract abates alcohol-induced acute liver injury in a mouse model[J]. Nutrition Research, 2018, (54): 80-92.
[26] MIR S M, SAHU B D, KONERU M, et al. Supplementation of oat (L.) extract abates alcohol-induced acute liver injury in a mouse model[J]. Nutrition Research, 2018, 54: 80-92.
[27] OSNA N A, DONOHUE T M, KHARBANDA K K. Alcoholic liver disease: pathogenesis and current management[J]. Alcohol Research, 2017, 38(2): 147-161.
[28] MALLIKARJUNA K, SHANMUGAM K R, NISHANTH K, et al. Alcohol-induced deterioration in primary antioxidant and glutathione family enzymes reversed by exercise training in the liver of old rats[J]. Alcohol, 2010, 44(6): 523-529.
[29] LI S, TAN H Y, WANG N, et al. The role of oxidative stress and antioxidants in liver diseases[J]. International Journal of Molecular Sciences, 2015, 16(11): 26087-26124.
[30] 凌关庭. 保健食品原料手册[M]. 北京:化学工业出版社, 2002: 590-591.
[31] 王文杰, 王娜, 陈奕晨. 牛磺酸对小鼠酒精性肝损伤的保护作用及其作用机制的研究[J]. 中南药学, 2020, 18(1): 53-57.
[32] ZHAO R J, HUO C Y, QIAN Y, et al. Ultra-high-pressure processing improves proteolysis and release of bioactive peptides with activation activities on alcohol metabolic enzymesfrom mushroom foot protein[J]. Food Chemistry, 2017, 231: 25-32.
Improving Effect ofMeat Extract on Acute Alcoholic Liver Injury in Mice
WANG Li-xia1, ZHANG Chao-hua1,2, GAO Jia-long1,2, ZHENG Hui-na1,2, CAO Wen-hong1,2,QIN Xiao-ming1,2, CHEN Jian-ping1,2
(1.,////////,524088,; 2.,116034,)
【】To futher explore the active anti-alcoholic components inmeat.【】The ultrafiltration components with a molecular weight of < 3 ku (F-I), 3 ~ 8 ku (F-Ⅱ) and > 8 ku (F-Ⅲ) were prepared by enzymatic hydrolysis and ultrafiltration fractionation methods, by using the protein ofmeat extracted by alkali solution and acid precipitation method. Meanwhile, the whole viscera water extract of the shellfish was prepared by the water extraction method. Taking mice with acute alcoholic liver injury as the model, the improvement effect of each extract on the acute alcoholic liver injury was evaluated by serum biochemical indexes (alanine aminotransferase ALT, aspartate aminotransferase AST), liver biochemical indexes (superoxide dismutase SOD, glutathione GSH, triglyceride TG, malondialdehyde MDA, alcohol dehydrogenase ADH and aldehyde dehydrogenase ALDH) and liver pathological sections, and the amino acid content and mass spectrometry structure of components with high activity against liver injury were determined.【】Compared with the model group, the ultrafiltration groups and the water extract group could significantly reduce the ALT and AST activities in the serum of mice (< 0.01), reduce the contents of MDA and TG in the liver (< 0.05), and significantly increase the activities of SOD, GSH (< 0.05), ADH and ALDH in the liver of mice (< 0.01), improve the pathological condition of liver tissue, alleviate cell necrosis, inflammation and other pathological conditions. Amino acid detection results showed that the amino acid compositions of F-I fraction and water extract were comprehensive, and the taurine content in the water extract is about twice that of the F-I fraction; mass spectrometry results showed that F-I fraction and water extract contained 15 and 20 main peptide fragments, respectively.【】The ultrafiltration fractions and water extract ofhave protective effect on acute ALD, and the F-I fraction and water extract have better effect. The improvement mechanism is related to the enhancement of the antioxidant capacity and promotion of ethanol metabolism.
; enzymatic hydrolysis solution; water extract; acute alcoholic liver injury
Q939.11
A
1673-9159(2021)06-0099-09
10.3969/j.issn.1673-9159.2021.06.012
王利霞,章超桦,高加龙,等. 马氏珠母贝肉提取物对小鼠急性酒精性肝损伤的影响[J]. 广东海洋大学学报,2021,41(6):99-107.
2021-08-25
财政部和农业农村部国家现代农业产业技术体系资助(CARS-49);广东普通高等学校水产品高值化加工与利用创新团队项目(GDOU2016030503);海洋贝类营养健康食品关键技术及产业化(GDOU2017052606)
王利霞(1998―),女,硕士研究生,研究方向为水产品贮藏与加工。E-mail: 1271355028@qq.com
高加龙(1983―),男,博士,副教授,从事水产品精深加工研究。E-mail: Garonne@126.com
章超桦(1956―),男,博士,教授,从事水产品精深加工研究。E-mail: zhangch2@139.com
(责任编辑:刘朏)

