慢性萎缩性胃炎、胃癌患者外周血ALDH1、G-17水平变化及意义
严波,杨善峰,李祥,肖强,何雁,金娟
合肥市第二人民医院(安徽医科大学附属合肥医院)消化内科,合肥230011
胃癌作为世界范围内常见的恶性肿瘤,在东亚地区高发,特别是我国安徽中部地区,具有高发病率、高病死率的特点[1-2]。胃癌在我国的发病率、病死率分别占第2、3 位,约占全世界的42.56%和44.97%。探寻新的肿瘤标志物对于胃癌的及早发现及诊断,降低病死率,提高患者生存率及生存质量均具有重要意义。乙醛脱氢酶1(ALDH1)、胃泌素17(G-17)均为新发现的肿瘤标志物,在肿瘤的发展、转移及耐药过程中存在协同机制[3]。既往研究主要集中于ALDH1、G-17 在肿瘤转移、耐药及预后等方面的作用,而对两者在肿瘤发生过程中所起的作用尚不明确。本研究观察了胃癌、慢性萎缩性胃炎患者外周血ALDH1、G-17 水平变化,并对其进行相关性分析,探讨二者是否参与了慢性萎缩性胃炎进展至胃癌的过程。现报告如下。
1 资料与方法
1.1 临床资料 选取 2020 年 4 月—2021 年 3 月我院收治的胃癌患者41例(胃癌组)、慢性萎缩性胃炎患者52 例(萎缩性胃炎组);其中胃癌组男25 例、女16 例,年龄(59.3 ± 6.2)岁;萎缩性胃炎组男31 例、女21例,年龄(56.2±6.1)岁。胃癌组、萎缩性胃炎组患者经胃镜及病理组织活检确诊。排除标准:①合并炎症感染性疾病或自身免疫性疾病;②近期大量使用抑酸剂、糖皮质激素、胃黏膜保护剂、抗生素及非甾体药物;③合并其他类型肿瘤或精神疾病;④合并严重心肺肝肾功能不全;⑤既往接受放化疗者或孕妇。另选同期我院体检中心体检确诊的非萎缩性慢性胃炎患者25例(对照组),患者胃镜检查均示正常胃黏膜,病理组织学检查示轻度非萎缩性慢性胃炎;男13 例、女12 例,年龄(52.9 ± 4.3)岁。三组性别、年龄均具有可比性(P均>0.05)。本研究通过医院伦理委员会审核,患者及其家属均签署知情同意书。
1.2 外周血ALDH1、G-17 水平检测方法 采用ELISA 法。晨起抽取三组外周血6 mL,2 000 r/min离心8 min,取上层血清,-70 ℃冰箱保存待检。采用 ELISA 法检测外周血 ALDH1、G-17 水平,ALDH1试剂盒购自美国RayBiotech 公司,G-17 试剂盒购自芬兰Biohit公司,严格按照试剂盒说明书进行操作。
1.3 统计学方法 采用SPSS18.0 统计软件。计量资料以表示,多组间比较采用方差分析,组间比较采用成组t检验;外周血ALDH1、G-17 的相关性采用Pearson 相关分析。P<0.05 为差异有统计学意义。
2 结果
2.1 三组外周血ALDH1、G-17 水平比较 胃癌组外周血ALDH1、G-17水平均明显高于萎缩性胃炎组和对照组,萎缩性胃炎组外周血ALDH1、G-17 水平均明显高于对照组(P均<0.05)。见表1。
表1 三组外周血ALDH1、G-17水平比较()
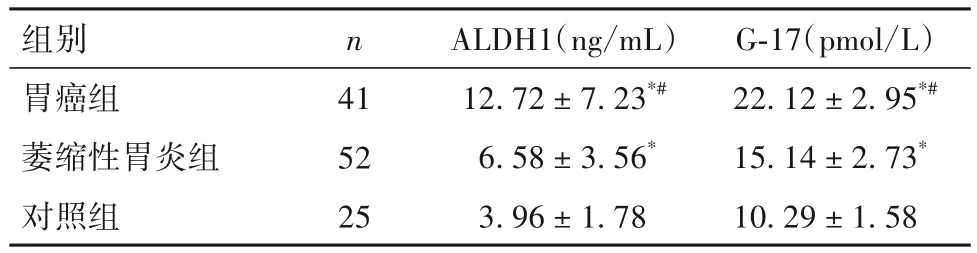
表1 三组外周血ALDH1、G-17水平比较()
注:与对照组比较,*P<0.05;与萎缩性胃炎组比较,#P<0.05。
组别胃癌组萎缩性胃炎组对照组G-17(pmol/L)22.12±2.95*#15.14±2.73*10.29±1.58 n 41 52 25 ALDH1(ng/mL)12.72±7.23*#6.58±3.56*3.96±1.78
2.2 三组外周血ALDH1 与G-17 水平的关系 胃癌组外周血ALDH1 与G-17 水平呈正相关关系(r=0.518、P<0.05),萎缩性胃炎组外周血ALDH1 与G-17 水平呈正相关关系(r=0.632,P<0.05),对照组外周血ALDH1 与G-17 水平无明显相关性(r=0.208,P>0.05)。
3 讨论
我国是胃癌高发国家,且胃癌发病率有逐步升高趋势[4]。慢性萎缩性胃炎属于癌前病变,其进展为胃癌的风险明显增大,尤其是胃窦萎缩性胃炎,癌变风险尤其高。早期胃癌患者多局限于胃黏膜或黏膜下层,通常有黏膜腺体组织的晚期丢失(腺体萎缩),并且发展为新胃癌的风险非常高。因此,寻找与胃癌发生、发展密切相关的肿瘤指标对于明确萎缩性胃炎进展为胃癌的相关机制具有重要意义,同时也可为胃癌早期发现、浸润、转移、预后判断提供可靠的肿瘤标志物。
ALDH1是乙醛脱氢酶(ALDH)家族中新发现的一种肿瘤干细胞标志物,ALDH 超家族编码特定生命进程中的关键酶,在肿瘤的发生、演变、转移、复发中具有重要作用,可作为胃癌干细胞标志物,为胃癌的诊断和治疗提供新的途径[5-6]。既往研究显示,ALDH1 蛋白表达与胃癌原发灶肿瘤分级和淋巴结转移有关,其在胃癌组织中的表达明显高于癌旁组织,在转移淋巴结中的表达明显高于未转移淋巴结,在低分化癌组织中的表达明显高于高分化癌组织,对于临床分期高、有淋巴结转移灶的胃癌组织ALDH1 表达也更高[7]。有研究显示,ALDH1 蛋白表达与胃癌的分期、转移及患者预后有明显相关性,可作为胃癌早期诊断或预后判断的指标之一,其与肿瘤干细胞标志物联合检测可能对于胃癌患者预后的预测具有重要意义[8]。ALDH1低表达于正常人胃黏膜上皮,但高表达于胃腺癌患者的癌组织中[9]。本研究结果显示,在正常胃黏膜组织—慢性萎缩性胃炎—胃癌的进展过程中,患者外周血ALDH1水平逐渐升高且差异具有统计学意义,表明在胃癌的发生、发展过程中,ALDH1 可通过一定机制导致或加速胃癌的进程,可能与血管内皮生成因子(VEGF)、上皮—间质转换(EMT)等促进肿瘤侵润、转移有关,但具体机制尚不清楚。研究显示,NUAK2能够促进胃癌肿瘤干细胞标志物表达上调,可促进胃癌细胞增殖及转移[10]。幽门螺杆菌(Hp)感染可引发炎症并改变胃局部微环境,促使干细胞分化并导致腺体增生,这些变化均可能会影响胃干细胞的分化,并诱导胃癌的发生[11]。
G-17 具有刺激胃酸分泌、促进胃黏膜细胞增殖和分化的生理功能,是胃窦和十二指肠G 细胞合成和分泌的一种胃泌素,占人体胃泌素总量的90%,对于调节消化道功能和维持其结构完整具有重要作用。外周血G-17 水平变化可反映胃黏膜病变情况,常用于癌前病变及胃癌筛查,具有无创、简便等优点,被称为“血清学活检”,在临床应用中具有重要价值[12]。但 G-17 在胃癌的发生、发展、转移及预后判断中的研究较少,且相关机制尚不完全明确。本研究结果显示,在正常胃组织黏膜—慢性萎缩性胃炎—胃癌的进展过程中,患者外周血G-17 水平逐渐升高且差异具有统计学意义,提示G-17 可能通过多个信号传导通路参与胃癌细胞增殖。研究显示,G-17 可激活混合谱系激酶3(MLK3),使金属基质蛋白酶活化,细胞外基质降解,从而降解细胞间联接,促进肿瘤侵润及转移[13]。Hp可刺激胃泌素释放增多,导致胃黏膜炎症、肠腺化生、萎缩、不典型增生,从而参与胃癌的发生、发展,提示胃癌的发生过程中胃泌素和Hp感染有协同作用。
肿瘤的发生、发展是一个渐进式过程,涉及多级反应和积累,因此肿瘤的发生、发展呈网络状复杂机制,很多环节尚不明确。不同的致癌因素可能通过不同机制共同促进肿瘤的发生和发展,相关机制之间可能存在交叉,甚至有共同的机制或相近的协同机制促进肿瘤的发生和发展。本研究结果显示,慢性萎缩性胃炎与胃癌患者的外周血ALDH1 与G-17水平均呈正相关关系,而对照组却没有明显相关性,这表明ALDH1 和G-17 之间可能通过相互作用或协同作用促进胃癌的发生和发展[14]。结合国内外研究,考虑其作用机制可能如下:①ALDH1 可通过VEGF 促进血管内皮细胞增殖,导致胃癌和新生组织中异常血管生成。②G-17通过与胆囊收缩素2受体(CCK-2R)结合发挥作用,在血管生成中增强内皮细胞活性,增加微血管和小静脉的通透性,从而促进胃癌发展[3]。③Hp 感染可引发炎症并改变胃内的局部微环境,使Hp与胃上皮祖细胞和干细胞相互作用,加速干细胞增殖,导致胃黏膜炎症、肠腺化生、萎缩、不典型增生的发生[11];而ALDH1 是组织中正常干细胞和肿瘤干细胞生长、分化的必需物质,同时ALDH1 在胃癌组织中高表达,可作为评价胃癌预后的指标,而L 型幽门螺旋杆菌(Hp-L)感染可促进ALDH1 的表达[15],因此 ALDH1 可能与 Hp 共同作用影响胃干细胞的分化并诱导胃癌发生。
综上所述,慢性萎缩性胃炎、胃癌患者外周血ALDH1、G-17 水平均升高,二者共同参与了慢性萎缩性胃炎进展至胃癌的过程。由于肿瘤的发生、发展是一个极其复杂的过程,本研究只能证实ALDH1和G-17 共同参与慢性萎缩性胃炎进展至胃癌的过程,且在此过程中存在一定相关性,但其具体机制需要进一步研究明确。

