基于网络药理学和分子对接探讨甘草防治阿尔茨海默病的分子机制
马震东,黄晓风,朱思林,郭晋言,黄淑芸,陈倩文,杨 春*,杜以宽 (.广东医科大学干细
胞与再生组织工程重点实验室,广东东莞 523808;2.东莞市人民医院中心实验室,广东东莞 523059)
阿尔茨海默病(AD)是一种以进行性脑神经元丢失和萎缩为特征的疾病,属中医领域“痴呆”范畴,主要因心脾二脏的气血不足、心神失养所致[1]。认知障碍是AD 和其他呆病的主要症状之一。甘草既善温运脾胃,又可除烦解郁,有补脾益气等功效,对认知障碍有保护作用[2]。临床应用中,甘草副作用小,在治疗神经退行性疾病中发挥一定作用,是中医治疗AD 最常用的十种中药之一[3]。
本文借助中药系统药理学数据库与分析平台TCMSP 结合疾病靶点数据库DisGeNET、Drugbank和OMIM,通过构建甘草活性成分作用靶点网络与AD 相关靶点网络相互映射来挖掘甘草防治AD 的主要活性成分及作用靶点,利用DAVID 数据库进行功能注释和富集分析,探究甘草防治AD 的作用机制通路,并通过Ledock 进行分子对接加以验证,试图为甘草药效物质基础和作用机制的实验研究提供大数据集成的理论依据。
1 材料和方法
1.1 甘草活性化学成分筛选及对应靶点信息的获取
通过TCMSP 数据库(http://lsp.nwu.edu.cn/tcmsp.php)获取甘草活性成分信息。以口服生物利用度(OB)≥30%、血脑屏障(BBB)≥-0.3、类药性(DL)≥0.18 为条件对甘草活性成分进行筛选。将符合条件的活性成分在Pubchem 数据库(https://pubchem.ncbi.nlm.nih.gov/)中进行检索并校对,获取其2D 结构,保存为SDF格式。将收集到的2D结构导入到SwissTar‐getPredict 数据库进行靶点预测,以Possibility>0 为筛选条件,获取相关程度较高的甘草成分靶点信息。
1.2 AD相应靶点的获取及交集靶点的获取
通 过DisGeNET(https://www.disgenet.org/)、OMIM(http://www.omim.org/)以及Drugbank(https://www.drugbank.ca/)数据库,以“Alzheimer's Disease”为关键词检索AD 相关靶点,并应用Uniprot 数据库(https://www.uniprot.org)对疾病靶点进行标准化,运用EXCEL 剔除重合靶点信息,最后将甘草活性成分相应靶点与AD 相关靶点通过Venny(https://bioin‐fogp.cnb.csic.es/tools/venny/)进行映射,获得甘草防治AD的潜在靶点。
1.3 药物-活性成分-疾病-靶点网络的构建
将筛选得到的活性成分、甘草防治AD 的潜在靶点等信息输入Cytoscape软件构建“药物-活性成分-疾病-靶点”网络,通过“Network analyzer”功能进行拓扑学分析,分析内容包括度值(Degree)、介度中心性(Betweenness centrality)、近性中心性(Closeness cen‐trality)等参数。以大于上述参数的2 倍中位数值为条件筛选出甘草防治AD的主要活性成分。
1.4 基于STRING数据库的蛋白相互作用网络构建
为进一步了解化合物、靶点和蛋白质之间的复杂关系,将甘草防治AD 的潜在靶点导入STRING(https://string-db.org/)数据库,限定物种为人,设定最小相互作用参数为“medium confidence(0.40)”,保存为TSV 文件,将所得文件导入Cytoscape 进行PPI 网络可视化并根据度值筛选出甘草防治AD 的潜在关键靶点。
1.5 甘草治疗AD生物过程与代谢通路富集分析
为说明甘草防治AD 潜在靶点在基因功能中的作用,通过DAVID 数据库(https://david.ncifcrf.gov/home.jsp)进行基因本体论(GO)分析和京都基因与基因组百科全书(KEGG)功能注释和富集分析。以P<0.01 为筛选标准,筛选出最显著富集的生物学注释,并通过微生信网站(http://www.bioinformatics.com.cn/)对结果作可视化处理。
1.6 关键靶点与活性成分的分子对接
为预测甘草活性成分与靶点间结合亲和力,利用Ledock 分子对接软件对甘草中的核心化合物和关键靶点进行分子对接试验。在TCMSP数据库中下载活性成分mol2 结构文件,通过Chem 3D 软件优化力学结构后保存,作为配体;从PBD 数据库(http://www.rcsb.org/)中获取靶蛋白PBD 文件,在PyMOL 对蛋白进行去水、分离出活性中心的原配体,作为受体;利用Ledock 进行分子对接,通过微生信网站将活性成分与对应靶蛋白对接得到的结合能构建为热图。
2 结果
2.1 甘草活性成分的筛选
在TCMSP 数据库中检索到280 个甘草化合物信息。根据设置的筛选条件,共筛选出69 个化合物,然后利用PubChem 数据库排除无效成分,得到64 个化合物,用GC1-GC64 表示,见表1。通过SwissTarget‐Prediction 数据库进行靶点预测,得到甘草活性成分相关靶点692个。

表1 甘草的64种有效成分

续表1
2.2 甘草防治AD的潜在靶点筛选
在OMIM、DrugBank 和DisGeNET 数据库中分别获得198、98 和93 个AD 靶点,合并去重后,共得到310 个AD 相关靶点。通过Venny 对64 个活性成分对应的靶点与OP相关靶点匹配后取交集得到甘草防治AD的82个潜在靶点,见图1。
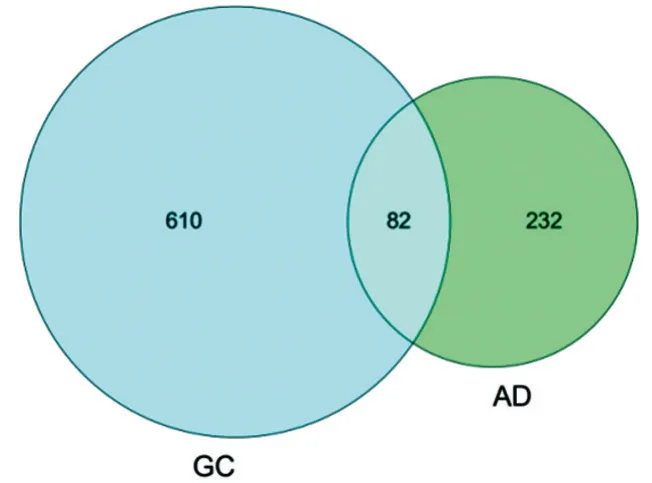
图1 甘草与AD的交集靶点图
2.3 甘草-活性成分-靶点-疾病网络
运用Cytoscape软件构建甘草-活性成分-靶点-疾病网络图,见图2。该网络图由146 个节点,804 条边组成,其中紫色代表甘草,黄色代表活性成分,绿色代表疾病,蓝色代表交集靶点。以度值、介度中心性、接近中心性的2 倍中位数值为条件筛选出的10 个主要活性成分为甘草素、7-乙酰氧基-2-甲基异黄酮、光甘草素、甘草宁O、7-甲氧基-2-甲基异黄酮、异槲皮酚、糖醇、kanzonols W、异补骨脂二氢黄酮、鳞叶甘草素A。

图2 “药物-成分-靶点-疾病”网络图
2.4 甘草靶点PPI网络构建与核心靶点分析结果
将82 个交集靶点导入STRING 数据库,并通过Cytoscape 软件进行可视化,见图3。网络图由82 个节点和567 条边组成,82 个节点代表82 个蛋白靶点,567 条边代表567 对蛋白质间的相互作用。图中度值排名前5 的是淀粉样前体蛋白(APP)、乙酰胆碱酯酶(ACHE)、半胱天冬蛋白酶3(CASP3)、5-羟色胺转运体(SLC6A4)及单胺氧化酶B(MAOB)。

图3 蛋白互作网络图
2.5 甘草有效成分靶点的功能通路注释
使用DAVID 数据库进行GO 富集分析,共得到106 个条目(FDR<0.01),包含61 个生物过程(BP)条目,26 个分子功能(MF)条目,19 个细胞组成(CC)条目。甘草防治AD 的潜在靶点富集最显著的10 个条目中,有3 个为生物过程,分别为对药物的反应、对安非他命的反应及腺苷酸环化酶激活肾上腺素能受体信号通路;有4 个为细胞组成,分别为质膜、质膜的组成部分、轴突和树突;有2 个为分子功能,分别为药物结合和多巴胺神经递质受体活性。表明甘草活性成分可以通过调控多个复杂的生物学途径防治AD。结果见图4。
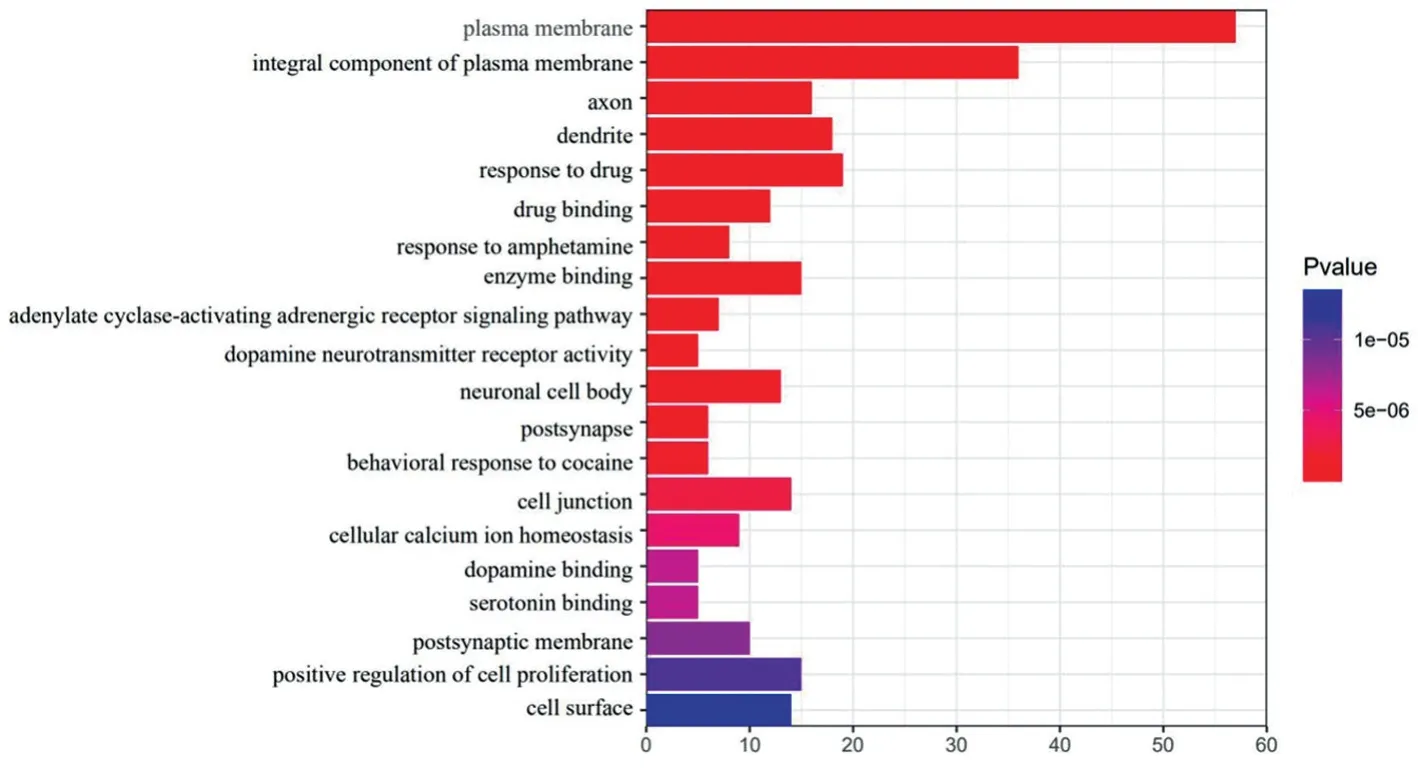
图4 甘草防治AD靶点GO分析
KEGG 通路分析共富集出38 条通路,P<0.01 的信号通路12 条。结果表明甘草防治AD 的潜在靶点主要在神经活性配体受体相互作用通路、阿尔茨海默病通路、钙信号通路、5-羟色胺能突触通路、cAMP 信号通路、多巴胺能突触通路等中富集,提示上述通路与甘草干预AD的发生发展密切相关。见图5和表2。

表2 KEGG通路基因富集结果
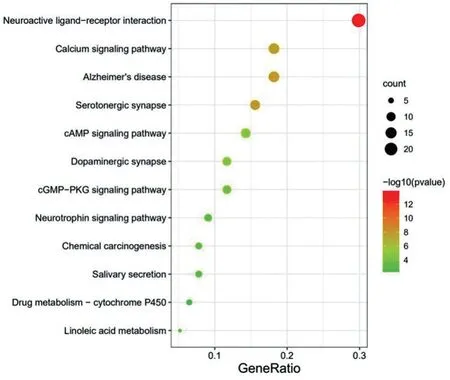
图5 甘草防治AD靶点KEGG富集分析
2.6 分子对接结果
一般认为配体与受体结合的构象稳定时能量越低,发生的作用可能性越大。以结合能≤-5.0 kJ/mol作为标准,对“2.3”项中筛出的10 个主要活性成分和“2.4”项中度值排名前5 的关键靶点进行分子对接验证。结果显示,甘草中主要活性成分与APP、CASP3、ACHE、SLC6A4、MAOB 等关键靶点的结合能均小于-5.0 kJ/mol,提示有效活性成分与关键靶点的结合活性较好,筛选结果可靠。其中甘草宁O 与MAOB的结合活性最好。分子对接得分见图6,图中数值单位为kJ/mol。选取成分甘草素、kanzonols W 与靶点MAOB进行分子对接展示,见图7。

图6 甘草主要活性成分与关键靶点分子对接得分热图

图7 甘草素、kanzonols W与靶点MAOB分子对接展示图
3 讨论
AD是一种与年龄相关的慢性进行性神经退行性疾病。AD 患者发病过程中,β-淀粉样蛋白(Aβ)沉积活化小胶质细胞,进一步引起氧化应激、炎症损伤及细胞凋亡,最终导致神经元功能缺损[4],而甘草活性成分可能通过抗氧化、抗炎和抗凋亡等途径发挥治疗AD 的作用[5]。此外,近年研究发现,微生物群-肠道-大脑轴在神经退行性疾病的发展中起着重要作用,AD 患者中肠道微生物群发生显著改变[6]。通过对肠道微生物群施加积极影响,可能减少甚至逆转AD 患者认知下降的情况。研究报道甘草中活性成分可通过调控肠道微生物群预防各种疾病的发生,在日常饮食中合理加入适量甘草或许能起到延缓AD 发生的作用[7-8]。因此,本文通过网络药理学方法探讨甘草预防及治疗阿尔茨海默病的多成分、多靶点、多通路作用机制,将成为防治AD的一个新思路。
TCMSP 是中药网络药理学研究常用数据库,但是,甘草次酸[9]和甘草酸二铵[10]在数据库未见收录。而满足OB≥30%、DL≥0.18 及BBB≥-0.3 特征的甘草酚[11]在相关研究中显示出抗AD 的作用,也未在最终筛选的64 种成分里。此外,甘草中含有的甘草苷、异甘草素、槲皮素、山柰酚等黄酮类化合物及萜类化合物甘草酸虽不满足筛选条件,但同样已有文献报道上述成分均具有抗AD作用[10,12-14]。本文在TCMSP数据库的基础上,经文献查阅及数据挖掘,增加了8 个甘草中具有抗AD 作用的成分,对TCMSP 数据库的筛选结果进行了补充,为下一步的靶点预测以及通路筛选奠定基础。
KEGG 富集分析结果显示,5-羟色胺能突触通路富集了12 个靶点,其中包括APP、MAOB、CASP3 及SLC6A4 等5 个关键靶点,提示该通路可能为甘草防治AD 的主要途径。CASP3 是半胱氨酸-天冬氨酸蛋白酶家族的成员,在细胞凋亡和突触可塑性调节中起重要作用,能通过裂解Akt 激活GSK3β 激酶通路,调节AD 患者tau 的磷酸化[15]。研究表明,AD 患者中5-羟色胺合成受损,抗氧化系统失衡,通过CASP3 和p53 蛋白激活神经元凋亡,在脑内发生炎症反应,进而导致大脑中神经元的树突棘丢失[16]。甘草酸二铵能减少脂质过氧化和线粒体细胞色素C 释放以及CASP9 和CASP3 的激活,进而抑制Aβ(1-42)介导的神经毒性[17]。异甘草素能通过抑制Aβ(25-35)诱导的神经细胞凋亡、钙离子浓度升高以及活性氧的生成,降低Bax 活性和减少CASP3 的表达来对神经元起保护作用[18]。MAO 是机体内参与单胺类物质代谢的主要酶类,可催化5-羟色胺的代谢,在衰老和AD 中发挥一定的作用。MAOB 的高活性会增加过氧化应激反应,进而导致AD 的形成[19]。分子对接结果显示,甘草活性成分与MAOB 结合活性均较高,其中甘草宁O 的结合活性最好,但却没有相关的文献报道甘草宁O 治疗AD。而甘草中的异甘草素[20]、甘草酚和甘草素[11]等活性成分均已有研究证明能抑制MAOB 的活性。此外,AD 患者中脑淀粉样变性的进展与神经炎症和SLC6A4 活性降低有关[21]。维持大脑活动所需的胆碱能激活程度受中枢5-羟色胺能转运速度调节,ACHE 和SLC6A4 的双重抑制剂可能有助于治疗AD[22]。ACHE 为胆碱能神经传递的调节因子,通过抑制ACHE催化功能,能改善AD。甘草素和甘草酚均能有效抑制ACHE,进而增强记忆作用[11]。
本研究的富集分析结果显示甘草也可以通过调节cAMP信号通路来治疗AD。环磷酸腺苷反应元件结合蛋白(cAMP responsive element bind protein,CREB)是介导cAMP信号通路级联反应的转录因子,参与调控基因的表达,并具有调节转录活性的能力。AD 患者中CREB 的表达水平降低,Aβ 主要通过降低磷酸化的CREB 来降低脑源性神经营养因子(BDNF),进而导致AD 患者突触功能障碍和认知功能障碍[23]。上调cAMP/CREB/BDNF通路在改善记忆障碍、治疗AD 中发挥重要作用。甘草素能通过抑制ACHE 和激活BDNF/ERK/CREB 信号通路来调节胆碱能系统[24]。甘草查尔酮A 衍生物通过激活依赖于CREB 的BDNF/AKT/ERK 和BCL2 来抑制细胞存活和抗凋亡,从而对SH-SY5Y 细胞起到神经保护作用[25]。相关研究表明cAMP 信号通路与5-羟色胺能突触通路可能存在一定关系。抑制cAMP 效应物蛋白激酶A(protein kinase A,PKA)和由cAMP 激活的交换蛋白活性,可减弱5-羟色胺的过度兴奋效应[26],5-羟色胺能通过介导5-羟色胺受体能够刺激或抑制AC-cAMP-PKA 信号转导通路[27]。以上分析表明,甘草可通过多成分、多靶点、多通路来治疗AD,并且靶点与通路、通路与通路之间存在一定的联系。
通过网络药理学分析方法及相关文献报道的佐证,我们预测以异甘草素、甘草素为活性成分,CASP3、MAOB、SLC6A4、ACHE 为靶点,5-羟色胺能突触通路为切入点,可进一步探索甘草防治AD 所发挥的具体机制。

