注射用胸腺肽α1联合NP方案化疗对年龄>60岁肺癌患者CD4+/CD8+比值及血清miR-203、miR-197表达的影响
王伟
(漯河市郾城区人民医院内科,河南 漯河 462300)
目前,肺癌仍是恶性肿瘤死亡首要原因,且多数患者确诊时已处于晚期,临床治疗主要采用以全身化疗为主的综合治疗[1-2]。老年肺癌患者伴随基础疾病较多,机体免疫功能低下,化疗耐受性差,是影响患者预后的重要因素[3]。注射用胸腺肽α1是免疫增强剂,可增强机体免疫功能,在恶性肿瘤辅助治疗中发挥重要作用[4]。
miRNA是一类非编码小RNA,与恶性肿瘤发生发展密切相关。研究显示,肺癌中miR-203、miR-197显著高表达,可能成为肺癌诊断及预后评价的生物标志物[5]。本研究选取我院>60岁肺癌患者106例,探究注射用胸腺肽α1联合NP方案化疗对免疫功能、血清miR-203、miR-197表达的影响。报道如下。
1 资料与方法
1.1 一般资料
选取我院2017年2月~2018年10月>60岁肺癌患者106例,根据治疗方案不同分组,每组各53例。
对照组女20例,男33例,年龄61~79岁,平均(70.15S4.08)岁,TNM分期:Ⅲa期24例,Ⅲb期19例,Ⅳ期10例;观察组女19例,男34例,年龄61~82岁,平均(71.03S4.39)岁,TNM分期:Ⅲa期22例,Ⅲb期20例,Ⅳ期11例。两组基线资料均衡可比(P>0.05)。
1.2 纳入与排除标准
1.2.1 纳入标准
(1)均经支气管镜病理学检查确诊;(2)年龄>60岁;(3)预计生存期>3个月;(4)有可测量的肿瘤病灶;(5)患者及家属知情同意。
1.2.2 排除标准
(1)合并其他恶性肿瘤;(2)免疫系统疾病;(3)对本研究药物过敏;(4)孕期及哺乳期妇女。
1.3 方法
1.3.1 对照组
采用NP方案化疗。长春瑞滨(江苏豪森药业集团有限公司,国药准字H20031337)25 mg·m-2,静滴,第1、8 d;顺铂(德州德药制药有限公司,国药准字H20023236)30 mg·m-2,静滴,第1~3 d。长春瑞滨给药前后分别用地塞米松5 mg+生理盐水100 ml静滴,预防静脉炎。
1.3.2 观察组
于对照组基础上加用注射用胸腺肽α1(成都地奥九泓制药厂,国药准字H20020545),每次1.6 mg,1天1次,皮下注射。两组均以3周为1个周期,持续治疗2个周期。
1.3.3 检测方法
空腹取静脉血3 mL,离心,取上清,以酶联免疫吸附试验测定神经特异性烯醇化酶(NSE)、细胞角蛋白19片段(CYFRA21-1)、血管内皮生长因子(VEGF),以放射免疫法测定癌胚抗原(CEA),以采用化学发光数字成像分析仪(CIS-1,华瑞同康生物技术有限公司)测定胸苷激酶1(TKl),miR-203、miR-197采用实时定量聚合酶链反应测定。
1.4 观察指标
(1)疗效。参照《实体瘤疗效评价标准简介》[6],分为完全缓解、部分缓解、稳定、进展,将完全缓解、部分缓解计入总缓解。
(2)治疗前后免疫功能指标(CD3+、CD4+、CD4+/CD8+)。
(3)治疗前后血清肿瘤标志物(CEA、Cyfra21-1、NSE)水平。
(4)治疗前后血清VEGF、TK1水平。
(5)治疗前后血清miR-203、miR-197水平。
1.5 统计学分析
2 结果
2.1 疗效
观察组总缓解率高于对照组(P<0.05)。表1。

表1 两组疗效对比(n(%),n=53)
2.2 免疫功能指标
治疗后观察组血清CD3+、CD4+、CD4+/CD8+水平高于对照组(P<0.05),见表2。
表2 两组免疫功能指标对比(±SD,n=53)

表2 两组免疫功能指标对比(±SD,n=53)
注:与同组治疗前相比,aP<0.05;与对照组相比,*P<0.05。
组别 CD3+(%) CD4+(%) CD4+/CD8+ 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 观察组 32.51S4.57 41.28S4.55a* 43.21S5.24 52.54S5.76a* 1.03S0.25 1.47S0.21a* 对照组 34.05S5.36 33.51S5.17 41.89S6.18 40.51S4.97 0.97S0.23 1.02S0.26
2.3 肿瘤标志物
治疗后观察组血清CEA、Cyfra21-1、NSE水平低于对照组(P<0.05),见表3。
表3 两组血清肿瘤标志物对比(±SD,n=53)

表3 两组血清肿瘤标志物对比(±SD,n=53)
注:与同组治疗前相比,aP<0.05;与对照组相比,*P<0.05。
组别 CEA(μg·mL-1) Cyfra21-1(ng·mL-1) NSE(ng·mL-1) 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 观察组 38.24±3.56 13.05±2.47a* 9.02±1.51 3.20±0.97a* 19.83±4.25 10.52±1.24a* 对照组 36.98±4.09 23.51±2.84a 8.73±1.68 5.01±1.25a 21.04±3.87 14.85±2.09a
2.4 VEGF、TK1
治疗后观察组血清VEGF、TK1水平低于对照组(P<0.05),见表4。
表4 两组血清VEGF、TK1水平对比(±SD,n=53)
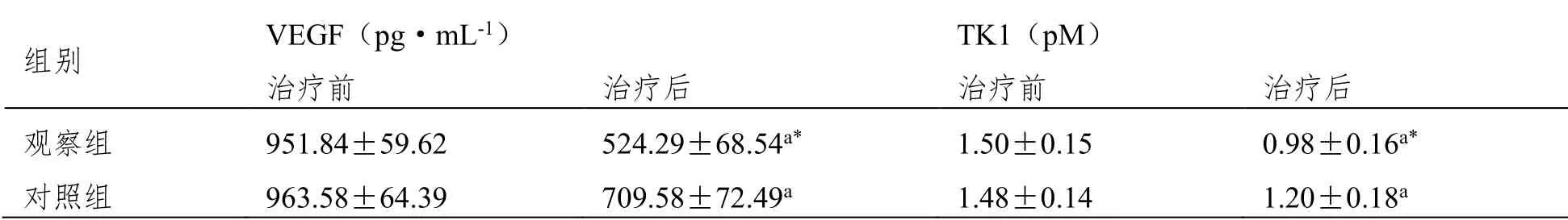
表4 两组血清VEGF、TK1水平对比(±SD,n=53)
注:与同组治疗前相比,aP<0.05;与对照组相比,*P<0.05。
组别 VEGF(pg·mL-1) TK1(pM) 治疗前 治疗后 治疗前 治疗后 观察组 951.84±59.62 524.29±68.54a* 1.50±0.15 0.98±0.16a* 对照组 963.58±64.39 709.58±72.49a 1.48±0.14 1.20±0.18a
2.5 miR-203、miR-197
治疗后观察组血清miR-203、miR-197水平低于对照组(P<0.05),见表5。
表5 两组血清miR-203、miR-197水平对比(±SD,n=53,ΔΔct)
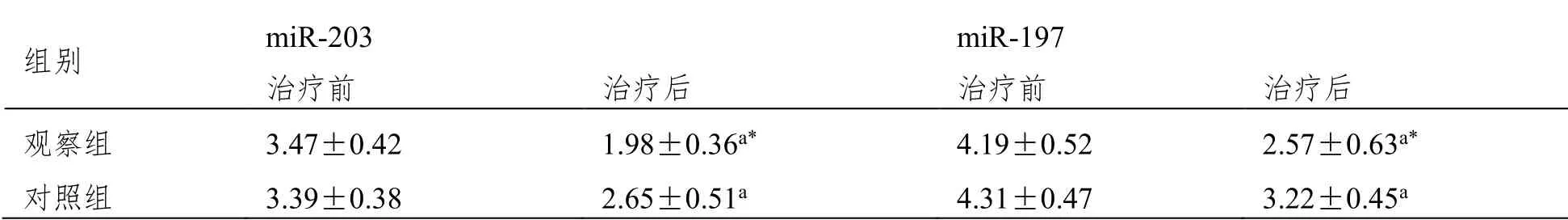
表5 两组血清miR-203、miR-197水平对比(±SD,n=53,ΔΔct)
注:与同组治疗前相比,aP<0.05;注:与对照组相比,*P<0.05。
组别 miR-203 miR-197 治疗前 治疗后 治疗前 治疗后 观察组 3.47±0.42 1.98±0.36a* 4.19±0.52 2.57±0.63a* 对照组 3.39±0.38 2.65±0.51a 4.31±0.47 3.22±0.45a
3 讨论
肺癌是常见的恶性肿瘤之一,且发病率逐年升高。目前,我国老年肺癌患者占全部肺癌患者的8%~13%,研究表明,此类患者接受适当化疗,可延长生存期,改善生活质量[7]。
长春瑞滨是新半合成长春碱类抗癌药物,为特异性细胞周期药物,可使细胞分裂停止于有丝分裂中期,以阻断细胞分裂增殖;顺铂为第一代铂类抗肿瘤药物,可抑制肿瘤细胞DNA复制。NP方案(长春瑞滨联合顺铂)在晚期肺癌中显示了较好疗效[8]。但恶性肿瘤患者普遍存在细胞免疫低下,而免疫疗法作为肿瘤治疗的崭新模式逐渐受到临床重视。
胸腺肽α1是从胸腺素第5组分分离纯化的小分子生物活性多肽,可通过促进T细胞、自然杀伤细胞(NK)增殖分化及细胞因子[干扰素(INF)、白介素2(IL-2)等]释放来增强患者免疫力,杀伤肿瘤细胞[9]。毛雨秋等[10]研究显示,老年胃癌患者在化疗基础上加用胸腺肽α1,缓解率由51.02%增至79.59%,且可有效调节免疫细胞及细胞因子水平,改善免疫功能。毛圣亚等[11]研究显示,胸腺肽α1辅助治疗老年晚期肺腺癌患者,可增强机体免疫力,改善生活质量。
本研究数据显示,观察组总缓解率高于对照组,治疗后观察组血清CD3+、CD4+、CD4+/CD8+水平高于对照组,血清CEA、Cyfra21-1、NSE水平低于对照组。表明注射用胸腺肽α1联合NP方案化疗治疗年龄>60岁肺癌患者,可改善免疫功能,降低血清肿瘤标志物水平,效果显著。分析认为,注射用胸腺肽α1不仅提高机体免疫力,且对肿瘤细胞内第二信使花生四烯酸释放具有促进作用,抑制肿瘤细胞增殖,增强抗肿瘤效果。血管内皮生长因子(VEGF)是最强促血管生长因子,胸苷激酶1(TKl)与癌细胞增殖密切相关,二者均在肺癌发生发展中发挥重要作用,且对疗效有一定预测价值[12-13]。本研究结果显示,治疗后观察组血清VEGF、TK1水平低于对照组,表明注射用胸腺肽α1联合NP方案化疗治疗年龄>60岁肺癌患者,可调节血清VEGF、TK1表达,亦表明联合治疗可更好的控制肿瘤生长及转移。
miRNA参与细胞增殖、分化、凋亡,其异常表达在恶性肿瘤发生、进展过程中发挥重要作用[14]。miR-203基因序列定位于染色体14q32.33上,miR-197定位于染色体1p13.3上,张振华等[15]研究显示,非小细胞肺癌外周血miR-203、miR-197呈高表达,且与TNM分期、淋巴结转移有关。
本研究数据显示,治疗后观察组血清miR-203、miR-197水平低于对照组,提示注射用胸腺肽α1联合NP方案化疗治疗年龄>60岁肺癌患者,可调节血清miR-203、miR-197表达,可能为联合治疗抗肿瘤效果更好的机制之一。但具体通路仍有待进一步论证。
综上可知,注射用胸腺肽α1联合NP方案化疗治疗年龄>60岁肺癌患者,可改善免疫功能,调节血清miR-203、miR-197、VEGF、TK1表达,降低血清肿瘤标志物水平,效果显著。
Parathyroid Hormone Resistance and Autoantibodies to the PTH1 Receptor
Adel Mandl, et al.
We describe two cases of acquired parathyroid hormone (PTH) resistance consequent to the development of serum PTH type 1 receptor (PTH1R) autoantibodies, which block PTH binding and signaling. Both cases were associated with other autoimmune manifestations, and one case was associated with atypical membranous glomerulonephritis. In vitro binding and signaling assays identified the presence of PTH1R-blocking IgG autoantibodies, which were not present in serum samples from patients with other renal or autoimmune disorders. (Funded by the Intramural Research Programs of the National Institute of Diabetes and Digestive and Kidney Diseases and others.).
N Engl J Med. 2021 Nov 18;385(21):1974-1980. doi: 10.1056/NEJMoa2109409.

