晚期胃癌患者应用康艾注射液联合SOX方案治疗的有效性和安全性研究Δ
司莲莲,张志国,张 颖,李 莉,郭宏伟,高 峥,韩 磊
(首都医科大学大兴教学医院肿瘤内科,北京 102600)
2020年,全球新诊断胃癌患者109万例,死亡胃癌患者达76.9万例,其中男性的胃癌发病率为女性的2倍[1]。我国是胃癌高发大国,2018年胃癌新发病例67.9万例,胃癌死亡病例49.8万例,胃癌的发病率和死亡率在所有瘤种中均居第3位[2]。我国早期胃癌患者占比很低,仅约20%,大多数患者发现时已是进展期,总体5年生存率<50%。胃癌术后复发是引起治疗失败或增加患者死亡的主要原因。2017年版中国临床肿瘤学会(Chinese society of clinical oncology,CSCO)指南把SOX方案列为治疗人表皮生长因子受体2(HER2)阴性复发/转移胃癌的Ⅰ级推荐。但SOX方案仍然具有较高的Ⅲ级以上不良反应发生率,以白细胞降低为主[3];在非血液不良反应方面,主要表现为神经毒性[4]。康艾注射液是从黄芪、人参和苦参中提取有效成分制成的抗肿瘤中药注射剂,具有清热解毒、补气升阳和消肿散瘀的功效,可与化疗药联合治疗恶性肿瘤,能起到协同治疗的效果,同时能降低不良反应[5]。本研究旨在探讨康艾注射液联合SOX方案治疗晚期胃癌的疗效和安全性,为临床提供参考。
1 资料与方法
1.1 资料来源
采用临床随机对照研究方法,选取晚期胃癌患者78例,均为2018年3月至2020年10月首都医科大学大兴教学医院收治。纳入标准:(1)经组织病理学及影像学检查确诊为晚期胃癌(包括胃癌术后复发和无法手术切除的转移性胃癌);(2)预计生存期>3个月;(3)经评估,卡氏功能状态(Karnofsky performance status, KPS)评分>60分;(4)患者与家属对本研究知情并同意,且自愿签署知情同意书。排除标准:(1)合并重度的心、肝、脑、肾功能衰竭者;(2)合并血液系统疾病者;(3)精神疾病不能沟通者。按照随机数字表法将患者分为观察组和对照组。观察组39例患者中,男性25例,女性14例;年龄38~78岁,平均(60.28±9.54)岁;临床分期:ⅢB期24例,Ⅳ期15例;病理分型:低分化腺癌26例,中分化腺癌7例,黏液腺癌4例,印戒细胞癌2例。对照组39例患者中,男性22例,女性17例;年龄37~76岁,平均(56.85±9.15)岁;临床分期:ⅢB期26例,Ⅳ期13例;病理分型:低分化腺癌27例,中分化腺癌5例,黏液腺癌4例,印戒细胞癌3例。两组患者的一般资料相似,具有可比性。
1.2 方法
(1)对照组患者单纯使用一线SOX方案治疗:注射用奥沙利铂(规格:50 mg)130 mg/m2,第1日,用5%葡萄糖注射液500 ml稀释后静脉滴注3 h,21 d给药1次;且餐后用温水送服替吉奥胶囊(规格:20 mg),40 mg/(m2·d),1日2次,连续14 d,停药7 d。(2)观察组患者的一线SOX方案同对照组;同时给予康艾注射液(规格:每支20 ml)60 ml,加入5%的葡萄糖注射液或0.9%氯化钠注射液250 ml,静脉滴注,1日1次,连用2周,休息1周,3周为1个周期。两组患者的化疗总周期均为6个周期。
1.3 观察指标
(1)对比两组患者治疗前后的功能状态情况。采用KPS评分评估,以0~100分为评估范围,分值越高,提示功能状态越理想。(2)对比两组患者治疗前后的血清肿瘤标志物水平,包括糖类抗原19-9(CA19-9)、糖类抗原72-4(CA72-4)、糖类抗原24-2(CA24-2)和癌胚抗原(CEA)。(3)对比两组患者治疗前后T淋巴细胞亚群水平,包括CD4+、CD8+和CD4+/CD8+。(4)对比两组患者的不良反应发生情况,包括中性粒细胞减少、白细胞减少、手足综合征、恶心/呕吐和周围神经毒性等。
1.4 疗效评定标准
依据实体瘤临床疗效评价标准,评估两组患者治疗后的临床疗效。完全缓解(complete response,CR):治疗后,肿瘤病灶完全消失,至少维持4周;部分缓解(partial response,PR):治疗后,病灶缩小≥50%,至少维持4周;疾病稳定(stable disease,SD):治疗后,病灶缩小<50%,或增大≤25%;疾病进展(progressive disease,PD):肿瘤增大>25%,或出现新病灶。客观缓解率(objective response rate,ORR)=CR率+PR率;疾病控制率(disease control rate,DCR)=CR率+PR率+SD率。
1.5 统计学方法

2 结果
2.1 治疗效果比较
两组晚期胃癌患者的客观有效率、疾病控制率比较,差异无统计学意义(P>0.05),见表1。

表1 两组晚期胃癌患者治疗效果比较[例(%)]
2.2 功能状态比较
治疗前,两组患者KPS评分比较,差异无统计学意义(P>0.05)。与治疗前比较,对照组患者治疗后的KPS评分明显升高,差异有统计学意义(P<0.05);观察组患者治疗后的KPS评分较治疗前明显升高,且升高程度明显高于对照组,差异均有统计学意义(P<0.05),见表2。
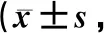
表2 两组患者治疗前后KPS评分比较分)
2.3 血清肿瘤标志物水平比较
治疗前,两组患者血清肿瘤标志物CA19-9、CA72-4、CA24-2和CEA水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者血清肿瘤标志物CA19-9、CA72-4、CA24-2和CEA水平均较治疗前有明显降低,且观察组患者血清肿瘤标志物CA19-9、CA72-4和CEA水平较对照组降低更为明显,差异均有统计学意义(P<0.05);观察组患者血清肿瘤标志物CA24-2水平与对照组相比,差异无统计学意义(P>0.05),见表3。

表3 两组患者治疗前后血清肿瘤标志物指标比较
2.4 免疫功能指标水平比较
治疗前,两组患者免疫功能指标CD4+、CD8+和CD4+/CD8+水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者免疫功能指标CD4+、CD8+和CD4+/CD8+水平比较,差异均有统计学意义(P<0.05),见表4。

表4 两组患者治疗前后免疫功能指标比较
2.5 不良反应发生情况比较
观察组患者白细胞减少、中性粒细胞减少、手足综合征、周围神经毒性和肾功能损害等不良反应的发生率明显低于对照组,差异均有统计学意义(P<0.05);观察组患者恶心/呕吐、血小板减少、口腔黏膜炎和肝功能损害等不良反应的发生率与对照组相比,差异均无统计学意义(P>0.05),见表5。
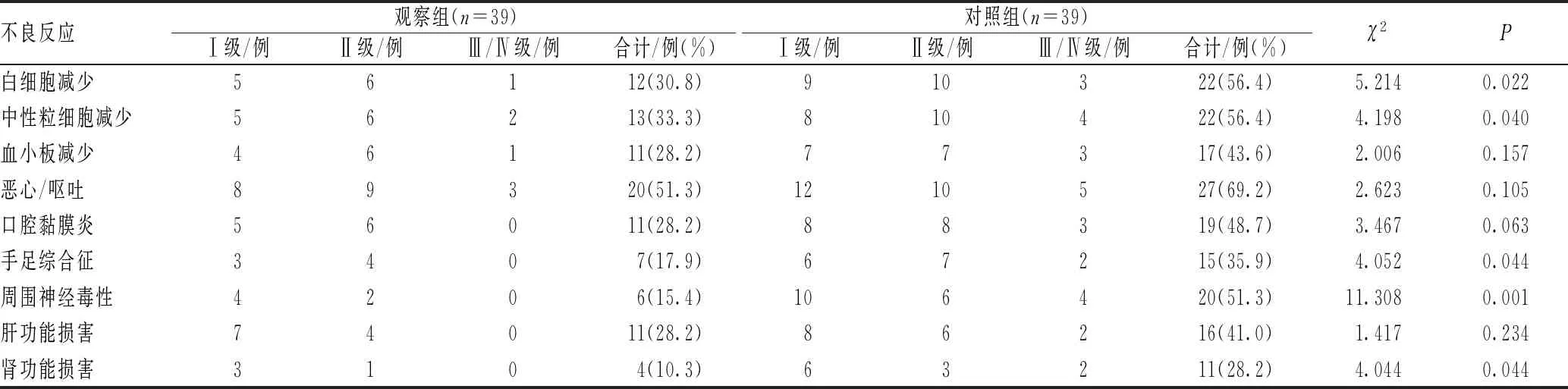
表5 两组患者不良反应发生情况比较
3 讨论
虽然胃癌在世界范围内的发病率正在降低,但我国胃癌发病率仍然很高(29.9/100 000)。每年因胃癌死亡的患者几乎占世界胃癌死亡患者的50%[6]。由于一些检测手段、治疗方法和治疗观念的差异,我国早期胃癌患者发现比例(11%)远低于美国(36%)[7]。相反,我国约80%的胃癌患者诊断时已是晚期[8]。早期胃癌的5年生存率能达到90%,而晚期胃癌的5年生存率<30%[9]。对于复发转移性晚期胃癌,氟尿嘧啶类药物联合铂类药物已被各国指南所推荐,几个大型Ⅲ期临床试验结果显示,氟尿嘧啶类药物联合铂类药物治疗复发转移性胃癌的缓解率为25%~54%,中位无进展生存期为2.9~7个月,中位总生存期为8.6~13个月[10-12]。
替吉奥是一种口服5-氟尿嘧啶(5-FU)的前体药物,由替加氟与2种调节剂吉美嘧啶、奥替拉西钾组成。吉美嘧啶是二氢嘧啶脱氢酶抑制剂,可减缓5-FU的代谢速率,维持5-FU在血浆和肿瘤组织中的浓度。奥替拉西钾是乳清酸磷酸核糖转移酶抑制剂,可以抑制5-FU在胃肠道中的磷酸化,减轻5-FU所致的严重消化道不良反应[13]。FLAGS研究结果显示,与5-FU联合顺铂相比,替吉奥联合顺铂方案的口腔黏膜炎、低钾血症和嗜中性粒细胞减少的发生率更低,并能提高患者的生活质量[14-15]。Zheng等[16]报道,胃癌患者术后采用SOX方案辅助治疗较替吉奥单药治疗能显著延长患者的中位无进展生存期。奥沙利铂是第3代铂类化合物,可以提高患者的耐受性,有研究结果显示,奥沙利铂的耳毒性、肾毒性以及恶心呕吐等不良反应发生率均比顺铂低,且给药比顺铂方便[17]。Lee等[18]报道,奥沙利铂联合5-FU的效果不逊色于顺铂联合5-FU,但奥沙利铂的血液毒性和肾毒性更小[19]。SOX方案因其安全可靠的疗效,已被CSCO指南列为Ⅰ类推荐。
SOX方案虽然可以替代5-FU联合顺铂方案,但不良反应发生率仍然很高,可引发神经系统、消化系统和造血系统等程度不等的损害。康艾注射液的主要活性成分为人参皂苷、黄芪皂苷和黄芪多糖等,可诱导肿瘤细胞凋亡,具有保护骨髓和调节免疫的作用,同时能提高T淋巴细胞、B淋巴细胞对肿瘤的杀伤能力,改善放化疗过程中的不良反应。多项报道指出,在常规化疗基础上加用中药方案,可发挥增效减毒作用,可降低化疗药引起的免疫抑制,减轻化疗药的消化道不良反应,还能增强化疗药的抗肿瘤作用,逆转化疗药耐药[20-22]。
本研究结果显示,SOX方案治疗晚期胃癌患者的ORR为28.21%,与相关研究报道一致[23-24]。但ORR远低于Koizumi[25]报道的59%,可能与G-SOX试验入选ECOG评分0~1分的患者占98%有关,患者的基础状况良好可增加对化疗药的敏感性和耐受性。本研究结果显示,SOX方案加用康艾注射液,观察组与对照组患者近期疗效的差异无统计学意义(P>0.05);但治疗后KPS评分方面,观察组患者明显优于对照组,差异有统计学意义(P<0.05),表明加用康艾注射液明显提高患者的生活质量,与李勇等[26]的报道一致。另外,观察组患者血清肿瘤标志物CA19-9、CA72-4和CEA水平在治疗后均低于对照组,免疫功能指标CD4+、CD8+和CD4+/CD8+水平均明显改善,提示康艾注射液联合SOX方案治疗晚期胃癌,可增强患者的免疫功能,与谭添等[27]的报道一致。奥沙利铂联合替吉奥治疗会给患者带来以血液学毒性、胃肠道毒性和神经毒性为主的不良反应。本研究结果发现,康艾注射液联合SOX方案能明显改善患者白细胞减少、中性粒细胞减少的发生,降低手足综合征、周围神经毒性和肾功能损害等不良反应的发生率,提示康艾注射液具有降低化疗药毒性的作用,具体作用机制仍需进一步探索。
综上所述,对于晚期胃癌患者,在SOX方案化疗的基础上加用康艾注射液治疗,可改善患者的健康状况,缓解临床症状,降低肿瘤标志物水平,提高身体免疫功能,且可增效减毒,具有良好的应用前景。

