伴有+8染色体异常的骨髓增生异常综合征患者的临床和实验室特征分析
张玥 吴萍 艾珂欣 李敏明 邓程新 耿素霞 陆泽生 翁建宇 杜欣
骨髓增生异常综合征(MDS)是一组异质的克隆性造血干细胞疾病,其特征是无效的造血功能引起一系或多系血细胞减少,并且高风险向急性髓系白血病(AML)转化[1]。MDS的细胞遗传学异常是最有价值的独立预后影响因素[2],约70%的MDS患者在初诊时有克隆性染色体畸变,染色体畸变对恶性细胞的行为、疾病进展、对治疗药物的反应及MDS患者的总体存活率有很大的影响[3-5]。+8染色体异常(简称+8异常)是成人MDS患者中最常见的染色体异常之一,发生率约为10%[6],但其并非MDS的特异性染色体异常,因此伴有+8异常的MDS患者具有何种独立临床特征值得我们进一步的探讨。此外,在MDS国际预后积分系统(IPSS)及MDS修订国际预后积分系统(IPSS-R)中,均将+8异常归属为预后中等核型组,但+8异常的预后意义仍存在很大的争议。基于此,本文对伴有+8异常MDS患者的临床特征进行回顾性分析,现报道如下。
对象与方法
1.对象:纳入2010年1月~2019年9月就诊于广东省人民医院血液科的初诊MDS患者56例。诊断标准参考2019年《骨髓增生异常综合征中国诊断与治疗指南》。其中男39例,女17例,男女比为2.3∶1,年龄17~76岁,中位年龄50(40,63)岁。根据是否伴+8异常将其分为正常核型组(28例)与+8异常组(28例);再根据是否伴+8异常以外的其他染色体异常将+8异常组28例患者分为孤立+8异常组(18例)与非孤立+8异常组(10例)。根据是否伴有U2AF1基因突变将16例+8异常MDS患者分为U2AF1突变组(5例)与U2AF1未突变组(11例)。本研究已通过广东省人民医院伦理委员会审核批准,所有患者均签署知情同意书。
2.方法:收集患者的临床资料(性别、发病年龄、WHO 2016 MDS修订分型、IPSS-R评分)、实验室检查结果[Hb、PLT计数、中性粒细胞计数(ANC)、WBC计数、单核细胞计数(MONO)、骨髓原始细胞(BM Blast)和外周血原始细胞(PB Blast)比例]及染色体核型、U2AF1基因突变情况、总生存(OS)期、血液系统疾病基因突变筛查全套检测结果。根据WHO 2016 MDS修订分型,56例MDS患者中MDS伴多系发育异常(MDS-MLD)8例,MDS伴原始细胞过多44例[其中难治性贫血伴原始细胞增多-1型(MDS-EB-1型)24例、难治性贫血伴原始细胞增多-2型(MDS-EB-2型)20例]、MDS不能分类(MDS-U)4例。按IPSS-R对56例患者进行预后评分,其中极低危(≤1.5分)1例,低危(>1.5~3分)5例,中危(>3~4.5分)19例,高危(>4.5~6分)21例,极高危(>6分)10例。
3.统计学处理:应用SPSS 24.0软件进行统计分析。计量资料以M(P25,P75)表示,组间比较采用χ2检验或Fisher确切概率法。计数资料以例数和百分比表示。生存分析采用Kaplan-Meier法;预后因素评估多因素分析采用多元线性回归分析。使用GraphPad Prism 8.0绘制生存曲线。以P<0.05表示差异有统计学意义。
结 果
1.正常核型组与+8异常组患者的临床资料及实验室检查结果比较:+8异常组患者IPSS-R评分较正常核型组明显增高(P=0.001)。两组患者其余指标比较差异均无统计学意义(P>0.05)。见表1。
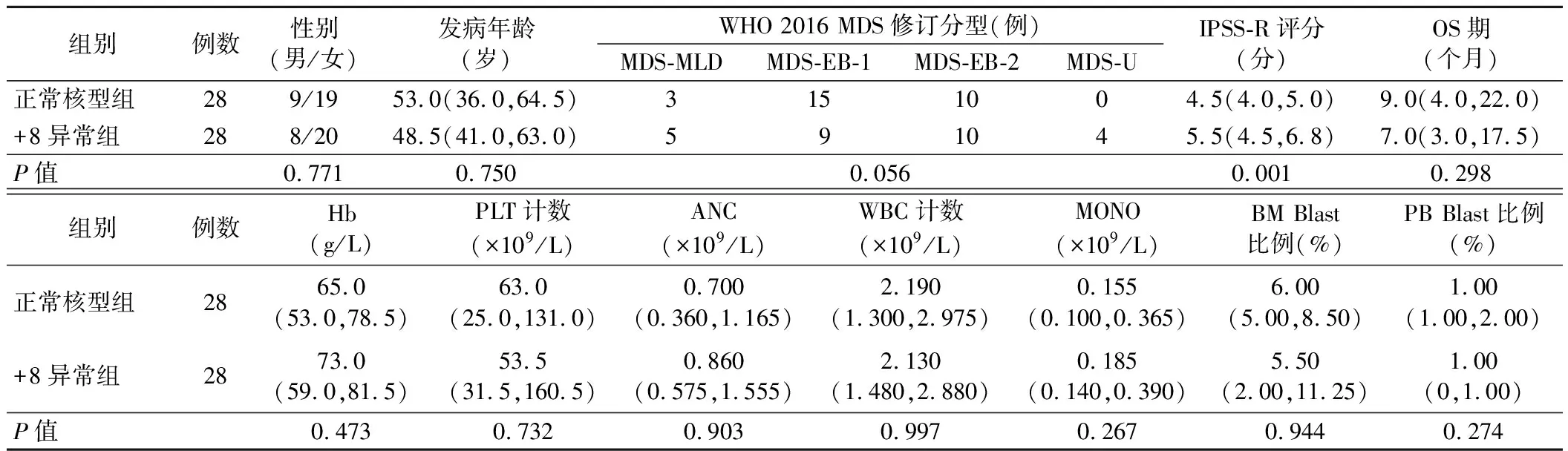
表1 正常核型组与+8异常组患者的临床资料及实验室检查结果比较[M(P25,P75)]
2.孤立+8异常组与非孤立+8异常组患者的临床资料及实验室检查结果比较:两组性别、WHO 2016 MDS修订分型比较差异均有统计学意义(P<0.001)。孤立+8异常组患者发病年龄、IPSS-R评分均低于非孤立+8异常组,OS期长于非孤立+8异常组(P<0.05)。两组其余指标比较差异均无统计学意义(P>0.05)。见表2。
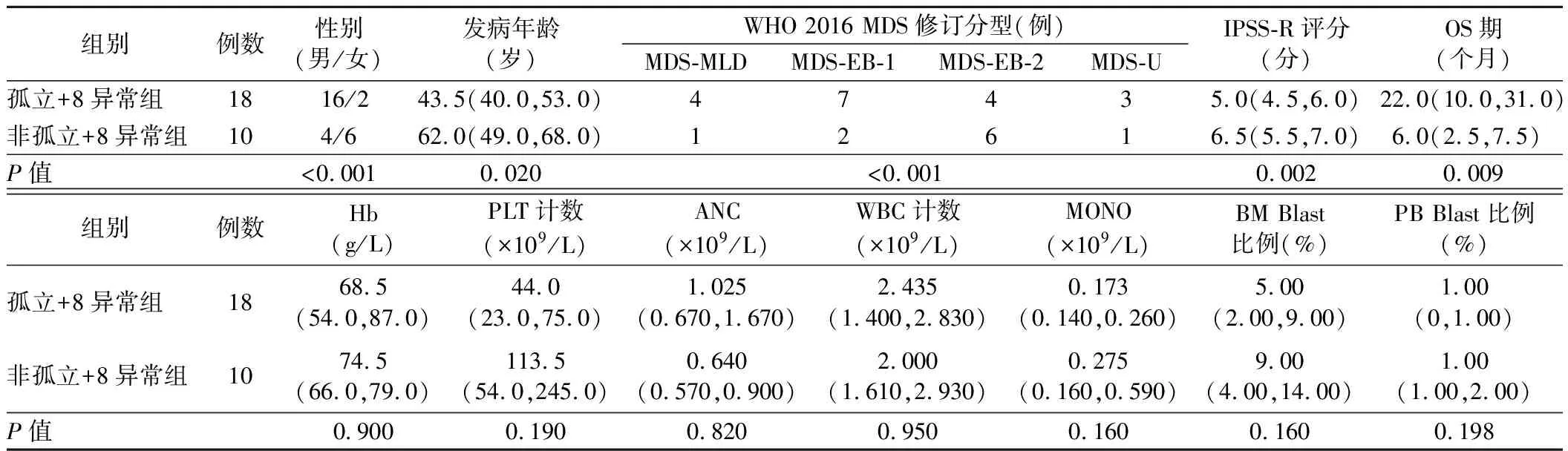
表2 孤立+8异常组与非孤立+8异常组患者的临床资料及实验室检查结果比较[M(P25,P75)]
3.孤立+8异常组与正常核型组患者的临床资料及实验室检查结果比较:孤立+8异常组患者IPSS-R评分高于正常核型组,PB Blast比例低于正常核型MDS组(P<0.05)。两组患者其余指标比较差异均无统计学意义(P>0.05)。见表3。
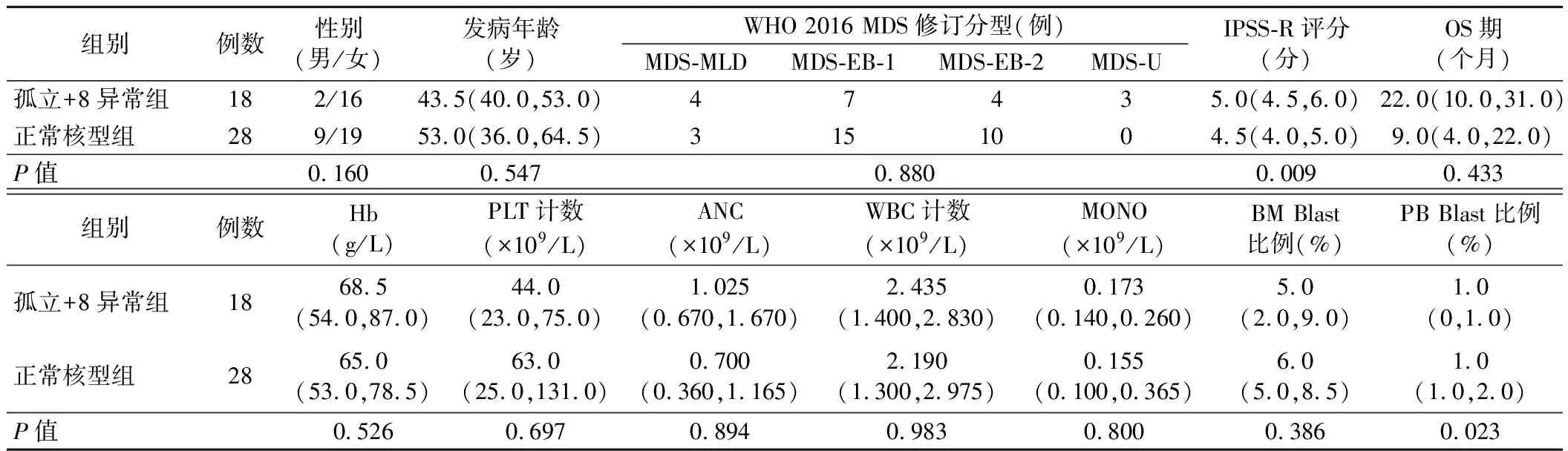
表3 孤立+8异常组与正常核型组患者的一般资料、临床资料及实验室检查结果比较[M(P25,P75)]
4.+8异常MDS患者的生物学特征:56例患者中有34例进行了血液系统疾病基因突变筛查全套检测,其中+8异常MDS 16例,正常核型MDS 18例。常见突变基因按照降序排列如下:ASXL1(7例,20.6%)、RUNX1(7例,20.6%)、U2AF1(6例,17.6%)、TET2(6例,17.6%)、NRAS(6例,17.6%)、SETBP1(5例,14.7%)、TP53(5例,14.7%)、SF3B1(5例,14.7%)、BCOR(4例,11.8%)、DNMT3A(3例,8.8%)、SRSF2(3例,8.8%)、ZRSR2(3例,8.8%)、NPM1(2例,5.9%)。在16例+8异常MDS患者中,均存在至少1种基因突变,其RNA剪接因子相关基因突变发生率(25.0%)高于转录因子相关基因和酪氨酸受体基因突变发生率(17.9%,P>0.05)。+8异常MDS患者U2AF1突变率(31.25%,5/16)高于正常核型患者(5.56%,1/18,P=0.064)。5例U2AF1突变的+8异常MDS患者中,3例为第34位的丝氨酸被络氨酸替代(S34Y),均为男性;2例为第34位的丝氨酸被苯丙氨酸替代(S34F),其中1例同时存在第157位的谷氨酰胺被精氨酸替代(Q157R)。正常核型患者的1例U2AF1突变为S34F。
5.U2AF1突变组与U2AF1未突变组患者的临床资料及实验室检查结果比较:两组患者性别、WHO 2016 MDS修订分型比较差异均有统计学意义(P<0.001)。U2AF1突变组患者发病年龄低于U2AF1未突变组(P=0.030)。两组患者其余指标比较差异均无统计学意义(P>0.05)。见表4。
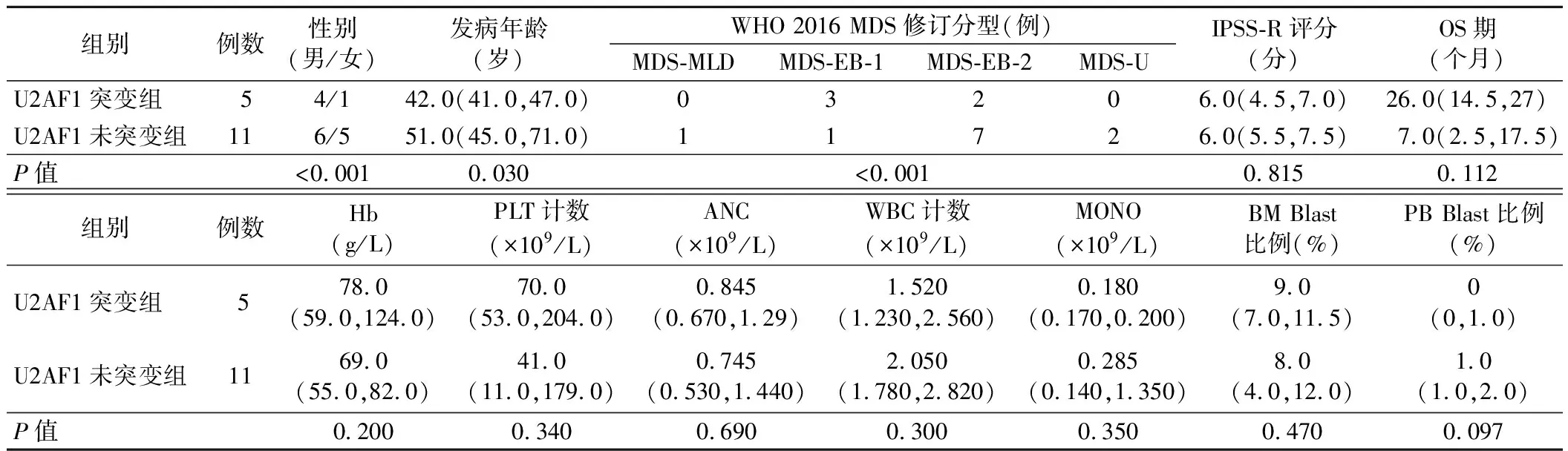
表4 U2AF1突变组与U2AF1未突变组患者的一般资料、临床资料及实验室检查结果比较[M(P25,P75)]
6.影响+8异常MDS患者OS期的多因素分析:将单因素分析中有统计学意义的指标纳入多因素分析,结果显示年龄>65岁(OR=1.223,95%CI1.062~1.989,P=0.0082)、ANC>1.0×109/L(OR=1.957,95%CI1.002~3.307,P=0.0198)是影响+8异常MDS患者OS期的独立危险因素。
7.随访结果:56例MDS患者中4例失访,余52例患者中位OS期为8个月(0~147个月),2年生存率28.8%,共9例进展为AML,其中+8异常核型5例,正常核型4例。孤立+8组、正常核型组及+8异常伴额外核型异常组的患者1年生存率分别为35.71%、46.43%、25%。+8异常组转白率为20.8%,中位转白时间为5个月;正常核型组转白率14.3%,中位转白时间为3.5个月,两组患者转白率与转白时间比较差异均无统计学差异(P>0.05)。截至随访时,56例患者中共有22例死亡,死亡原因多为原发病进展、感染、出血。
8.正常核型组及+8异常组患者生存情况比较:正常核型组患者的OS期为4~22个月,中位OS期为9个月,+8异常组患者的OS期为3~17.5个月,中位OS期为7个月,两组患者OS期比较差异无统计学意义(P=0.298)。见图1。
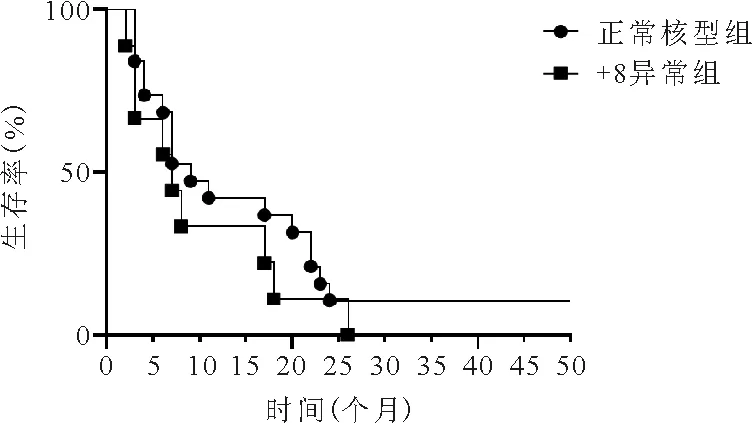
图1 正常核型组与+8异常组患者生存曲线
9.正常核型组患者及孤立+8异常组患者生存情况比较:正常核型组患者的OS期为4~22个月,中位OS期为9个月,孤立+8核型组患者OS期为10~31个月,中位OS期为22个月,两组患者OS期比较差异无统计学意义(P=0.433)。见图2。
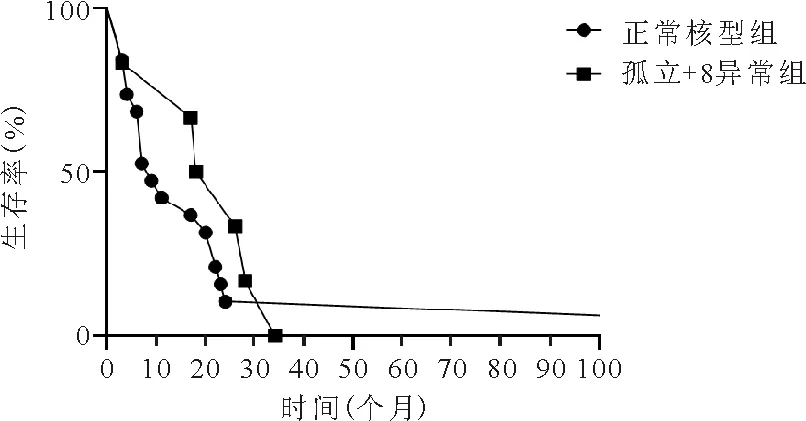
图2 正常核型组与孤立+8异常组患者生存曲线
10.孤立+8异常组与非孤立+8异常组患者生存情况比较:孤立+8异常组患者的OS期为10~31个月,中位OS期为22个月,非孤立+8异常组患者OS期为2.5~7.5个月,中位OS期为6个月,两组患者OS期比较差异无统计学意义(P=0.002)。见图3。
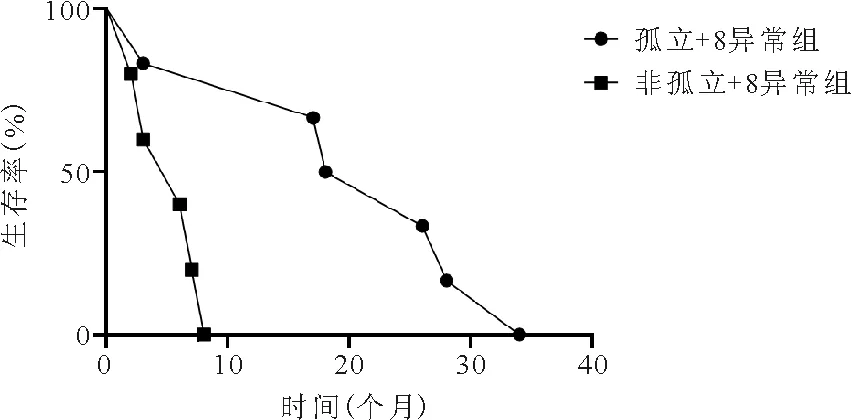
图3 孤立+8异常组与非孤立+8异常组患者生存曲线
11.U2AF1突变组与U2AF1未突变组患者生存情况比较:U2AF1突变组患者的OS期为14.5~27.0个月,中位OS期为26个月,U2AF1未突变组患者OS期为2.5~17.5个月,中位OS期为7个月,两组患者OS期比较差异无统计学意义(P=0.112)。见图4。
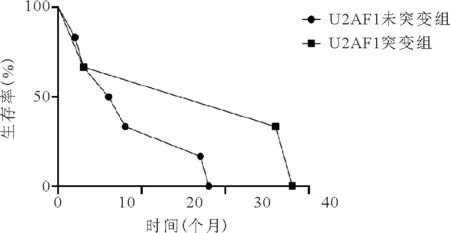
图4 U2AF1突变组与U2AF1未突变组患者生存曲线
作为成人MDS患者中最常见的染色体异常之一,+8异常通常被归类为中等预后,但伴有+8异常的MDS患者其自身的临床特点及其对患者的临床影响仍有待确定。本研究对+8异常MDS患者进行临床特点及核型、基因学的分析,并结合其他的研究结果,进行了相关总结和探讨。
+8异常的发生是否具有性别差异目前仍有争议。有文献报道,孤立+8异常并未在MDS中显示出任何与性别相关的频率差异[7]。亦另有研究结果显示+8异常在男性MDS患者中的发生率更高[8-10]。与后者一致,本研究中孤立+8异常组患者多为男性(男女比为8∶1),而非孤立+8异常组患者男女比为4∶6,两组患者性别构成比具有明显差异。
文献报道孤立+8异常在MDS中主要发生在难治性贫血(RA)、难治性贫血伴有原始细胞过多(RAEB)和慢性粒单核细胞白血病(CMML)患者中[7-8,11-13],本研究中孤立+8异常主要为MDS-EB-1亚型的患者,非孤立+8异常患者更集中于MDS-EB-2,预后评分显示非孤立+8异常患者IPSS-R倾向于较高危组(6.5分比5.0分,P=0.002)。在年龄分布上,Paulsson等[9]的研究结果显示,在MDS中+8异常的频率在各年龄组之间没有显著变化。另一项研究结果发现,+8异常在AML中与较高的年龄有明显关联,即随着年龄的增长,+8异常的比例越来越高[14]。在本研究中,+8异常并未表现出各年龄组的差异,但孤立+8异常组患者中位发病年龄为43.5岁,明显小于非孤立+8异常组的62岁,即孤立+8异常MDS患者发病年龄更小。
相关文献结果显示,+8异常MDS患者中位OS期介于11~25个月之间,Hb、PLT、BMBlast和+8异常合并2个或更多细胞遗传学异常对伴有+8异常MDS患者的OS期有显著影响[8,10]。本研究中+8异常患者中位OS期为7个月,多因素分析结果显示患者发病年龄及ANC对OS期有显著影响;在+8异常组与正常核型组、孤立+8异常组与正常核型组两组患者的分析对比中发现,其临床与实验室检查结果及生存情况比较差异均无统计学意义,即+8异常在MDS中未表现出明显的临床影响。另外,本研究中非孤立+8异常MDS患者较孤立+8异常MDS患者的OS期更短。
基因突变是近年来MDS分子生物学研究的热点,U2AF1、ZRSR2、IDH1、IDH2及ASXL1突变与伴+8异常MDS的发病密切相关[15-18]。其中U2AF1基因位于21号染色体长臂,为RNA剪接因子相关基因,与MDS患者预后不良相关,该基因突变的患者具有更高的白血病转化风险[17,19]。本研究中16例+8异常MDS患者进行基因检测发现,5例存在U2AF1基因突变;而18例正常核型患者中仅1例存在该基因突变,提示U2AF1突变在+8异常患者中发生率高。通过分析U2AF1突变+8异常患者的特征发现,5例U2AF1突变+8异常患者全部为孤立+8异常,多为男性,均为MDS-EB亚型,提示U2AF1突变与孤立+8异常密切相关。猜测其原因可能是U2AF1突变引起RNA剪切改变,导致下游一系列基因的改变,使染色体核型不稳定,从而导致了染色体异常[15]。
综上所述,本研究对+8异常MDS患者进行临床特点及核型、基因学的分析,发现伴有+8异常的MDS患者的发病年龄及ANC对其OS期有显著影响,但与临床及实验室特征无明显相关性。另外,孤立+8异常的MDS患者发病年龄较小,以男性居多,集中分布在MDS-EB-1中,并与U2AF1基因突变密切相关。本研究为单中心回顾性研究,研究结果可能存在偏移,因此在后续的研究中,仍需更大样本的研究对这些结果进行验证和分析,发现更重要的预后因素,从而指导临床治疗决策。

