腹腔镜二级脾蒂离断法脾切除术治疗急诊外伤性脾破裂患者的临床效果
陈维志
福建医科大学附属第一医院急诊医学中心 (福建福州 350000)
脾脏具有独特的解剖学特点,为腹腔脏器中最易受损的器官。外伤性脾破裂(traumatic spleen rupture,TSR)通常合并失血性休克、多脏器损伤,病死率可达70%[1]。全脾切除术是直接有效的治疗方法,也是既往临床治疗TSR患者最主要的方案。随着微创外科技术水平的提升,TSR的治疗逐渐向微创、保脾方向发展,腹腔镜技术的治疗效果逐渐被认可。既往学者对腹腔镜二级脾蒂离断法脾切除术的应用效果关注点多为手术相关指标、术后恢复效果、并发症等方面,而对于其对患者炎症反应、免疫功能的变化关注较少。基于此,本研究旨在分析腹腔镜二级脾蒂离断法脾切除术治疗急诊TSR患者的效果及安全性,现报道如下。
1 资料与方法
1.1一般资料
回顾性分析2018年4月至2020年8月我院收治的78例急诊TSR患者的临床资料,依照治疗方案的不同分为对照组(37例)和试验组(41例)。对照组男20例,女17例;年龄27~49岁,平均(38.16±5.04)岁;受伤至入院时间0.2~2.0 h,平均(1.06±0.39)h;美国创伤学会脾脏损伤(the American Association for the Surgery of Trauma,AAST)分级:Ⅰ级19例,Ⅱ级14例,Ⅲ级4例;致伤原因:交通事故伤21例,钝器伤11例,高空坠落伤3例,其他伤2例。试验组男25例,女16例;年龄27~49岁,平均(39.14±4.38)岁;受伤至入院时间0.3~2.0 h,平均(1.11±0.35)h;AAST分级:Ⅰ级20例,Ⅱ级16例,Ⅲ级5例;致伤原因:交通事故伤20例,钝器伤16例,高空坠落伤2例,其他伤3例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准。纳入标准:经腹部超声、CT等检查确诊为TSR;均行手术治疗,且临床资料完整;未累及其他脏器损伤;免疫功能正常。排除标准:迟发性脾破裂;血流动力学不稳;循环代偿能力欠佳;并发肋骨、脊椎、骨盆骨折;伴有血气胸;既往有腹部手术史;未顺利完成手术;伴有血液系统疾病。
1.2方法
对照组行开腹脾切除术治疗:予以患者静脉复合麻醉,麻醉满意后,患者取仰卧位,垫高头部,消毒铺巾,于腹部正中位置做一切口,约20 cm,然后使用负压吸引器(上海聚慕医疗器械有限公司,MC-600A)抽吸腹腔内积液,再将胃牵拉至右侧,切断脾胃韧带,暴露胰尾、胃后壁,之后将脾动脉结扎后向上牵拉,分离脾肾、脾膈、脾结肠韧带,暴露脾蒂并切断,移除脾脏,止血,置管,缝合。
试验组行腹腔镜二级脾蒂离断法脾切除术治疗:腹腔镜选用奥林巴斯型号TC200,予以患者静脉复合麻醉,麻醉满意后,患者取仰卧位,消毒铺巾,垫高头部、左侧腰部,约45°,建立CO2气腹,于脐上3 mm处做一切口,约10 mm,置入腹腔镜,于剑突下、左腋中心、腋前线肋下缘分别穿刺,分别置入5、10、5 mm Trocar,根据患者术前影像学检查结果确定的手术方法(全脾切除术或部分脾切除术),经腹腔镜探查,推开胰尾,使脾脏下极暴露,超声刀切断脾脏下二级血管、脾结肠韧带,离断脾肾、脾膈、脾结肠韧带,使用合成夹结扎粗大血管,在暴露脾蒂后离断脾动静脉、脾蒂,然后切除脾脏后探查肝脏损伤情况,打开胃结肠韧带,确认是否存在胃、胰腺、十二指肠损伤,探查肠功能,之后经主操作孔取出脾脏,确认无活动性出血后置管,缝合。
两组术后均采用统一抗感染等干预方案。
1.3评价指标
(1)手术相关指标:记录两组的胃肠道功能恢复时间、住院时间、术中失血量及术后引流量。(2)分别于术前、术后3 d检测两组的炎症因子和免疫功能指标:采集患者10 ml空腹静脉血,将其中8 ml离心(3 500 r/min,时间10 min)分离取血清,使用全自动生化分析仪(德国西门子,ADVIA2400型),采用免疫透射比浊法测定血清免疫球蛋白(immunoglobulin,Ig)A、IgM、IgG水平(试剂盒由长春汇力生物技术有限公司提供),使用酶联免疫吸附法(试剂盒由北京万泰生物药业股份有限公司提供)测定肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)水平;剩余2 ml全血使用墨汁吞噬试验(试剂盒由广州泛思生物科技有限公司提供)测定白细胞计数(white cell count,WBC)水平。(3)并发症发生情况:统计两组术后出血、胰瘘、切口感染、皮下气肿等并发症发生情况。
1.4统计学处理
2 结果
2.1两组手术相关指标比较
试验组胃肠道功能恢复时间、住院时间均短于对照组,术中失血量、术后引流量均少于对照组,差异均有统计学意义(P<0.05),见表1。
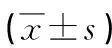
表1 两组手术相关指标比较
2.2两组炎症因子比较
术前,两组TNF-α、IL-6、WBC水平比较,差异无统计学意义(P>0.05);术后3 d,两组TNF-α、IL-6、WBC水平均高于术前,而试验组TNF-α、IL-6、WBC均低于对照组,差异有统计学意义(P<0.05),见表2。
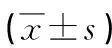
表2 两组炎症因子对比
2.3两组免疫功能指标比较
术前,两组IgA、IgM、IgG水平比较,差异无统计学意义(P>0.05);术后3 d,两组IgA、IgM、IgG均低于术前,而试验组高于对照组,差异有统计学意义(P<0.05),见表3。
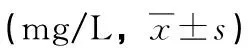
表3 两组免疫功能指标比较
2.4两组并发症发生情况比较
试验组出现术后出血1例,切口感染1例,皮下气肿2例,并发症发生率为9.76%(4/41);对照组出现术后出血3例,胰瘘2例,切口感染3例,皮下气肿3例,并发症发生率为29.73%(11/37)。试验组并发症发生率低于对照组,差异有统计学意义(χ2=4.995,P=0.025)。
3 讨论
随着交通、建筑业的发展,TSR患者逐渐增多。急诊TSR具有病情危急的特点,可对患者生命安全构成威胁。传统开腹脾脏切除术是临床常用的治疗方法,对于难以保留脾脏的TSR患者的效果确切,但其创伤较大,术中对脾门血管辨认难度大,易损伤胰尾、脾蒂血管等,增加并发症发生风险。腹腔镜的应用,使得临床术式趋于微创发展。腹腔镜手术对于脾蒂的处理多采用离断脾脏周围韧带后经切割器离断脾门血管,为一级脾蒂离断法,具有方便、快捷的优点,但对于脾门组织过宽者往往需多次进行,这可能会导致部分血管未完全离断、钉合不牢等并发症,故其临床应用受限。二级脾蒂离断法强调直接分离脾蒂二级分支,具有确切可靠、残端缺血坏死组织少的优势,同时能减少术后脾发热、胰腺损伤等并发症的发生[2]。既往研究结果显示,对于血流动力学稳定的TSR患者,经二级脾蒂精确离断法腹腔镜脾切除术微创治疗具有较高的安全性[3]。有研究表明,腹腔镜脾切除术中二级脾蒂离断法相较于一级脾蒂离断法即直线切割器离断,具有手术费用少、并发症发生率低等优点[4]。本研究结果显示,试验组胃肠道功能恢复时间、住院时间均短于对照组,术中失血量、术后引流量均少于对照组,并发症发生率低于对照组,差异有统计学意义(P<0.05),与上述结果类似。
与开腹术比较,腹腔镜二级脾蒂离断法脾切除术具有以下优势[5-6]:(1)术中脾门分支血管解剖清晰度较高,利于彻底结扎止血,不仅能减少术中失血量,还可有效抑制腹腔感染、胰瘘、出血等并发症的发生;(2)根据患者实际情况对脾蒂血管实施针对性处理,并用分离钳夹闭血管,能有效减少失血量,提高术野清晰度,促使手术的顺利进行;(3)微创技术能减少创伤,缩短患者术后恢复时间。因此,腹腔镜二级脾蒂离断法脾切除术治疗急诊TSR患者,能优化手术相关指标,促进患者恢复,减少并发症的发生。
手术创伤通过刺激机体炎性细胞释放大量细胞因子,可参与机体自身损害性炎症反应的生理、病理过程,且炎症因子表达水平越高,创伤程度越大,术后恢复时间越长。TNF-α、IL-6为重要的炎症因子,可参与炎症反应、免疫应答过程,其表达水平与机体创伤程度成正相关。WBC为反映全身炎症反应的重要指标[7-8]。本研究结果表明,腹腔镜二级脾蒂离断法脾切除术治疗急诊TSR患者,能减小对其炎症因子的影响。另外,手术创伤还可引起机体应激反应,而强烈的应激反应可导致患者机体病理生理变化,主要表现为免疫功能抑制。免疫球蛋白为机体重要的免疫效应因子,手术创伤可抑制其在血清中的表达,且抑制程度与手术创伤成正相关[9-10]。本研究结果表明,手术可引起机体免疫抑制,但腹腔镜二级脾蒂离断法脾切除术对患者免疫功能影响较小。在行腹腔镜二级脾蒂离断法脾切除术时应注意:对于门静脉高压患者,因其脾蒂周围血管迂曲扩张,操作中出血的风险较高,故在分离、结扎、离断等过程中,动作需轻柔、操作需仔细,术中需仔细辨认解剖层次,避免暴力操作引发再出血。
综上所述,腹腔镜二级脾蒂离断法脾切除术治疗急诊TSR患者,不仅能优化手术相关指标,还能减轻炎症反应,提升免疫功能,安全性高。

