腹腔镜全直肠系膜切除术治疗低位直肠癌的效果分析
张 力,林圳滨,范小华,梁学敏,李俊苗
(广东省中医院肛肠科,广东 广州 510120)
直肠癌是一种瘤体分布在齿状线相交直肠乙状结肠部位的消化系统恶性肿瘤,随着公众生活水平与生活结构的变化,其发生率不断升高,而中低位直肠癌约占直肠癌的70%[1-2]。据统计,低位直肠癌(low rectal carcer,LRC)发病率多年来在广东省全省不同癌种中名列前茅[3-4]。近期研究显示,LRC转移及术后复发是导致患者死亡的主要原因,而手术及尽早根治性干预是减少死亡最有效的手段[5-7]。研究表明,腹腔镜全直肠系膜切除术治疗直肠癌可减少炎症应激反应的发生,降低创伤程度,促进患者术后恢复,且并发症发生率低,优势显著,故近年来其逐渐替代传统开放手术成为治疗LRC的“金标准”[8-9]。但关于LRC患者行腹腔镜全直肠系膜切除术后炎症应激反应的研究及文献报道有限。因此,本研究拟通过对135例LRC患者的临床资料进行回顾性分析,探讨腹腔镜全直肠系膜切除术对LRC患者近期疗效及远期生存率的影响,旨在为该病治疗方案的制订提供参考。
1 资料与方法
1.1 临床资料
纳入2014年5月至2017年8月在我院行腹腔镜全直肠系膜切除术的68例LRC患者为腹腔镜组,另选取本院同期行传统开腹根治术的67例LRC患者作为开腹组。纳入标准:①病理检查证实为原发性LRC(腹膜返折以下);②肿瘤未累及肛门括约肌,肿瘤浸润肠壁≤1/2圈;③术前未接受放化疗、免疫治疗等;④身体状况良好,耐受手术;⑤周围未侵袭膀胱、前列腺或阴道;⑥TNM分期为Ⅱ~Ⅲ期;⑦为广州市常住居民,且临床与随访数据完整。排除标准:①行腹腔镜中转开腹术;②妊娠期或哺乳期女性;③术中发生肿瘤腹腔扩散或远处转移;④完全性肠梗阻;⑤有LRC手术治疗史;⑥重度脑血管疾病;⑦血液系统病变;⑧凝血功能缺陷;⑨重度心肝肾功能不全。2组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经我院医学伦理委员会批准(ZE2020-260-01),所有患者均签署手术知情同意书。

表1 患者基线资料比较
1.2 方法
腹腔镜组患者手术遵循腹腔镜根治术原则[10],患者全身麻醉下气管内插管,取截石位,保证头低30°,术者站于患者右侧,第一助手于患者左侧,持镜者与术者同侧,于脐孔或脐上部1 cm建立CO2人工气腹,保持压力在13 mmHg左右,置入10 mm Trocar,借助超声刀打开乙状结肠右侧系膜以及直肠右旁沟腹膜,直抵骶前间隙,逆行分离直肠下血管左方Denonvillier筋膜,充分显露输尿管;采用锁扣夹,于肠系膜下静脉、下动脉最底部行离断处理(图1a、b),朝下分离至直肠右旁沟腹膜;分离乙状结肠、直肠右旁沟腹膜及前壁Denonvillier筋膜(切记保持筋膜完整性),切断两侧的侧韧带,游离直肠至距肿瘤下方≤3 cm处(图1c),过程中注意保护盆神经丛、腹下神经等(图1d)。选择左下腹作为手术入路,作长为5~7 cm的切口,切除直肠肿瘤,清扫区域内淋巴结,借助吻合器与荷包关闭器对近端结肠行回纳肠段处理;重建气腹,于肛门置入管状吻合器,腹腔镜直视下吻合直肠残端和近端结肠端(图1e),取出吻合器,确认切割圈完整。对于肿瘤下缘距离肛缘不足4 cm的患者,行Miles手术;对于盆腔狭小、BMI>40 kg/m2、手术暴露不理想或操作困难的患者,改用手助腹腔镜直肠全切除术。最后仔细冲洗盆腔,放置合适的引流管,逐层缝合。
开腹组患者主要以Miles手术和Dixon手术为主。患者取膀胱截石位,于下腹中部作一长约10 cm的手术切口,分离皮下组织,然后切除肠系膜下动脉根部周围组织和淋巴结,电刀分开直肠及其周围的肠系膜至肿瘤远端边缘2 cm处,切开腹膜,将腹膜返折,切断直肠外侧韧带至肛尾韧带、肛提肌。注意保护腹膜后直肠两侧的输尿管,肿瘤切除后行肠管吻合术。对于肿瘤侵犯会阴的患者,常规切除直肠和肿瘤,不保留肛门。盆腔冲洗、置管、缝合方法与腹腔镜组大致相同。
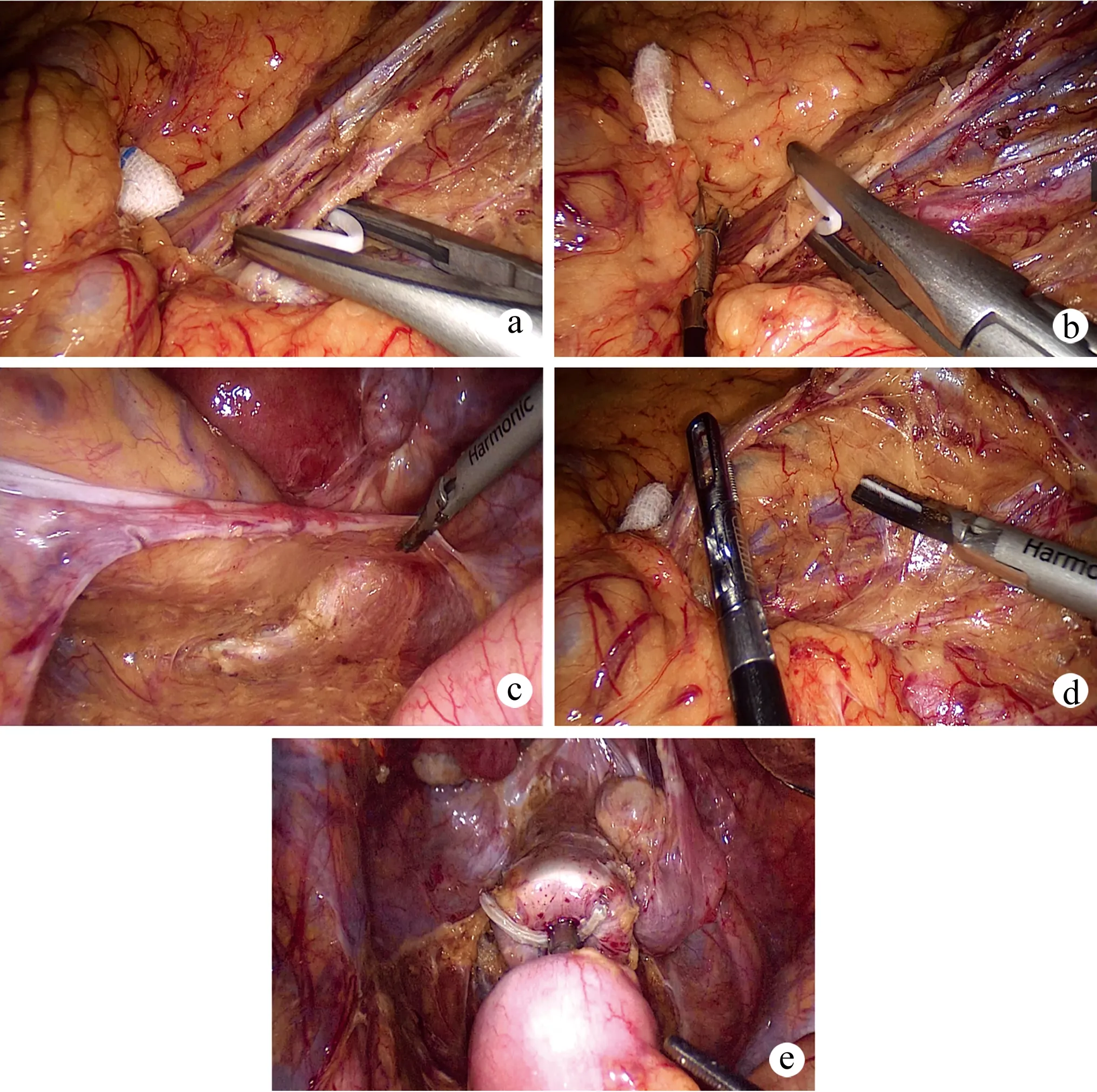
a、b:采用锁扣夹于肠系膜下静脉、下动脉最底部行离断处理;c:后方游离直肠至距肿瘤下方≤3 cm处;d:保护盆神经丛、腹下神经;e:吻合器行端端吻合
1.3 观察指标
对比2组患者手术时间、术中出血量、淋巴结清扫数目、术后肛门排气时间、术后进食时间及住院时间等围术期指标。于术前及术后4 d检测患者白细胞计数(white blood cell count,WBC)及C反应蛋白(C-reactive protein,CRP)含量。比较2组患者术后并发症发生情况,并采用Clavien-Dindo分级划分并发症等级[8]:Ⅰ级,通过止吐利尿药、解热镇痛药、物理治疗或在床旁可以处理的切口问题,不需要加用其他药物及内镜介入手术等方法处理;Ⅱ级,需要加用其他药物,必要时需要输血和(或)全肠外营养治疗;Ⅲ级,需要外科手术、内镜或介入干预治疗;Ⅳ级,危及生命,甚至需转至ICU治疗;Ⅴ级,死亡。于术前及术后1个月、6个月、1年采用胃肠生活质量量表(gastrointestinal quality of life index,GIQLI)评价患者生活质量,该量表包括自觉症状、特殊疾病状况、躯体生理功能、社会活动、心理情绪状况五大类,共计36条,总分144分,得分越高,提示患者健康情况越好[11]。术后患者均通过家访、门诊或电话联系进行随访,从手术日起开始计算,所有患者均随访3年(随访期间死亡的患者,以死亡日期计算),比较2组患者术后3年生存率。
1.4 统计学分析
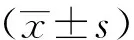
2 结果
2.1 患者围术期指标比较
腹腔镜组手术时间长于开腹组,术中出血量低于开腹组,差异均有统计学意义(P<0.001)。而2组淋巴结清扫数目比较,差异无统计学意义(P>0.05)。腹腔镜组住院时间、术后进食时间、术后肛门排气时间均显著短于开腹组(P<0.001),见表2。

表2 患者围术期指标比较
2.2 患者炎症应激指标比较
2组术前WBC、CRP水平比较,差异无统计学意义(P>0.05)。腹腔镜组术后4 d WBC水平与术前比较,差异无统计学意义(P>0.05),2组术后4 d CRP水平均较术前明显上升(P<0.001),且开腹组WBC、CRP水平均显著高于腹腔镜组(P<0.001),见表3。

表3 炎症应激反应指标比较
2.3 患者术后并发症比较
腹腔镜组术后并发症发生率显著低于开腹组(P<0.05),见表4。2组均无复发病例。采用Clavien-Dindo分级划分并发症等级,结果显示,腹腔镜组Ⅰ级4例,Ⅱ级3例,Ⅲ级1例,Ⅳ级1例,Ⅴ级0例;开腹组Ⅰ级9例,Ⅱ级5例,Ⅲ级2例,Ⅳ级3例,Ⅴ级0例,组间比较差异无统计学意义(P=0.979)。
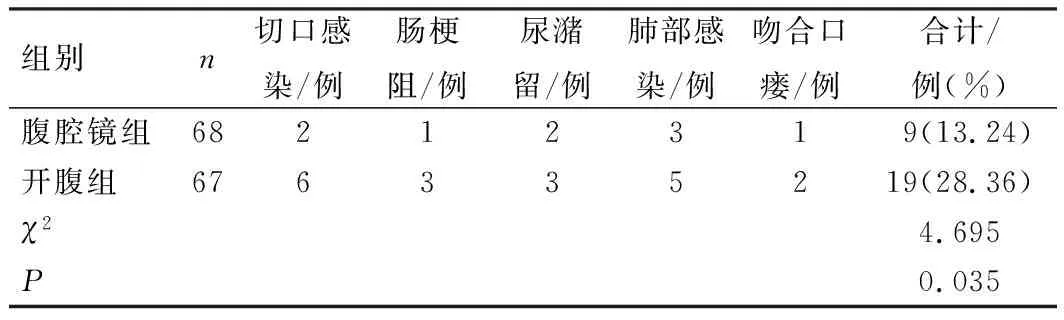
表4 患者术后并发症发生情况比较
2.4 患者手术前后生活质量比较
术前2组患者GIQLI评分比较,差异无统计学意义(P=0.449);术后1个月,2组患者GIQLI评分均较术前降低,但腹腔镜组显著高于开腹组(P<0.001);术后6个月,2组患者GIQLI评分均较术后1个月明显升高,腹腔镜组基本恢复至术前水平,但开腹组恢复较差,差异具有统计学意义(P<0.001);术后1年,2组患者GIQLI评分均较术前明显升高(P<0.001),且腹腔镜组高于开腹组(P=0.014),见表5。
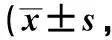
表5 患者手术前后GIQLI评分比较分)
2.5 患者3年生存率比较
经Kaplan-Meier分析显示,腹腔镜组3年生存率为48.53%,开腹组为44.78%,组间比较差异无统计学意义(P=0.152),见图2。
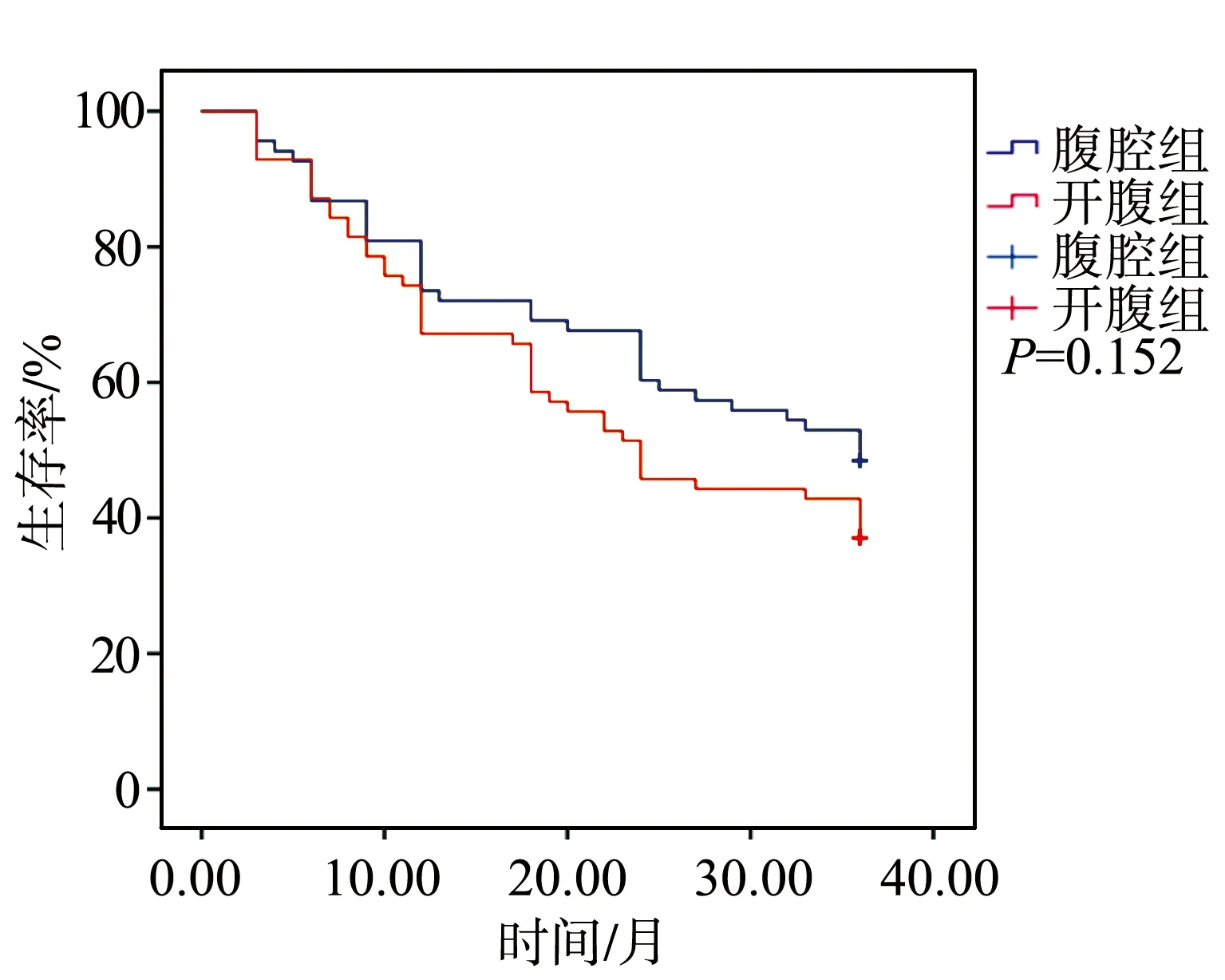
图2 患者生存曲线
3 讨论
结直肠癌是一种好发于中老年人的胃肠道系统恶性肿瘤,严重影响患者的生活质量及生命安全[12]。近年来,结直肠癌的发病率有明显上升趋势,其中直肠癌占比达60%,而中低位直肠癌又占直肠癌发病率的60%~75%[13]。目前,结直肠癌患者的病死率仅次于肝癌及肺癌,且在青年团体中其发病率越来越高[14]。因此,结直肠癌的治疗以早发现、早诊断、早治疗为主[15]。手术是目前公认最为有效的治疗方式[16]。以往传统开腹术式需要作较长的腹部切口,易导致术后疼痛周期延长、腹壁瘢痕、切口疝、切口感染等,增加并发症发生的风险[17]。腹腔镜结直肠癌根治术具有副作用小、恢复快等优点,近年来逐渐替代传统结直肠癌开腹术式[18]。
腹腔镜全直肠系膜切除术是一种新兴的微创术式[9],其疗效与开腹根治术相当,且还可减少手术创伤,促进患者术后快速康复[19],但其操作要求高、手术操作范围广,因而手术时间较传统开腹手术长。本研究结果显示,腹腔镜手术时间显著长于开腹组,印证了以上观点。但是随着此类微创术式的普及,术者和协助人员经验日益丰富,操作更加娴熟,相信腹腔镜手术的时间有望缩短。直肠癌开腹根治术过程中可引起强烈的炎症应激反应,从而影响患者的免疫功能[20]。血浆中的CRP是一类组织受损或感染时,肝细胞在受到不断刺激下产生并大量聚集的非抗体性蛋白,可灵敏地预测炎症反应的发生发展程度,从而最大限度减少直肠癌术中炎症应激反应的发生,一定程度上也可降低吻合口瘘等并发症的发生率,从而改善患者预后[21-22]。近期有研究证实WBC类细胞水平对直肠癌手术相关并发症的发生有重要价值[23]。本研究结果显示,腹腔镜组术后4 d WBC、CRP水平均低于开腹组,说明腹腔镜全直肠系膜切除术可减轻炎症应激反应,其原因可能为开腹根治术属于侵入性操作,对组织损伤较大,易导致炎症应激反应的发生,而腹腔镜手术创伤较小,手术切口牵拉范围较小,未引起较强的应激反应;此外,腹腔镜手术主要为电切电凝,易于实施,可充分止血,因此术中出血量较低,同时不会明显侵犯腹腔中的脏器,患者术后胃肠功能可早日恢复。Komen等[24]的研究结果表明,腹腔镜全直肠系膜切除术对直肠癌患者的胃肠功能损伤小,可减轻患者炎症及应激反应,有利于免疫功能恢复,改善患者预后。本研究结果显示,腹腔镜组住院时间、术中出血量、术后进食时间与术后肛门排气时间均优于开腹组,印证了以上观点。
本研究中患者术后并发症以切口感染、尿潴留、肺部感染、肠梗阻与吻合口瘘等为主,且腹腔镜组并发症发生率(13.23%)低于开腹组(28.36%)。笔者认为,这是由于腹腔镜微创手术创伤小,对患者脏器功能影响小,术后切口感染风险低,卧床时间短,疼痛轻,鼓肺能力得到改善,肺部感染、吻合口瘘、腹胀、腹痛及肠梗阻的发生率均明显低于传统开腹根治术。有研究表明,直肠癌术后并发症一定程度上可影响患者的远期生存率[25]。本研究采用德国学者Eypasc创建的GIQLI评分系统评价患者术后生存质量[26],结果显示,2组术前GIQLI评分无统计学差异;术后1个月,受到手术创伤与术后并发症的影响,2组GIQLI评分皆大幅降低,但腹腔镜组评分依然显著高于开腹组;随着时间的推移,手术对患者的影响越来越小,术后6个月,2组患者生活质量均明显恢复,腹腔镜组患者生活质量大致恢复至术前水平,开腹组恢复相对较差;术后1年,2组患者生活质量均得到大幅提高,且腹腔镜组明显优于开腹组,表明腹腔镜手术在提高患者术后生存质量方面显著优于开腹组。肿瘤种植复发是腹腔镜直肠癌全直肠系膜切除术特有的并发症[27],且术后复发及转移是影响LRC患者术后生存的主要因素,通常在术后3年内发生[28-30]。因此,本研究主要统计患者术后3年生存率,结果显示,腹腔镜组3年生存率为48.53%,开腹组为44.78%,组间比较无统计学差异,提示腹腔镜手术与开腹根治术的远期疗效相当。本研究2组患者3年生存率均较低,这可能是因为纳入的患者就诊时病情已发展至中晚期。
综上,腹腔镜全直肠系膜切除术治疗LRC具有创伤小、疗效确切、术中出血量低、术后胃肠功能恢复快、并发症较少、住院时间短等特点,且其远期疗效与开腹根治术相当。然而该手术操作要求高,需要较强的团队协作,以确保取得高质量的手术结果。

