贵州省鸡源弯曲菌的流行现状及抗生素敏感谱研究
李 轩,谢 春,周 藜,汪淑颖,周 倩,张德著,向 红,
弯曲菌(Campylobacter)作为一种食源性人兽共患病原菌,感染该菌后除了引起腹泻等肠道疾病外,还可能引起菌血症、反应性关节炎及格林-巴利综合征等严重并发症。欧盟最新报告显示弯曲菌病是最常见的人兽共患病,该疾病的83.9%与空肠弯曲菌有关,10.3%与结肠弯曲菌有关[1-2]。在中低收入国家中,弯曲菌是通过动物粪便传播的重要病原菌[3]。家禽(尤其是鸡)是弯曲菌天然宿主,该菌可作为一种共生菌存活在禽类肠道中并持续向外排菌。通过多位点序列分型技术发现全球数据库中引起弯曲菌病的主要克隆复合体与从鸡分离的主要克隆复合体相似[4],在禽类养殖等关键环节采取生物安全措施是降低人类弯曲菌病流行率的最有效策略。贵州省是“全域养鸡、全民吃鸡”的少数省份之一,其禽类养殖业是养殖业中覆盖面最广、商品化程度最高的产业[5]。有必要了解贵州省鸡源弯曲菌的流行现状,预测疾病发生风险。
虽然感染弯曲菌的禽类不需要抗生素治疗,但在预防控制其它疾病的过程中,大量抗生素的使用将产生弯曲菌耐药株。2013年美国疾病控制和预防中心发布的一份报告中表示耐药性弯曲菌被列为“威胁级别严重的微生物”,在对中低收入国家动物源菌株抗生素耐药性(AMR)研究中发现耐药水平最高的是印度和中国[6],形势不容乐观。2020年北京首次报道了一起由多重耐药结肠弯曲菌引起的严重胃肠炎暴发[7]。因不同地区在肉鸡养殖过程中抗生素的选择和用量标准不同,耐药情况存在差异,目前关于贵州省鸡源弯曲菌的耐药现状鲜有报道。
国内外部分地区对鸡源弯曲菌的流行现状做过调查,但贵州省鸡源弯曲菌的流行状况尚未见详细报道。本研究以农贸市场和养殖场肉鸡为研究对象,调查弯曲菌携带情况,评估鸡源弯曲菌耐药表型和多重耐药的流行趋势,分析分离株耐药表型与耐药基因的相关性及交叉耐药情况,以期为指导贵州省肉鸡养殖业抗菌药物的合理使用以及为临床合理用药提供科学依据。
1 材料与方法
1.1 样品采集 将贵州省按东、西、南、北、中划分为5个片区进行随机抽样,在养殖场和农贸市场共采集359份新鲜粪便样本,将棉拭子蘸取粪便后插入Cary-Blair运送培养基中,4 ℃条件下送实验室检测。
1.2 主要仪器与试剂 全自动快速生物质谱检测系统(microflex LT/SH MALDI-MS System)购自布鲁克(北京)科技有限公司;Cary-Blair运送培养基购自青岛海博生物技术有限公司;Bolton肉汤、哥伦比亚血平板购自广东环凯微生物科技有限公司;弯曲菌培养检测试剂盒(双孔滤膜法)、弯曲菌生化检测试剂盒、弯曲菌琼脂稀释法抗生素最低抑菌浓度(MIC)检测试剂盒购自青岛中创汇科生物科技有限公司;Premix Taq(Takara Taq Version 2.0 plus dye)购自宝生物工程(大连)有限公司。
1.3 分离培养 采用双孔板滤膜法分离弯曲菌,挑取适量粪便样本放入促生长增菌液中增菌24 h后,取150 μL滴加于双孔板滤膜上,42 ℃微需氧条件下(5%O2、10%CO2、85%N2)培养48 h,将镜检形态为G-、S形或螺旋形等可疑菌落纯化后进行生化鉴定。
1.4 菌种鉴定 参照国标GB4789.9-2014进行生化鉴定,将生化鉴定为弯曲菌属的菌株通过MALDI-TOF MS进一步鉴定,即用无菌接种环挑取单个菌落均匀涂于靶板上,待菌落干燥后,滴加1 μL CHCA(α-氰基-4-羟基肉桂酸)基质液完全覆盖菌落,在室温下自然干燥后进行检测,每株细菌从点靶到上机重复2次试验。
1.5 药敏试验 参照美国临床实验室标准化研究所(CLSI)推荐的琼脂稀释法(Agar Dilution Method)对菌株进行药敏试验,使用弯曲菌琼脂稀释法抗生素最低抑菌浓度(MIC)检测试剂盒进行试验,其中抗菌药物包含7类11种。42 ℃微需氧培养24 h后读取结果,空肠弯曲菌ATCC33560、结肠弯曲菌ATCC43478作为质控菌株。对红霉素、环丙沙星、四环素的敏感性判定依据CLSI M45-3rd版,对其余抗生素的敏感性判定依据美国NARMS(National Antimicrobial Resistance Monitoring System)和欧盟EUCAST(European Committee on Antimicrobial Susceptibility Testing)的推荐标准。
1.6 耐药基因检测 参照文献[8-10],ermB、cmeA、cmeB、cmeC、RE-cmeABC、aadE3-sat4-aphA-3、cfr、Tet(O)、blaOXA-61耐药基因的引物由宝生物工程(大连)有限公司合成。PCR反应体系为:2×Premix Taq12.5 μL,10 pmoL/mL上下游引物各1 μL,DNA模板1 μL,无菌ddH2O补足至25 μL。反应体系:95 ℃预变性5 min,95 ℃变性30 s,54.5~56.5 ℃(不同基因退火温度不同)退火30 s,72 ℃延伸1 min,30个循环,最后72 ℃延伸5 min。取1 μL扩增产物加样于1.0%琼脂糖凝胶中,120 V电压下电泳20 min,通过凝胶成像系统成像。
1.7 统计学分析 运用SPSS 22.0软件进行统计学分析,计数资料组间比较采用χ2检验,P<0.05为差异有统计学意义。不同抗菌药物间的耐药相关矩阵使用GraphPad Prism 8.0软件绘制(|r|<0.4为弱相关,0.4≤|r|≤0.7为中等相关,|r|>0.7为强相关。
2 结 果
2.1 流行病学分析 359份粪便样本共检出156株(43.5%)弯曲菌,包括68株(43.6%)空肠弯曲菌和88株(56.4%)结肠弯曲菌;春冬和夏秋季节弯曲菌检出率分别为43.1%和44.0%,两者之间差异无统计学意义(χ2=0.033,P>0.05);在不同地理区域上,东、西、南、北、中部地区检出率分别是32.3%、48.0%、50.5%、45.2%、54.3%;工业化养殖和自由散养鸡群中弯曲菌检出率分别为28.1%和45.5%,差异有统计学意义(χ2=7.014,P<0.05);养殖规模小于10 000只鸡的弯曲菌检出率高于规模大于10 000只的养殖场(χ2=21.137,P<0.05);养殖场与居民生活区距离小于2.5 km的鸡源弯曲菌检出率高于距离大于2.5 km的检出率(χ2=25.096,P<0.05)(见表1)。
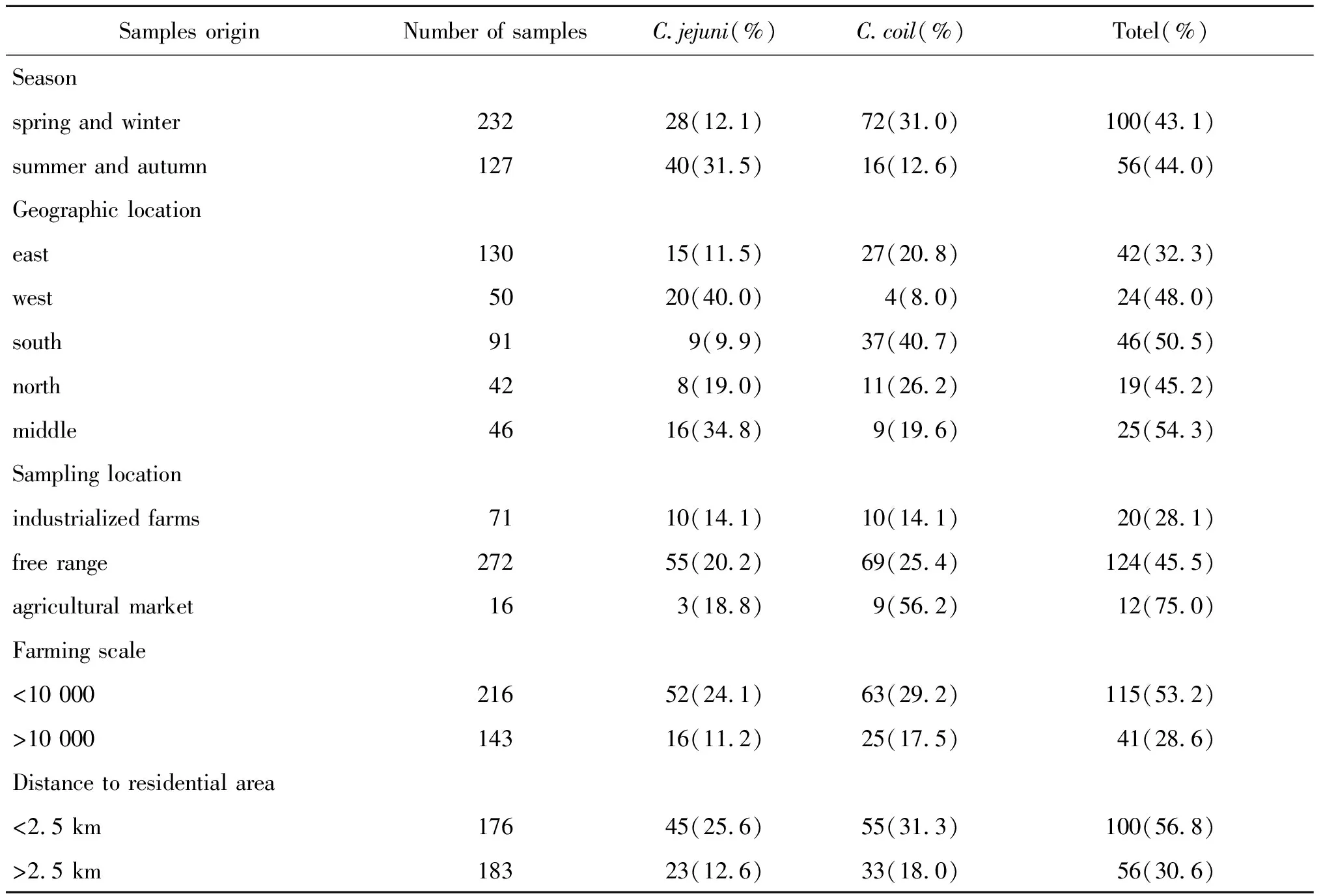
表1 鸡源弯曲菌的检出情况Tab.1 Detection status of Campylobacter from chicken
2.2 耐药分析 对其中的84株弯曲菌进行药敏实验,发现分离株对11种常见抗生素表现出不同程度的耐药,耐药率介于2.3%~90.4%(表2)。空肠弯曲菌对萘啶酸(83.3%)和四环素(83.3%)的耐药率最高,其次为环丙沙星(66.6%)、阿奇霉素(16.6%)、链霉素(16.6%)和克林霉素(16.6%);结肠弯曲菌对萘啶酸(93.3%)、四环素(90.0%)、环丙沙星(86.6%)的耐药率较高,对氯霉素(6.6%)、氟苯尼考(1.6%)的抗性较弱;结肠弯曲菌分离株对红霉素、阿奇霉素、庆大霉素、链霉素和泰利霉素的耐药率显著高于空肠弯曲菌;不同地域(东、南、西、北、中)、养殖方式(工业化和自由放养)、不同养殖规模弯曲菌分离株耐药率位于前3位的抗生素均为均为萘啶酸、四环素和环丙沙星,其耐药率分别介于82.3%~100%、82.3%~92.2%和79.4%~94.4%。
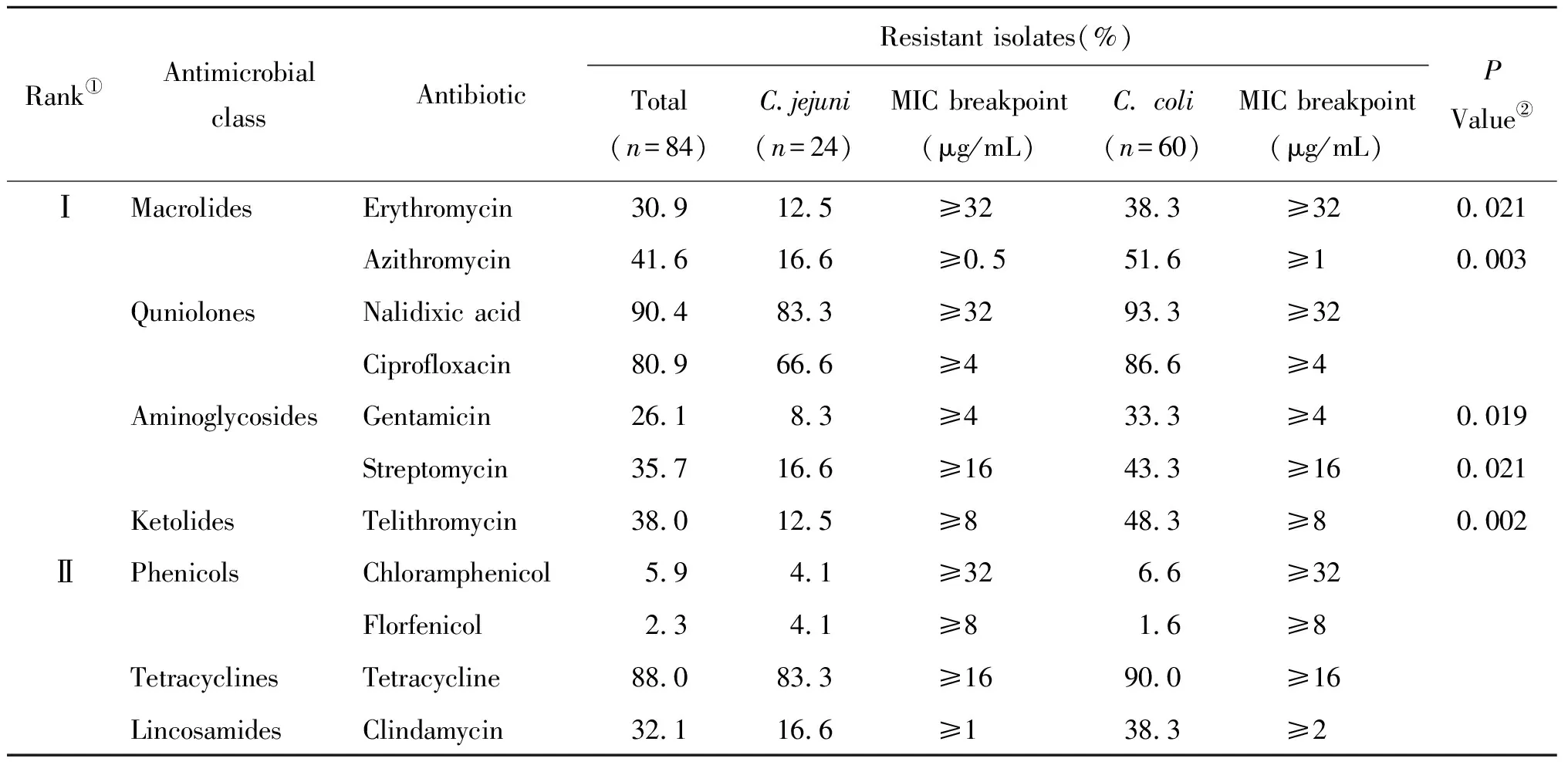
表2 84株弯曲菌对11种抗生素的耐药情况Tab.2 Drug resistance rate of 84 Campylobacter isolates eleven antimicrobial agents
84株弯曲菌分离株对11种抗生素共产生了38种耐药谱,空肠弯曲菌产生了13种耐药谱,结肠弯曲菌产生了25种耐药谱,空肠弯曲菌和结肠弯曲菌的优势耐药图谱都为NAL-CIP-TET。ERY-AZI-NAL-CIP-GEN-STR-CHL-TET-TEL-CLI、NAL-CIP-TET、NAL-CIP、NAL-TET是空肠弯曲菌和结肠弯曲菌的共有谱型。81.0%的菌株表现出多重耐药,其中3株菌对10种抗生素耐药。对3种、9种抗生素耐药的菌株较多,分别占31%和8.3%。空肠弯曲菌和结肠弯曲菌的多重耐药率分别为54.2%、91.7%,差异存在统计学意义(χ2=13.297,P<0.05),结肠弯曲菌与空肠弯曲菌多重耐药情况相比较严重(表3)。
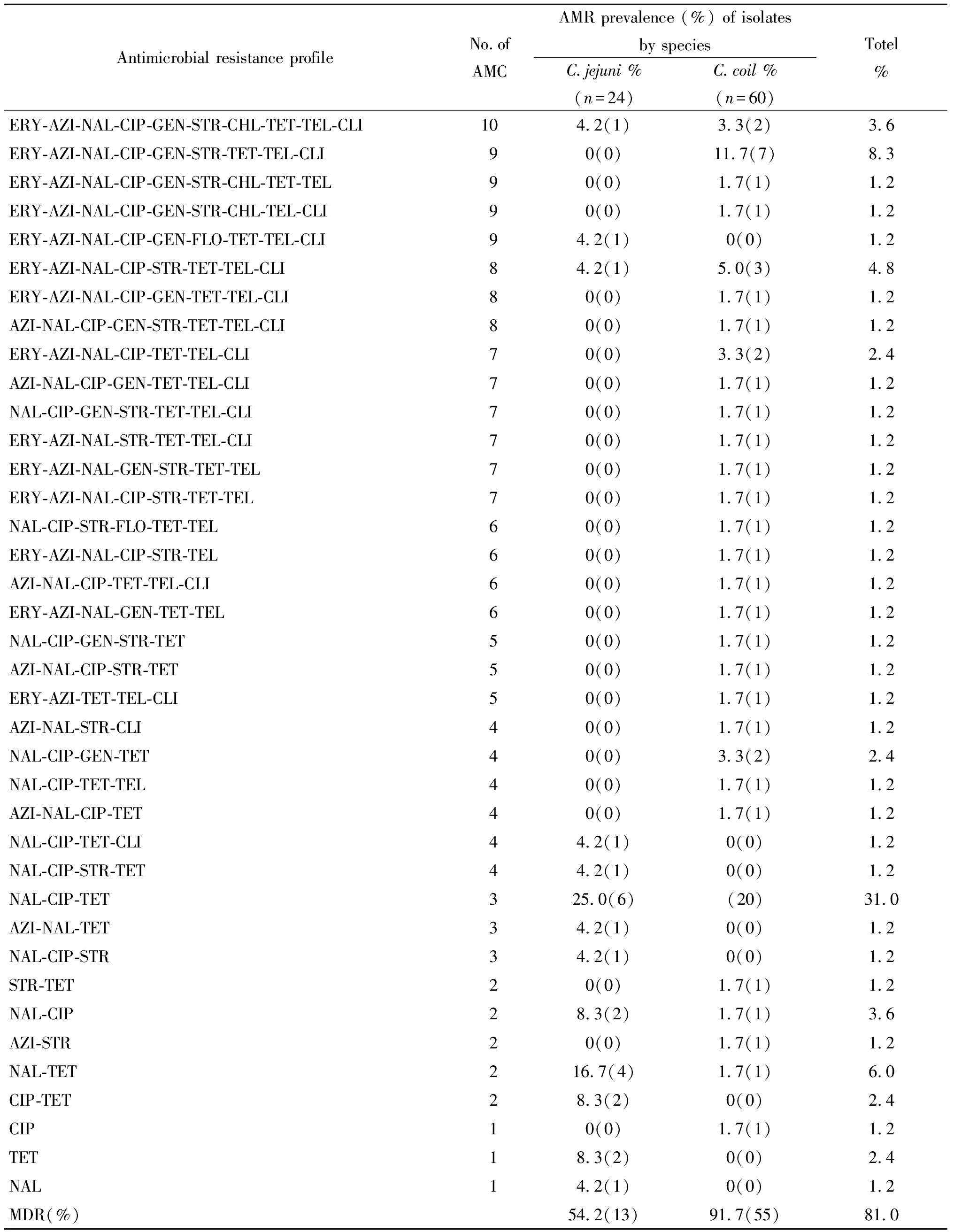
表3 84株弯曲菌耐药类型构成Tab.3 Major antimicrobial resistance patterns of 84 Campylobacter
2.3 耐药基因 通过PCR检测84株弯曲菌分离株的耐药基因(见图1),结果显示,cmeA、Tet(O)、cmeC、cmeB、blaOXA-61、cfr、ermB、aadE-sat4-aphA-3、RE-cmeABC基因检出率由高到低依次为98.8%、98.8%、96.4%、92.8%、76.1%、36.9%、28.5%、20.2%、16.6%。其中耐药基因cmeB(P<0.05)、blaOXA-61(χ2=12.705,P<0.05)、cfr(χ2=8.594,P<0.05)、ermB(χ2=6.743,P<0.05)在空肠弯曲菌和结肠弯曲菌中的检出率差异存在统计学意义。同时发现耐药基因cmeB(χ2=6.131,P<0.05)、ermB(P<0.05)、cfr(χ2=18.525,P<0.05)、blaOXA-61(χ2=10.070,P<0.05)在夏秋和春冬季节的检出率差异存在统计学意义;cmeB(P<0.05)基因在工业化养殖和自由散养中的检出率差异存在统计学意义;无耐药基因在不同规模、与居民生活区距离不同的养殖场间检出率差异存在统计学意义。
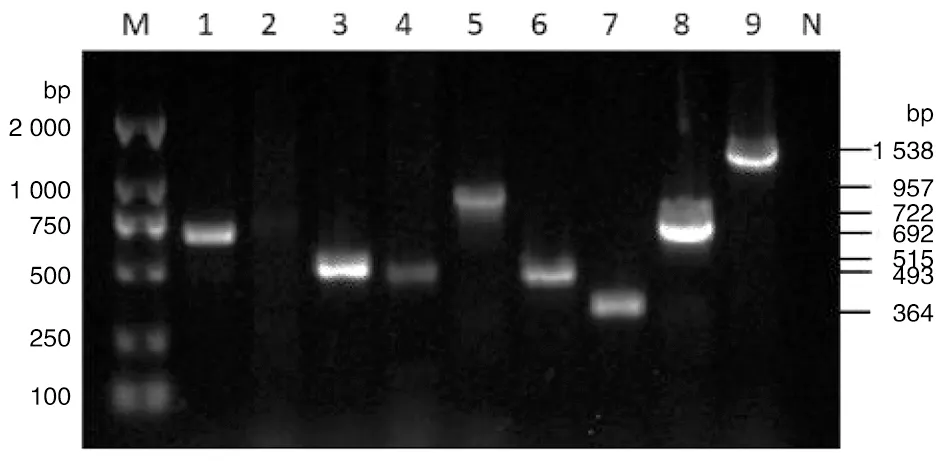
M:核酸分子量标准DL2000;泳道N:阴性对照;泳道1-9:弯曲菌分离株ermB、cfr、Tet(O)、blaOXA-61、cmeA、cmeB、cmeC、RE-cmeABC、aadE-sat4-aphA-3基因的PCR扩增结果图1 弯曲菌分离株耐药基因的PCR扩增结果Fig.1 PCR amplification of antibiotic resistance gene in Campylobacter isolates
2.4 耐药型和耐药基因的相关性 通过对耐药基因携带与耐药表型相关性分析可知,红霉素、阿奇霉素、泰利霉素、克林霉素、庆大霉素和链霉素耐药株中相关耐药基因检出率高于敏感株;而萘啶酸、环丙沙星、链霉素、氯霉素、氟苯尼考和四环素耐药株和敏感株之间相关耐药基因的检出率差异无统计学意义,耐药基因的携带与耐药表型无关(表4)。
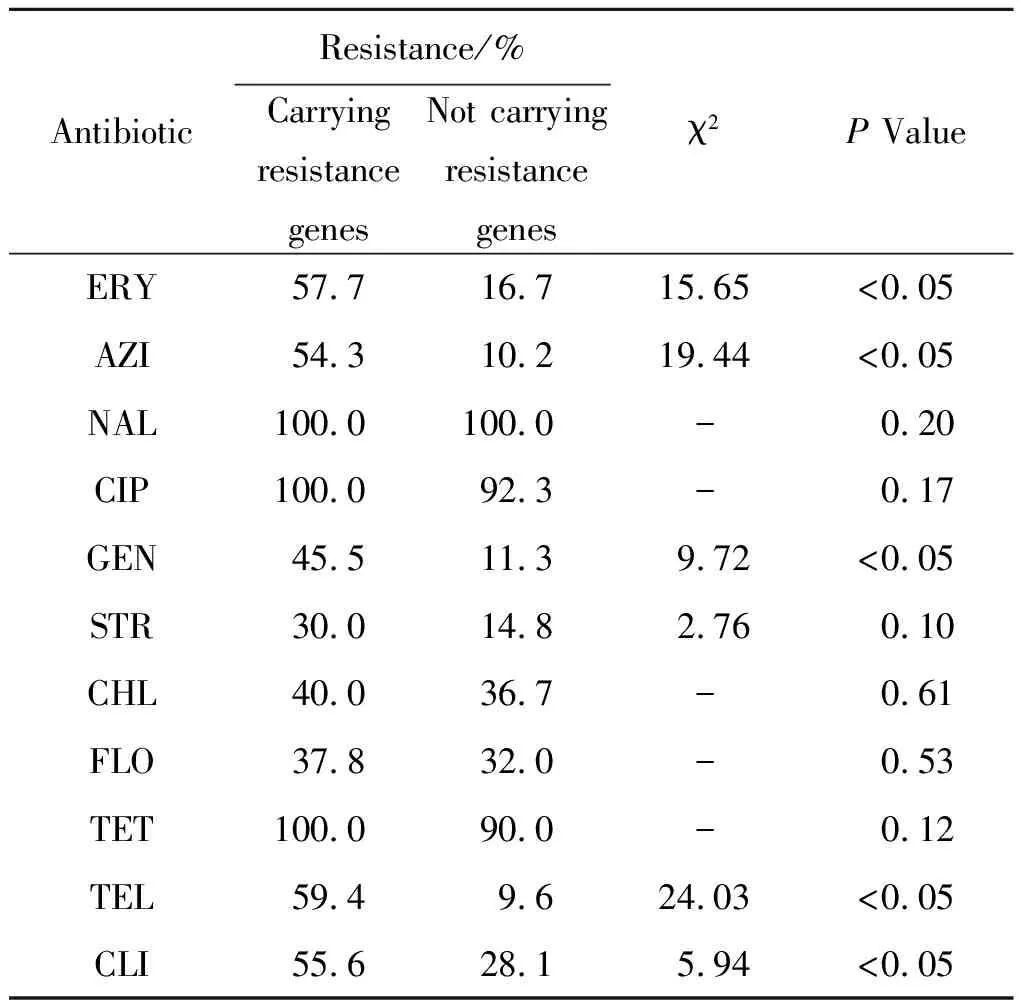
表4 比较耐药菌株中携带耐药基因的情况Tab.4 Comparison of resistance between the strains carrying and not carrying resistance genes
2.5 交叉耐药情况 应用热图表示不同抗生素药物的耐药相关性(见图2)。大环内酯类抗生素耐药菌株共61株,其中红霉素耐药26株,阿奇霉素耐药35株,交叉耐药率为74.29%,红霉素耐药与阿奇霉素耐药有关联性(χ2=52.72,P<0.05),r=0.79>0.7,呈高度相关;52株菌对氨基糖苷类抗生素耐药,“-”meansFisher’sexacttest。
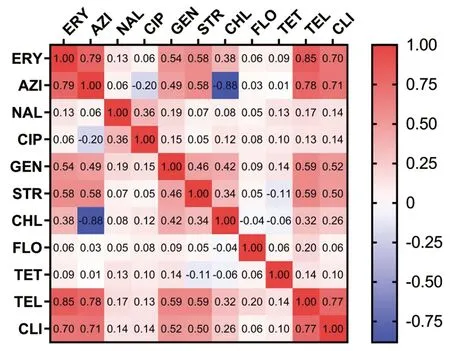
图2 不同抗生素耐药相关性热图Fig.2 Heat map of resistance to different antibiotics
其中22株对庆大霉素耐药,30株对链霉素耐药,交叉耐药率为30.77%,庆大霉素耐药与链霉素耐药有关联性(χ2=17.79,P<0.05),r=0.46>0.4,呈中度相关;氟喹诺酮类抗生素中萘啶酸与环丙沙星间呈弱相关(r=0.36),氯霉素类抗生素中氯霉素与氟苯尼考间呈弱相关(r=-0.04)。
3 讨 论
病原性弯曲菌是世界范围内引起人类胃肠炎的主要原因,家禽特别是肉鸡及其肉制品被认为是弯曲菌感染的重要来源。从肉鸡养殖、运输、屠宰、加工、储存、烹饪到餐桌的整个链条中,养殖过程中感染弯曲菌的鸡是传播病原菌、引起人类感染弯曲菌的重要源头,有必要了解养殖场中鸡源弯曲菌的流行情况。本研究中弯曲菌检出率达43.5%,低于西班牙(62%)、非洲布基纳法索(67.96%)的检出率[11-12],高于广西(2.86%)、河南(23.7%)的检出率[13-14],说明鸡源弯曲菌的地域流行特征明显。空肠弯曲菌和结肠弯曲菌检出率分别为18.9%和24.5%,与姚红等[14]及中国东南部[15]的空肠弯曲菌检出率高于结肠弯曲菌检出率的结果不同;但与摩洛哥北部的研究结果近似[16],且Wang等[17]分析2008—2014年间中国5个省份的鸡源弯曲菌分离株的流行特征,发现优势菌属由空肠弯曲菌向结肠弯曲菌转变,认为在抗生素选择压力下,结肠弯曲菌多重耐药率高于空肠弯曲菌,具有更强的适应性和更高的存活率,解释了结肠弯曲菌是优势菌属的原因。这与本次研究中贵州地区结肠弯曲菌检出率较高、多重耐药较严重的结果一致。
季节可能对鸡群内弯曲菌流行起直接或间接作用,颜卫等发现全年中鸡源弯曲菌携带高峰期是夏季(21.98%)[18],西班牙的相关研究发现秋季(31.3%)鸡群弯曲菌携带率高于春季(20.3%)[19],而本研究中春冬季和夏秋季间鸡源弯曲菌检出率差异无统计学意义,可能与贵州省平均气温低,且各季节气温变化不明显有关。
近年来,消费者对环境友好型产品的偏好增加了对自由散养禽类肉制品的需求。目前,肉鸡的养殖模式由工业化养殖向自由散养转变,普遍认为由于自由散养的鸡群与潜在污染环境密切接触,更易感染病原菌。在英国,自由散养的鸡群中95%~100%携带弯曲菌,工业化养殖的鸡群中55%携带弯曲菌[20];在南非,小型散养、商业散养、工业化养殖鸡群中弯曲菌的携带率分别为68%、47%、47%[21];在马来西亚,散养和封闭式饲养的鸡群中弯曲菌携带率分别为46.7%~86.7%和0%~6.7%[22]。本研究得出类似结果,自由散养鸡源弯曲菌的检出率显著高于工业化养殖的检出率,主要由于鸡有食粪的特性,从受感染的鸡中摄取排泄粪便是鸡群感染传播的主要途径,同时环境中啮齿类动物、苍蝇、其它昆虫等媒介生物对病原菌传播有一定的影响。此外,本研究发现养殖规模大小对弯曲菌感染有一定影响,养殖规模大的卫生管理措施相对完善,感染率较低。
Kaakoush等虽在种鸡群中发现了很高的弯曲菌检出率,但鸡蛋中弯曲菌的检出率极低[23],Agunos等[24]进一步从被检母鸡及子代中分离出的弯曲菌未发现遗传上的亲缘关系。而水平传播是弯曲菌在鸡群中定殖的重要途径[25],Schets等[26]在肉鸡、养殖场废水和地表水中检测到相同的STs,表明环境因素在弯曲菌传播过程中发挥关键作用。本研究中发现养殖场与居民生活区距离小于2.5km的养殖场中肉鸡弯曲菌携带率高于2.5km以外养殖场中肉鸡,可能由于离居民生活区较近的养殖场容易受到人类活动、牲畜(牛、羊、猪、狗)以及苍蝇等媒介生物的影响,其具体原因将进一步探讨。
在对全球中低收入国家动物源弯曲菌AMR的研究中发现,耐药率最高的是四环素(60%)和喹诺酮类(60%),红霉素的耐药率虽低于30%但高于高收入国家[6]。弯曲菌种类方面,本研究中空肠弯曲菌和结肠弯曲菌耐药水平位于前3均为萘啶酸、四环素和环丙沙星,且萘啶酸和四环素的耐药率高达80%以上,耐药情况更为严重,与付燕燕等[27]研究结果一致。同时,本研究发现来自不同地理区域、养殖方式和规模大小的弯曲菌耐药水平位于前三的均为萘啶酸、四环素和环丙沙星,说明贵州省禽类养殖环节药物使用或抗生素污染在地域上差异不明显。
目前治疗弯曲菌感染引起肠胃疾病的首选药物是大环内酯类或氟喹诺酮类,对此类药物的高耐药水平将不利于临床治疗弯曲菌病。本研究中结肠弯曲菌对抗生素的耐药率高于空肠弯曲菌,与伊朗的一项系统评价结果相反,但与国内外大部分研究结果相似,原因可能是不同国家、地区治疗动物疾病或在饲料中添加的抗生素的种类和用量标准不同[15, 28-29]。2020年北京报道的一起严重肠胃炎暴发中所有结肠弯曲菌分离株均对萘啶酸、环丙沙星和四环素具有抗性,可见结肠弯曲菌耐药性需要引起高度重视[7]。2018版《中国抗菌药物管理和细菌耐药现状报告》显示住院患者抗菌药物使用率以贵州省最高(46.5%),抗生素的广泛使用和严峻的耐药现状将不利于临床上弯曲菌病的治疗。
本研究中81.0%的分离株呈多重耐药,与温州、江苏、中国东南部研究情况相比,多重耐药现象更为普遍[15,29-30],且发现红霉素与阿奇霉素、庆大霉素与链霉素呈中度以上的交叉耐药,提示当弯曲菌对两者间其中一种抗生素耐药时,应避免使用另一种抗菌药物。关于弯曲菌的耐药机制目前仍在探索,本研究发现红霉素、阿奇霉素、泰利霉素、克林霉素耐药表型与耐药基因存在呈正相关,但萘啶酸、环丙沙星、链霉素、氯霉素、氟苯尼考、四环素、庆大霉素抗生素耐药表型与耐药基因无相关性。该结果可能与耐药基因位于质粒等其它移动元件上并未检出或耐药基因未表达等原因有关。为减少耐药菌株的产生,应提倡有指征地合理用药,实施抗生素轮换策略。同时,有必要研发非抗生素类抗感染药物,以扩大药物种类;探索控制耐药质粒在细菌间转移的手段,开发外排泵抑制剂;将抗生素与其他技术(例如纳米技术)结合,改善抗生素靶向性,同时避免环境中亚抑菌浓度的抗生素大量残留,以减少抗生素耐药性的产生。
本研究初步了解了贵州省鸡源弯曲菌的污染状况,明确了耐药表型及耐药基因流行情况,为抗生素在禽类养殖中的规范使用以及弯曲菌病的临床治疗提供参考依据,为进一步探究耐药机制提供实验室数据。今后的研究中,应将“OneHealth”理念贯彻在预防控制弯曲菌感染整个环节中,综合考虑人、动物、环境、病原等影响因素,多维度应对病原弯曲菌危害的公共卫生问题以促进人、动物、环境共同健康。
利益冲突:无
引用本文格式:李轩,谢春,周藜,等.贵州省鸡源弯曲菌的流行现状及抗生素敏感谱研究[J].中国人兽共患病学报,2021,37(11):995-1002,1007. DOI:10.3969/j.issn.1002-2694.2021.00.139

